微生物修复剂S35对氯氰菊酯污染棚室土壤修复研究
陈 锐, 陈智坤,瞿 佳, 门 欣,孙晓宇 ,邓 媛,赵玲侠,沈卫荣
(1.陕西省微生物研究所微生物资源研究中心, 陕西 西安 710043; 2.陕西省科学院秦岭天然产物工程中心, 陕西 西安 710043; 3. 陕西省科学院土壤资源与生物技术应用重点实验室,陕西省西安植物园(陕西省植物研究所),陕西 西安 710061 )
氯氰菊酯是目前最为广泛使用的菊酯类杀虫剂之一。使用后,残留农药大部分进入土壤或水体。残留于土壤中的氯氰菊酯不仅会改变土壤酶活[1],影响土壤微生物菌群结构[2~3],影响作物生长[4],改变土壤中无脊椎物的数量[5],对脊柱动物具有发育毒性[6~7],可促进脂肪积累并导致小鼠肥胖[8]。人类长期接触可能引起皮质神经元凋亡[9]、帕金森症[10]、卵巢功能障碍[11]。针对可能存在的潜在危害,研究学者提出利用微生物的生命代谢活动,在污染地区使用微生物菌剂,使其在土壤中降解特定的污染物[12~13],可在短时间内加速土壤中污染物的降解,恢复土壤健康,降低农产品安全风险[14]。目前已报道的氯氰菊酯降解微生物多集中于细菌类微生物上[15~22],不产生芽孢及可能属于条件致病性微生物限制了这类降解细菌的应用开发。降解微生物在土壤中能否定殖也决定了该类微生物在土壤环境中发挥其降解能力的关键。在前期自70余份土壤样本中分离获得可高效降解氯氰菊酯菌株米曲霉(Aspergillus oryzae)SSCL-3 及草酸青霉(penicillium oxalicum)SSCL-5,经紫外分光光度法及HPLC验证其在无机盐培养基(含氯氰菊酯400mg/L)中,对氯氰菊酯的降解率达85%以上[23~24]。这两株降解微生物属于真菌微生物,不具致病性,可产生大量孢子适于应用开发。这两株菌对其他菊酯家族成员也有一定的降解效果并且其降解类型不完全重叠,为验证其在土壤中降解氯氰菊酯的实际效果,将该两株菌制备成复合菌剂S35,通过40 d棚室土壤田间试验,监测土壤中氯氰菊酯残留,菌剂S35中效能微生物SSCL-3及SSCL-5在土壤中的定殖,土壤真菌多样性,土壤理化指标及观测作物生长的变化,对菌剂S35的应用开发做全面的评估。
1 材料与方法
1.1 菌剂制备
分别将SSCL-3及SSCL-5斜面孢子接种于均匀接种于麸皮稻壳固体培养基。
SSCL-3固体培养基:麸皮60%,稻壳5%,水30%,豆粕 0.112%,葡萄糖0.5%,大米粉0.2%,植物油0.5%,磷酸二氢钾0.1%,硫酸镁0.05%。培养:温度28℃,pH6,发酵接种量10-4个孢子/100mL,培养192 h。
SSCL-5固体培养基:麸皮55%,稻壳10%,水30%,豆粕 0.112%,葡萄糖0.5%,大米粉0.2%,植物油0.5%,磷酸二氢钾0.1%,硫酸镁0.05%。培养:温度28℃,pH7,发酵接种量10-4个孢子/100 mL,培养168 h。
将培养物低温烘干约72 h(<45℃)。在粉碎机中以间歇模式进行粉碎至约60目大小。以SSCL-3粉碎物:SSCL-5粉碎物:麸皮:高岭土=1∶1∶10∶8,搅拌混合均匀,获得固体制粉状制剂,制剂自封袋分装,在常温条件下保存。
1.2 田间试验设计
田间试验设置4 个组,每组用地长5 m,宽4 m。分别为S35对照组(菌剂对照组)、S35-SY修复组(修复实验组)、SY对照组(农药对照组)及CK对照组(空白对照)。菌剂及农药用量如下:
S35组(菌剂S35施用400 g/m2用量),S35-SY组(菌剂S35施用400 g/m2用量,氯氰菊酯农药大功达10%乳油 450 mL/m2使终浓度达到约100 mg/kg),SY组(氯氰菊酯农药100 mg/kg)。农药及菌剂施用后翻耕深度约25 cm,6 d后栽种番茄(金鹏1号)作为观测作物,每7~10 d浇水一次。
1.3 土样采集
从施工日开始作为0d,每10天取样一次,至50 d取样结束,共计取样6次。五点取土法,取土深度5~20 cm,取样后合并成为1个样本,每组取平行3个,取样总数为72个。
1.4 土壤中氯氰菊酯残留量的测定
土壤中氯氰菊酯的提取及测定 称取土壤15 g于250 mL三角瓶,加入5 g无水硫酸钠和50 mL乙酸乙酯,震荡萃取30 min,萃取3次,合并萃取液。将萃取液过无水硫酸钠后,35℃旋转蒸发仪蒸干,用15 mL乙腈定容。HPLC HP-1100 C18柱,柱温35℃ 波长235 nm,流动相:乙腈∶水=80∶20,流速 1 mL/min,上样量10 uL[25]。
1.5 功能菌株在土壤中的定殖监测
称取土壤样本5 g加入45 mL无菌生理盐水中梯度稀释,将10-3,10-4,10-5的稀释液涂布于含氯氰菊酯的PDA平板上,28℃,静置培养 48 h,观察平板上菌落的生长。
1.6 土壤样本微生物多样性监测
取土壤样本每份4 g,置于无菌EP管,干冰寄送至联川生物(Omicstudio)进行土壤样本的基因组提取,提取后进行高通量 ITS V3-4区测序,进行土壤真菌多样性分析。
1.7 土壤样本理化指标监测
取土壤样本1kg寄送至中科院水土保持研究所进行土壤理化指标测定。测定指标包括土壤土壤含水量(烘干法)、含盐量(土壤总盐量测定法)、pH(玻璃电极法)、NPOC(重铬酸钾容量法—外加热法)、微生物碳(氯仿熏蒸浸提法)、全氮(凯式定氮法)、硝态氮(流动分析法)、铵态氮(流动分析法)、微生物氮(氯仿熏蒸浸提法)、全磷(钼锑抗比色法)、速效磷(NaHCO3浸提钼锑抗比色法)、速效钾(NH4OAc浸提,火焰光度法)的测定。
1.8 作物指标测定
从番茄种下第2日起进行番茄苗株高及叶片大小的测定。番茄苗随机选取5株量其整株的高度。叶片随机选中段分支5个,测量第1叶片大小。观测叶片上是否有异常色斑等病变。每10天测定一次,测定至50 d后结束。
2 结果与分析
2.1 氯氰菊酯残留量监测
土壤样本经乙酸乙酯萃取后,HPLC检测其残留含量。其结果如下图所示,初始氯氰菊酯浓度约为85 mg/kg以上,经过40 d修复期后,S35-SY修复组土壤中残留的氯氰菊酯浓度降至9.25 mg/kg,下降了约89%,SY对照组残留量为48.34,下降了约47%。与对照相比具有显著差异(T-test p=0.04)。
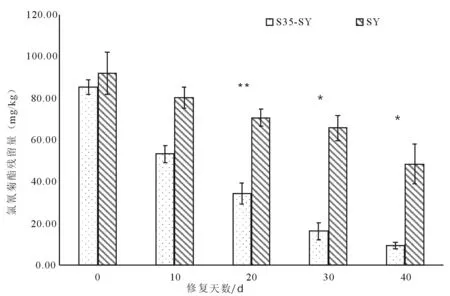
注 *同列差异达显著水平(P<0.05),**同列差异达极显著水平(P<0.01),
2.2 菌株SSCL-3及SSCL-5在土壤中的定殖观察
通过重新从土壤中分离培养可在氯氰菊酯平板上正常生长的真菌微生物,来观察菌株SSCL-3及SSCL-5在40 d修复过程中在土壤中的定殖过程(图2)。结果表明0~40 d,加入菌剂的S35对照组及S35-SY修复组均可观察到类似于草酸青霉及米曲霉形态的真菌菌落生长,而在没有菌剂的SY对照组则未观察到真菌菌落的生长。

图2 菌剂S35在土壤中的定殖
2.3 菌剂微生物的定殖监测
进一步通过高通量测序分析可以更加准确的了解菌剂S35在土壤中的定殖情况。如图3所示,S35对照组及S35_SY修复组在种水平上持续检出黄曲霉(Aspergillus flavus),而SY对照组及CK对照组黄曲霉水平则非常低。黄曲霉与米曲霉在基因测序中几乎无法区分,这应当是外源添加米曲霉后定殖的结果。在S35对照组中, 0 d及10 d可以监测到草酸青霉(Penicillium oxalicum),在S35_SY修复组中0 d至40 d均可以检出一定比例的草酸青霉(Penicillium oxalicum),当土壤中含有一定浓度的氯氰菊酯残留时有利于草酸青霉的定殖。

图3 种水平的土壤样本中目标菌株的检出
在种水平上比较不同天数相对含量有差异的微生物(如图4所示),米曲霉及草酸青霉在S35对照组,S35-CY修复组与SY对照组,CK对照组具有显著差异。通过高通量测序结果可以认为外源引入的米曲霉(Aspergillus oryzae)SSCL-3在土壤中的定殖与土壤残留氯氰菊酯无相关性,但草酸青霉SSCL-5可能具有一定的相关性。
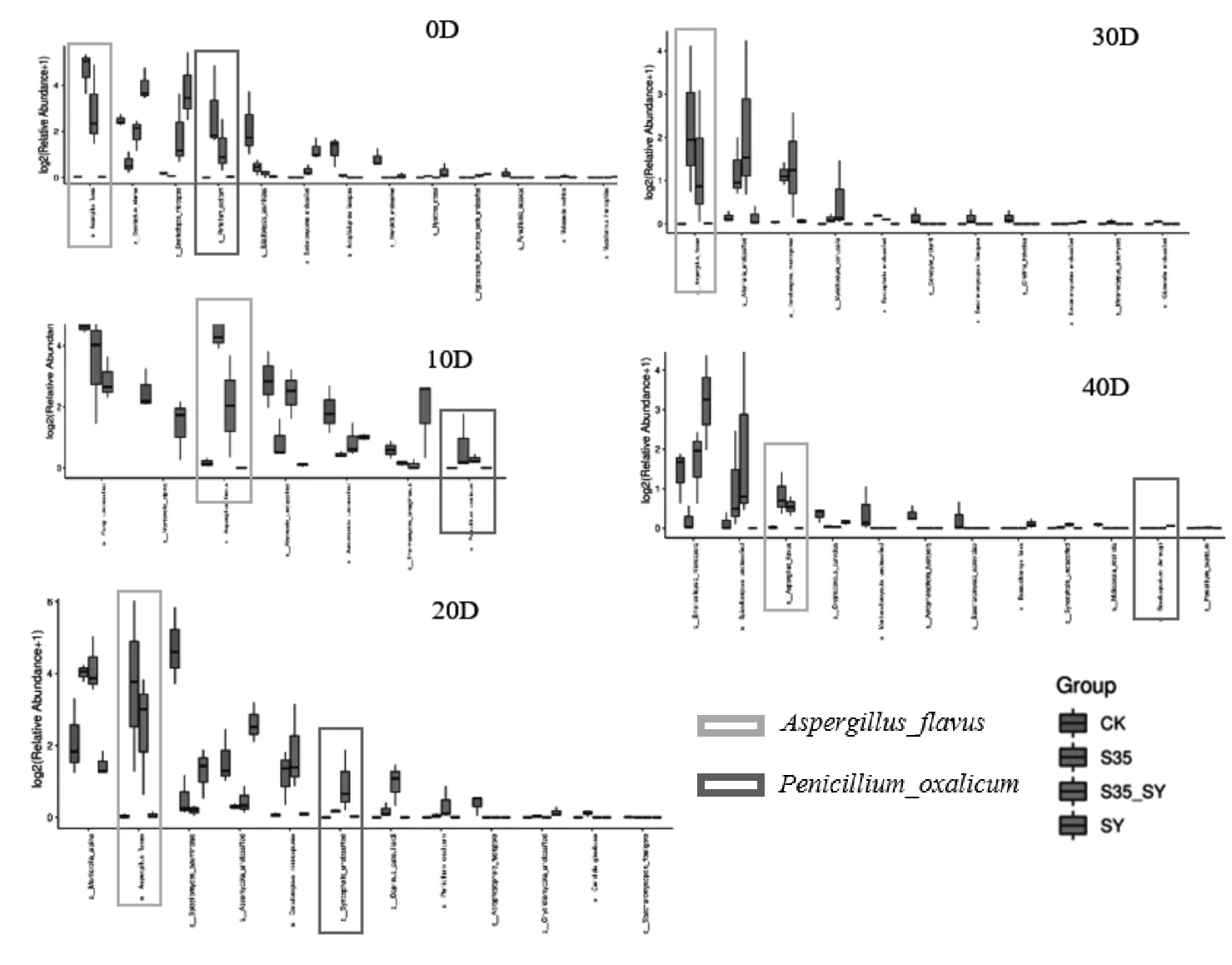
图4 种水平上不同天数测序相对量差异显著微生物
2.4 土壤真菌微生物多样性监测
土壤真菌的α多样性主要通过Chao1,Shannon,Simpson等指数变化来反应,测序结果如图5所示,S35对照组、S35-SY修复组及SY对照组土壤的Chao1, Otu, Shannon, Simpson指数均比对照低,随着天数的增加S35对照组,S35-SY修复组微生物多样性指数均有所恢复,SY对照组恢复则的较慢。通过多样性测序结果可以认为菌剂的加入有助于土壤微生物菌群的恢复。
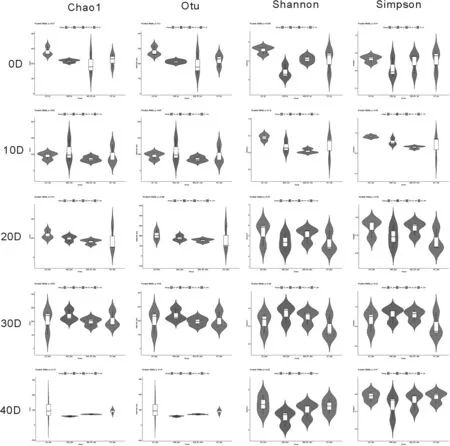
图5 土壤修复过程中真菌α多样性变化监测
真菌群落属水平上的聚类分析结果如图6所示,基本聚为两簇,A组中为S35-SY 0D , S35-SY 10D, S35-SY 20D,S35 0D, S35 10D, S35 20D, S35 30D属于添加了修复菌剂的S35早中期样本,B组中为CK 组 SY组以及S35-SY 30D , S35-SY 40D,属于加入菌剂后期样本与对照,聚类显示在修复初期由于菌剂的加入确实对土壤微生物菌群多样性产生了影响,但到修复后期逐步恢复与对照接近。菌剂对土壤真菌多样性的影响是暂时性的。

图6 修复土壤真菌群落聚类图
2.5 土壤理化指标监测
对5 -20 cm 土壤样本进行含水量、pH、土壤有机质(SOM)、有机碳(SOC)、全氮(Total-N)、铵态氮(NH4-N)、硝态氮(NOx-N)、微生物氮(TNb)、全磷(Total-P)、速效磷(Olsen-P)、速效钾(Olsen-K)及土壤团聚体(GMD)指标的监测。土壤理化结果显示(表1),除有机碳,全氮,全磷,速磷及速钾以外其他土壤样本的理化指标无差异。分析认为这些差异与菌剂辅料及农药有关,而与微生物本身无相关性。菌剂辅料中的麸皮、高岭土等成分以及掺入土壤的氯氰菊酯增加了土壤有机碳,氮,磷,钾的水平。
2.6 作物生长的监测
经过50 d对观测作物番茄的监测,其植株及叶片的生长未受到氯氰菊酯菌剂S35的影响(图7),在植株及叶片上未观察到有病变,在后期其挂果及产果过程中也未观察到与对照组有差异,S35菌剂对观测作物番茄生产无不良影响。
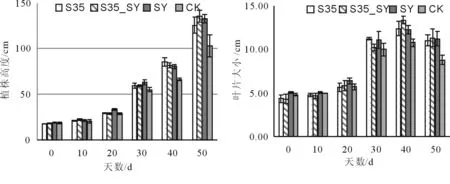
图7 菌剂对作物生长的影响
3 讨论
拟除虫菊酯是具有低哺乳动物毒性的合成有机杀虫剂,已在全世界的农村和城市地区广泛使用,拟除虫菊酯已在多种环境包括土壤,水,沉积物和生物中被广泛检测到。在长江三角洲的农业土壤中调查四种常见拟除虫菊酯的污染水平,241个土壤样品中检出了拟除虫菊酯(检出率88.8%)。四种拟除虫菊酯的平均浓度:联苯丙菊酯(4.92 ng / g)、氯氰菊酯(1.10 ng /g)、溴氰菊酯(0.89 ng/g)、氯氟氰菊酯(0.20 ng/g)[26]。广州地区的调查显示在水和沉积物中都观察到八种拟除虫菊酯浓度的显着增加[27]。对中国坚果种植土壤中的29种农药残留进行了调查。在65.8%的土壤中检出的六种拟除虫菊酯(联苯菊酯,联苯丙菊酯,氯氟氰菊酯,氯氰菊酯,氰戊菊酯和溴氰菊酯)的残留量为1.5μg/ kg至884.3μg/ kg[28]。在中国20个省份的温室和露天土壤中拟除虫菊酯的水平和分布调查中,拟除虫菊酯(PYs)的总浓度在1.30到113 ng / g之间,温室中发现的污染要比在露天田地高。80%的温室中总拟除虫菊酯的含量显着高于附近的田间土壤(p<0.05)。在中国北方省份PYs的污染普遍更为严重[29]。
残留拟除虫菊酯类农药对环境生物产生威胁,对人类具有发育毒性、生殖毒性,神经毒性等问题,快速降残留拟除虫菊酯水平有利于生态及人类健康发展。去除环境中残留的拟除虫菊酯类农药的残留可采用物理、化学及生物学的方法,例如:冷等离子体[30],光解[31],海藻[32]、植物[33]、微生物吸收及降解[34]等手段。目前研究报道显示微生物降解手段安全有效并且廉价,最具有应用潜能。可在液体介质中有效降解拟除虫菊酯的微生物有:芽孢杆菌属[35],短杆菌属[15],假单胞菌属[16],沙门氏菌属[17]、克雷伯氏菌[18]和鞘氨醇菌属[19]等细菌以及黑曲霉[20]、白腐真菌[21]、曲霉[22]等真菌。
土壤中可有效去除拟除虫菊酯的微生物研究主要集中在细菌上,最高可将200 mg/kg的氯氰菊酯在42 d降解90%[15]。在本研究的前期初筛中也分离出可降解氯氰菊酯的假单胞属、鞘氨醇菌属及沙雷氏属等细菌。但考虑到部分细菌菌株属于条件致病菌,一方面可能造成健康风险,另一方面可能会导致土壤微生物耐药性加重。另一些筛选出的细菌菌株不产生芽孢,在环境中抗逆性较差,因此从实际应用及生物安全角度考虑,最终采用米曲霉及草酸青霉菌株作为菌剂出发菌株。在已报道的真菌降解土壤拟除虫菊酯农药的研究中,已经发现真菌具有比细菌更好的农药降解潜力,其代谢和生态潜力更适合生物修复和废物处理[36~37]。在一项在土壤中进行的生物强化实验中,真菌曲霉可显著降低100 mg/kg氯氰菊酯残留量及其半衰期[16]。本研究基本达到类似水平。在前期的土壤盒及盆栽实验过程中同时证实[23~24],土壤中氯氰菊酯的降解效率与土壤活菌量,土壤温度高度相关。灭菌的土壤其农药降解速度显著低于不经灭菌的土壤。土壤修复过程中温度过低也会影响其代谢速率。前期实验中证实在其他类型的菊酯类农药中本菌剂的两个微生物菌株具有不同的耐受特性,是否可降解其他拟除虫菊酯类农药有待下一步研究验证。
4 结论
通过在土壤中添加氯氰菊酯并施用菌剂S35,定期监测土壤中残留氯氰菊酯,功能菌株定殖,土壤真菌微生物多样性,土壤理化指标及种植作物生长,从而评估菌剂施用效果及其使用安全性。初始土壤中氯氰菊酯浓度约为85 mg/kg以上,经过40 d修复期后,施用菌剂S35的土壤中氯氰菊酯浓度降至9.25 mg/kg,下降了约89%。对照组残留量为48.34 mg/kg,下降了约47%。与对照相比具有显著差异(T-test p=0.04)。复合菌剂S35中的效能微生物SSCL-3,SSCL-5可在土壤中稳定的定殖并发挥降解氯氰菊酯的作用。土壤真菌菌群由于S35菌剂的加入与对照相比有显著的下降,S35菌剂的施用可逐步改善污染土壤真菌微生物多样性。土壤理化指标未受到菌剂S35的负面影响。观测作物番茄作物在株高,叶片大小均无差异。通过田间土壤实验证实氯氰菊酯降解菌剂S35在土壤中具有较好的降解氯氰菊酯效果,并改善污染土壤真菌微生物多样性,对土壤及观测作物无负面影响。

