三(2-氯乙基)磷酸酯(TCEP)对大菱鲆(Scophthalmus maximus)免疫相关基因表达的影响
刘聪,衣丹,柴迎梅,丛柏林*
(1.山东 大学 海洋学院,山东 威海 264200;2.自然资源部第一海洋研究所,山东 青岛 266061)
三(2-氯乙基)磷酸酯(Tris(2-carboxyethyl)phosphine,TCEP),分子式为C6H12Cl3O4P,分子量为285.31,属于有机磷酸酯(organophosphate esters,OPEs)。2017 年7 月底TCEP 在内的7 种有机磷酸酯类阻燃剂被联合国环境署国际化学污染小组列在45 种内分泌干扰物(Endocrine Disrupting Chemicals,EDCs)清单中[1]。EDCs 作为类激素,在生物体内较低剂量也能产生较强的生物学效应[2]。多种EDCs 通过各种途径汇集于水体环境后会通过食物链的生物浓缩和放大效应对水体生物和养殖动物产生影响[3]。目前随着使用量的增加及在不同水体环境中的积累,TCEP 已成为各水系中普遍存在的新型污染物,其危害已被广泛关注[4-9]。目前包括TCEP 在内的OPEs 类化合物的毒性研究刚刚开始,相应的环境质量标准的缺乏阻碍了对这类化合物进行高效化学污染管理。而TCEP 这类物质在自然界中稳定存在,且能毒性累积,针对其大量使用的现状,我们急需认清TCEP 的环境毒性[10]。TCEP 可对多种生物产生危害,如TCEP 会造成鱼类内分泌干扰毒性以及神经毒性[11-12],还会造成鲑鱼(Oncorhynchus keta)氧化应激反应和脂质过氧化[13-14]。在无脊椎动物中,TCEP 会造成线虫(Caenorhabditis Elegans)运动能力下降,损害线虫神经元,同时具有诱发帕金森病的神经毒性[15]。在哺乳动物中,TCEP 可造成大鼠(Rattus norvegicus)肝肾免疫器官毒理损伤[16],造成小鼠(Mus culus)氧化应激和内分泌紊乱[17]。由此可见,TCEP 可造成多种动物内分泌干扰及免疫器官损害。
大菱鲆(Scophthalmus maximus)俗称“多宝鱼”,肉质鲜嫩、营养高、易消化、经济效益高,是国内外公认的优质海水养殖鱼类[18-19]。它属冷水性鱼类,对海水水质要求较高[20]。随着工业及生活污水排放量的增加,海水中累积的各类污染物给大菱鲆养殖行业带来了严重威胁。目前,常见的农药残留、重金属污染等危害已被广泛关注和研究,并采取了相应解决措施,而近些年来出现的新型污染物对大菱鲆养殖业的潜在危害尚未被完全认知。TCEP 对大菱鲆免疫的影响尚未见报道。
近年来随着TCEP 使用量增加,在海水中监测到的积累量不断升高,对大菱鲆等海水养殖鱼类的威胁性增加。我们通过测定大菱鲆的TCEP 半致死浓度(lethal concentration 50%,LC50)[21]以及安全浓度(safe concentration,SC)[21],评估TCEP 对大菱鲆的生物毒性效应,这是毒理学研究的有效方法。已有研究表明,肿瘤坏死因子alpha (TNF-α) 基因在脂多糖LPS 刺激虹鳟(Oncorhynchus mykiss)巨噬细胞反应和组织相容性复合体alpha (MHC-Ⅱ α)基因表达时起增强剂的作用[22]。在牙鲆(Paralichthys olivaceus)、金枪鱼(Thunnus albacores)和斑马鱼(Danio rerio)等硬骨鱼不同器官中,MHC-Ⅱ α和TNF-α的基因表达具有相关性[23-25]。所以我们将免疫相关因子MHC-Ⅱ α和TNF-α[26-29]作为共同生物标志物,评估TCEP 对大菱鲆免疫系统的影响。以期为大菱鲆健康养殖提供科学依据,为大菱鲆环境污染物检测提供分子标记参考。
1 材料和方法
1.1 样品和试剂
实验用大菱鲆于2019 年10 月11 日购于山东烟台宗哲水产养殖公司,大菱鲆幼鱼先后2 批共400 条,生长期4 个月,未达到性成熟,单条体长(17±2) cm,体重(56±4) g,用于测定半致死浓度LC50及免疫相关基因变化;大菱鲆成鱼1 批,共50 条,生长期1 a,已达到性成熟,单条体重约600 g,约为幼鱼的10 倍,用于测定半致死浓度LC50。实验用海水在胶州湾岸边由水泵抽取,并用纱布进行过滤除去杂质。实验室内大菱鲆的培养条件为盐度(34.2±0.2)、温度(16±2)℃、pH(7.8±0.2)、溶氧质量浓度(7.5±0.2) mg/L。在实验室培养条件下养殖7 d 后开始实验,利用TCEP 进行胁迫处理。实验开始前2 d 停止喂食,停食期间大菱鲆无死亡。实验动物处置方法符合动物伦理学标准。三(2-氯乙基)磷酸酯(TCEP)购于上海麦克林生化科技有限公司,纯度99%(CAS 编号:115-96-8)。
1.2 TCEP 对大菱鲆的半致死浓度LC50 和安全浓度的测定
半致死浓度(LC50)是衡量水体中污染物对生物毒性大小的重要参数,安全浓度(SC)是指长期暴露但不会产生不良效应的指标。
2003 年Fisk 等研究添加TCEP 对鱼类96 h 的LC50数据范围为6.30~250.00 mg/L[30]。我们在此基础上进行了预实验,并结合所购买的TCEP 的质量浓度(1.39 g/mL),将实验组TCEP 质量浓度分别设定为83.40 mg/L、97.30 mg/L、132.10 mg/L、152.90 mg/L、187.70 mg/L、197.40 mg/L 和228.20 mg/L。取8 个68 L 培养箱,分别注入30 L 过滤海水,每个培养箱放置10 条大菱鲆幼鱼,实验组加入不同质量浓度梯度的TCEP,对照组不添加TCEP。添加TCEP 时少量多次添加、不断搅拌致溶液呈透明,水面无油滴状,保证其在海水中充分溶解。在实验过程中实验组每隔24 h 观测记录一次大菱鲆的死亡率,对照组大菱鲆未出现死亡现象。
统计不同质量浓度梯度TCEP 处理大菱鲆幼鱼24 h、48 h、72 h 和96 h 时的死亡数量,通过寇氏法[31]计算半致死浓度LC50及标准误。采用24 h 时幼鱼的TCEP 半致死浓度对40 条大菱鲆成鱼进行毒性试验。安全浓度(SC,mg/L)采用Turubell 氏公式[31]计算:

式中:A为24 h LC50;B为48 h LC50。数据统计和计算采用Excel 软件[32],数值=平均值±标准差(n=3)。
1.3 MHC-Ⅱ α和TNF-α 基因表达的测定
鱼类主要组织相容性复合体(major histocompatibility complex,MHC)参与调节机体免疫和激发机体特异性免疫反应[26]。MHCⅡ类分子不仅能识别和清除抗原,还参与和调控机体免疫应答反应[27]。鱼类MHCⅡ类分子主要由α 链和β 链异二聚体组成,与哺乳动物的MHC-Ⅱ α 在跨膜区保守区存在差异[28]。肿瘤坏死因子α(TNF-α)主要存在于动物血清中,具有杀伤肿瘤细胞、抑制肿瘤细胞增殖的作用[29]。
根据我们测定获得的24 h 时TCEP LC50,设置实验组的TCEP 质量浓度分别为,设不添加TCEP 的海水对照组。每个箱内放入14 条大菱鲆幼鱼。在TCEP处理3 h、6 h、12 h 和24 h 后,从各实验组随机捞取3 条幼鱼,经20 mg/L 丁香酚麻醉后[33],取脾脏、头肾、鳃和肠,取样后将3 条鱼的相同组织混合,立刻用液氮冷冻。采用Trizol®Reagent(上海Invitrogen 公司生产,编号15 596 026)和PrimeScript RT®reagent kit with gDNA Eraser(大连Takara 公司生产,编号RR047A),参照说明书提取大菱鲆幼鱼的mRNA 并反转录为cDNA。
利用Primer5.0 软件设计β-actin,MHC-II ɑ和TNF-ɑ基因(Gene Bank 序列号分别为AY008305.1,DQ094170.1,FJ654645.1)的引物[34]:β-actinF:TGTCCCTGTATGCCTCTGGTCG,β-actinR:CAGTGGTGGTGAAGGAGTAGCC,MHC-II ɑF:CTCAACATTCCCTATCCCAACA,MHC-II ɑR:CAATAGTCAGACCCAGTCCACA,TNF-ɑF:CACAG GATATGGCGGTACTCG,TNF-ɑR:AGCTCGGACAGCATGTTGGT。引物由生工生物工程(上海)股份有限公司合成。
将同一条件下处理的3 条幼鱼不同组织所获得的cDNA 混合后作为模板,采用MX3005P 荧光定量仪(美国Stratagene 公司生产)进行实时荧光定量PCR(quantitative reverse transcription-PCR,qRT-PCR)分析。采用SYBR Premix Ex Taq II(大连Takara 公司生产,编号RR820A)试剂盒,扩增体系:SYBR®Premix Ex Taq II(Tli RNaseH Plus)(2×),10μL;PCR Forward Primer(10μmol/L),0.8μL; PCR Reverse Primer(10μmol/L),0.8μL ;ROX Reference Dye(50×),0.4μL; 1× DNA 模板,2.0μL; dH2O(灭菌蒸馏水) 6.0μL;总计20.0μL 的体系。扩增条件:预变性 95 ℃ 30 s;95 ℃ 5 s,55 ℃ 15 s,72 ℃ 10 s,40 个循环;熔解曲线分析 95 ℃ 1 min,55 ℃30 s,95 ℃ 30 s。采用MxPro 软件包对溶解曲线进行数据采集和结果分析[35],MHC-II ɑ,TNF-ɑ和β-actin基因的溶解曲线呈单一峰值,且荧光定量Ct 值范围为15~35,说明qRT-PCR 实验体系可靠。以β-actin为内参基因,采用2−ΔΔCt方法[36]计算MHC-Ⅱ α和TNF-ɑ基因相对表达量,数值=平均值±标准差(n=3)。采用SPSS 17.0 软件对实验数据进行t检验[37],p<0.05 为显著性差异,p<0.01 为极显著性差异。
2 结果与分析
2.1 TCEP 对大菱鲆的LC50 和安全浓度的影响
不同质量浓度梯度TCEP 条件下24 h、48 h、72 h 和96 h 的大菱鲆幼鱼死亡率数据见表1。幼鱼死亡率随TCEP 质量浓度的增加而升高。24 h、48 h、72 h 和96 h 时大菱鲆幼鱼死亡率曲线见图1。
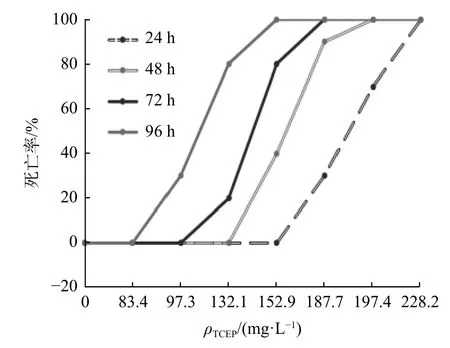
图1 不同TCEP 质量浓度梯度和处理时间对大菱鲆幼鱼死亡率的影响Fig.1 Effect of TCEP concentrations and treatment times on the mortality rate of Scophthalmus maximus
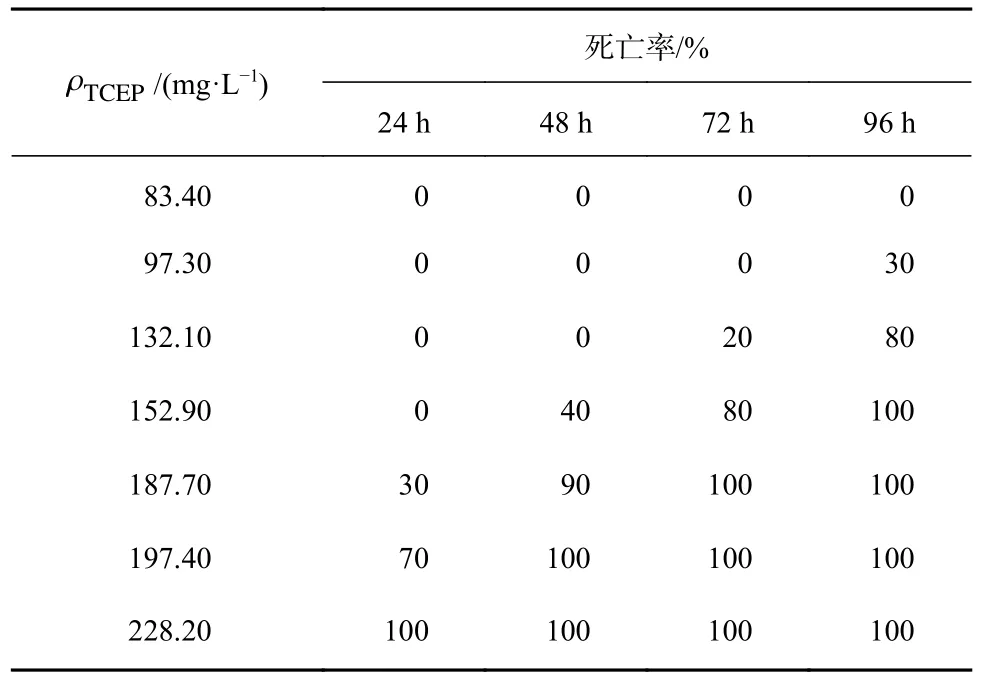
表1 不同质量浓度梯度TCEP 胁迫大菱鲆幼鱼的死亡率Table 1 Death rate of juvenile Scophthalmus maximus treated with different mass concentrations gradient of TCEP
通过寇氏法[31]计算表中数据可知,大菱鲆幼鱼在TCEP 处理24 h、 48 h、72 h 和96 h 时的LC50分别为190.76 mg/L(24 h)、159.94 mg/L(48 h)、140.70 mg/L(72 h)和110.71 mg/L(96 h)。标准误分别为0.027 2、0.012 1、0.012 0、0.015 4。对照组大菱鲆幼鱼无死亡现象。以190.76 mg/L 质量浓度的TCEP 处理大菱鲆成鱼24 h 时,其死亡数量正好达到全部大菱鲆成鱼数量的50%,说明大菱鲆成鱼和幼鱼的LC50相当。根据 Turubell 氏公式计算得ρSC为33.60 mg/L。
2.2 TCEP 对大菱鲆幼鱼MHC-Ⅱ α和TNF-α 基因表达的影响
2.2.1MHC-Ⅱ α基因的表达
添加不同质量浓度TCEP 胁迫处理的大菱鲆免疫相关组织中MHC-Ⅱ α基因表达变化如图2 所示。分别添加23.85 mg/L、47.69 mg/L 和95.38 mg/L 的TCEP 后,3 h、6 h、12 h 和24 h 时内大菱鲆幼鱼脾脏、头肾、鳃和肠组织中的MHC-Ⅱ α基因相对表达量较对照组都显著或极显著提高。
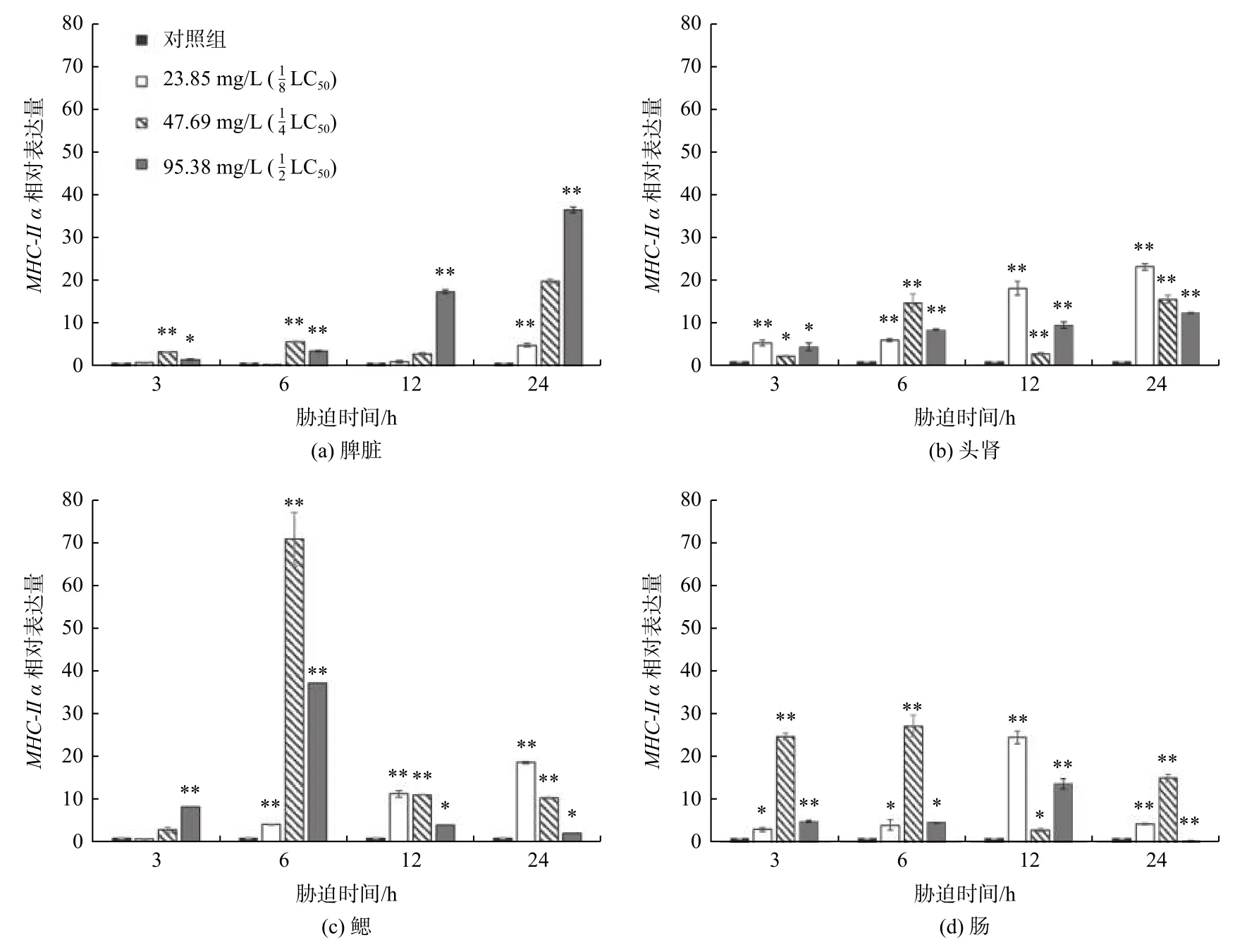
图2 大菱鲆主要组织相容性复合体基因MHC-Ⅱ α 在脾脏、头肾、鳃和肠组织中随胁迫时间的相对表达(*表示p<0.05,**表示p<0.01,n=3)Fig.2 Relative expression of MHC-Ⅱ α in spleen,anterior kidney,gill and intestines of Scophthalmus maximus with different stress times(* is p<0.05,** is p<0.01,n=3)
在脾脏中,随TECP 质量浓度升高和胁迫时间延长,MHC-Ⅱ α基因相对表达量总体上呈现上升趋势;TECP 质量浓度为的处理组的上升幅度高于的处理组。脾脏中胁迫3 h 时TECP 质量浓度为的处理组MHC-Ⅱ α表达上升极显著(p<0.01),TECP 质量浓度为的处理组MHC-Ⅱ α表达显著上升(p<0.05);胁迫6 h 时与3 h 时类似,但是TECP 质量浓度为的处理组MHC-Ⅱ α表达上升极显著(p<0.01);胁迫12 h 时,只有在的处理组MHC-Ⅱ α表达上升极显著;TECP 质量浓度为的处理组中,24 h 时表达量达到最高值。
在头肾组织中,MHC-Ⅱ α基因相对表达量总体上呈现上升趋势,在TECP 质量浓度为的处理组中上升幅度最大,在24 h 时相对表达量达到最高值。在鳃组织中,MHC-Ⅱ α基因相对表达量总体上呈现先上升后下降和持续上升两种分化趋势,在胁迫6 h 时47.69 mg/L 和95.38 mg/L 的处理组中达到最高值,但随着时间延长,12 h 以后相对表达量开始下降,在TECP 质量浓度为的处理组MHC-Ⅱ α表达上升极显著(p<0.01),而TECP 质量浓度为的处理组MHC-Ⅱ α表达上升(p<0.05);胁迫24 h 与胁迫 12 h 的趋势变化一致。在肠组织中MHC-Ⅱ α基因相对表达量总体上呈现先上升后下降的趋势,在处理组中变化幅度较大,3 h 的相对表达量与6 h 相近,6 h 时相对表达量达到最高值,在24 h 时相对表达量降低。在受到TCEP 胁迫后,实验组中MHC-Ⅱ α基因的表达量显著提高,随TCEP 的质量浓度升高,MHC-Ⅱ α基因在较高浓度和的处理组中表达量变化明显,反映出高质量浓度的TCEP 对免疫系统的影响更明显;而在胁迫时间超过12 h 时,表达量呈现出先上升后下降的趋势,可能是免疫系统受到的损伤无法及时复原,导致免疫反应的强度下降。
2.2.2TNF-α基因的相对表达
添加不同质量浓度TCEP 胁迫处理的大菱鲆免疫相关组织中TNF-ɑ基因表达变化如图3 所示。在分别添加23.85 mg/L、47.69 mg/L 和95.38 mg/L 的TCEP 后,3 h、6 h、12 h 和24 h 时内大菱鲆幼鱼脾脏、头肾、鳃和肠组织中的TNF-ɑ基因相对表达量较对照组都显著提高(p<0.05)。
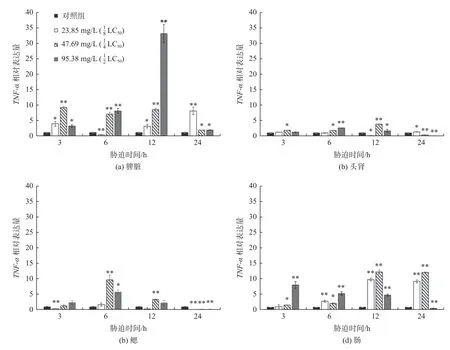
图3 TNF-ɑ基因在大菱鲆脾脏、头肾、鳃和肠组织中随胁迫时间的相对表达(*表示p<0.05,**表示p<0.01,n=3)Fig.3 Relative expression of TNF-ɑ in spleen,anterior kidney,gill and intestines of Scophthalmus maximus with different stress times(*is p<0.05,** is p<0.01,n=3)
在脾脏中,随TECP 质量浓度升高和胁迫时间延长,TNF-ɑ基因相对表达量总体上呈现先上升后下降和波浪式的趋势,TECP 质量浓度为的处理组中变化最为明显,在12 h 时表达量达到最高值,24 h 时相对表达量下降;在胁迫3 h 和6 h 的TECP 质量浓度为的处理组TNF-ɑ基因表达呈显著性变化。
在头肾组织中,TNF-ɑ基因相对表达量在TECP 质量浓度为处理组中变化较为明显,在12 h 时相对表达量达到最高值,24 h 之后相对表达量下降。在鳃组织中,TNF-ɑ基因相对表达量总体上呈现先上升后下降的趋势,在胁迫6 h 时各处理组中都达到最高值,随着时间延长相对表达量开始下降,24 h 时表达量极低。在肠组织中,TNF-ɑ基因相对表达量在TCEP 质量浓度为处理组中呈现上升趋势,在TCEP 质量浓度为处理组中呈现下降趋势;胁迫3 h 和6 h 的TECP 质量浓度为处理组的TNF-ɑ基因表达变化不呈显著性,其余处理组都呈显著或极显著变化(p<0.05)。
在受到TCEP 胁迫后,实验组中TNF-ɑ基因与MHC-Ⅱ α基因的表达量变化趋势相似,随TCEP 的质量浓度升高,TNF-ɑ基因在较高质量浓度的处理组中表达量变化幅度更大,而在胁迫时间超过12 h 时,TNF-ɑ基因表达量呈现出下降的趋势,可能与免疫系统受到的损伤无法及时复原相关。
3 讨论
内分泌干扰物是指环境中存在的能够干扰生物体内源激素的合成、释放、转运、结合、作用或清除,从而影响机体的内环境稳定、生殖、发育及行为的外源性物质[38]。TCEP 是一种新型的内分泌干扰物,属于有机磷酸酯(OPEs),主要作为阻燃剂添加到塑料产品、纺织品、电器设备、家具及建筑物中[39-40]。TCEP 的广泛应用使其在环境中不断累积。2011 年英国亚尔河水中检出了质量浓度极高的OPEs(平均为6 350 ng/L)[4]。2015 年德国、奥地利、西班牙、意大利、美国、日本等多个国家的地表水中,OPEs 的质量浓度范围为76~2 230 ng/L[5],其中TCEP 都是主要污染组分。地表水中的部分OPEs 随河流入海,德国易北河和莱茵河排放入北海的包括TCEP 在内的OPEs 分别可达5.5 和42.5 t/a[6]。2014 年的调查数据中,我国珠江入海口总 OPEs 质量浓度达 3.120 ng/L,其中TCEP 和 TCPP(磷酸三(2-氯丙基)脂)为主要污染物[7];2015年我国黄、渤海 40 条入海河流中,包括TCEP、TCPP 和TPPO(三(N,N-四亚甲基)磷酸胺)在内的12 种OPEs 在河流中的总OPEs 质量浓度范围为 9.6~1 549.0 ng/L,OPEs 中含氯的TCEP、TCPP 及 TPPO 为主要污染物[8]。还有研究发现TCPP 和TCEP 可通过渗透进入地下水,并在地下水中持久存在[9]。上述研究说明,TCEP 在水环境中的积累量已经不容忽视,而对于TCEP 对淡水和海洋生物的生物毒性亟需开展更广泛的检测与研究。TCEP(CAS:115-96-8)水溶解度为7.82 g/L,我们实验所用的TCEP 最大质量浓度为0.19 g/L,远低于其溶解度,能够充分溶解。另外在前期实验了4-甲基苄亚甲基樟脑(4-MBC)、对羟基苯甲酸丙酯(PP)、邻苯二甲酸二甲酯(DMP)等其他内分泌干扰物,并测试了其溶解性,TCEP 无晶体析出,溶解性良好。
采用生态毒理学理论评估TCEP 危害[21],常用表型观测方式(LC50和SC 为主要指标)和生物标志物检测。表型观测方式研究结果表明,0.5 和5.0 mg/L 的 TCEP 可以抑制斑马鱼(Danio rerio)幼鱼运动距离,通过产生氧化损伤造成神经毒性[10],也对人类细胞及斑马鱼具有内分泌干扰毒性[11]。5 mg/L TCEP 还能通过改变神经营养因子及相关受体基因表达对鮈鲫(Gobiocypris rarus)产生神经毒性[12]。已有OPEs 急性毒性研究表明TCPP 对斑马鱼(Danio rerio)成鱼96 h 的LC50值为47.06 mg/L[41]、对大鼠(Rattus norvegicus)经口的急性毒性LC50为500~4 200 mg/kg[42]、对黑头呆鱼(Pimephales promelas)96 h 的LC50值为51.00 mg/L[12,43];在相关研究中,TDCPP 对虹鳟(Oncorhynchus mykiss)96 h 的LC50值为1.10 mg/L,对斑马鱼(Danio rerio)胚胎仔鱼116 h的LC50值为7.00 mg/L[43-44];TCEP 对于鱼类96 h 的LC50值范围为6.30~250.00 mg/L[30]。我们发现TCEP 对于大菱鲆的LC50分别为190.76 mg/L(24 h)、159.94 mg/L(48 h)、140.70 mg/L(72 h)和110.71 mg/L(96 h),符合内分泌干扰物低剂量强生物学效应的特点。根据《水和废水监测分析方法》,TCEP 对大菱鲆幼鱼属于中毒(100~1 000 mg/L)级别[45]。鉴于TCEP 对大菱鲆幼鱼的急性毒性和致死作用,在其养殖活动中需对养殖海水中TCEP 的质量浓度及时监控,确保不超过33.60 mg/L 的安全浓度。
生物标志物的检测可深入探究TCEP 毒性机理[21]。鱼类免疫系统分为非特异性免疫和特异性免疫,一般情况下鱼类依靠非特异性免疫来抵御环境胁迫[46]。而非特异性免疫依赖各种免疫因子参与,具有代表性的免疫因子可以作为指示非特异性免疫变化的生物标志物。大菱鲆免疫相关因子主要分布在头肾、脾脏和黏膜相关的淋巴组织中。头肾是鱼类初级外周免疫器官,主要由淋巴组织构成,是免疫细胞发生、分化和增殖的重要场所,也是捕获抗原和产生抗体的主要器官,在免疫应答过程中发挥协同作用[41]。脾脏是鱼体次级外周免疫器官,是鱼体红细胞、粒细胞等免疫细胞产生、贮存和成熟的主要场所[47],在清除大分子物质、促进抗体生成中起着重要作用[48]。黏膜相关淋巴组织(MALT)指鱼体中不具备完整淋巴结构的、较为分散的淋巴生成中心,主要包括皮肤、肠和鳃淋巴组织[49]。分析MHC-Ⅱ α和TNF-α的基因表达结果可以看出,在受TCEP 胁迫后,大菱鲆免疫相关的基因相对表达量升高,但在不同免疫器官中的反应速度和强度有所不同。随着TCEP 胁迫时间延长及质量浓度增加,MHC-Ⅱ α基因相对表达量最高的器官为鳃,在脾脏和头肾组织中基因相对表达量呈升高趋势;而在鳃和肠组织中,基因相对表达量呈先升后降趋势。在相关的研究中,虹鳟(Oncorhynchus mykiss)受感染实验表明,其肝脏和头肾中的MHC基因在12 h 时上升,但在36 h 后呈下降趋势,之后逐渐恢复正常[50]。大弹涂鱼(Boleophthalmus pectinirostris)在鳗弧菌感染后,MHC-Ⅱ α相对基因表达有显著变化,在12 h 时分别达到最大值,且在脾脏组织的表达量高于肝脏组织的[51]。在鳃组织中,MHC-Ⅱ α基因相对表达量在12 h 以后开始下降,这可能是由于腮是最直接与TCEP 接触的器官,其表达趋势也符合转录水平的变化规律。
我们的研究中大菱鲆的MHC-Ⅱ α受到TCEP 胁迫时迅速变化与此类似。TNF-ɑ基因表达的变化趋势与MHC-Ⅱ α相似,在脾脏、头肾和肠组织中相对表达量高峰均出现在12 h,在鳃组织中相对表达量高峰出现在6 h。这与细菌感染日本比目鱼(Pacific Halibut)的研究[24]和菌株感染比目鱼的研究[52]中TNF-α基因表达的变化趋势一致。即在鱼体内,头肾作为初级外周免疫器官,脾脏作为次级外周免疫器官,共同在免疫反应中发挥作用[53]。鳃和肠作是黏膜相关淋巴组织,也属于免疫器官中外周免疫器官,可以产生淋巴细胞,对机体起到免疫保护作用[54],在受免疫胁迫时,淋巴组织会及时对胁迫作出反应。TNF-ɑ和MHC-Ⅱ α在不同器官中表达顺序不同,可能是由于鳃和肠首先接触到含TCEP 的海水,而头肾和脾脏接触较晚。先接触TCEP 的鳃和肠通过免疫相关因子呈递抗原,引起机体免疫应答;头肾和脾脏受到TCEP 影响后,免疫相关因子增多,同时分化产生大量免疫细胞,促进抗体生成。随胁迫时间延长,免疫相关因子表达量下降,可能是由于TCEP 造成的影响无法消除,导致免疫器官受到损伤,免疫防御能力下降;高质量浓度TCEP 胁迫的大菱鲆相对表达量下降出现时间更早,说明高质量浓度TCEP 对免疫器官造成的伤害更为严重。
TCEP 的胁迫会使大菱鲆免疫相关组织的MHC-Ⅱ α和TNF-α免疫相关基因的表达量上升,说明TCEP的胁迫对大菱鲆的免疫系统造成了影响;随着TCEP 的胁迫时间延长,基因表达量会出现先上升后下降的趋势,这可能是免疫器官受损导致免疫相关因子分泌减少,表现出TCEP 对大菱鲆的免疫系统造成了损伤;随着TCEP 的质量浓度上升,表达量的变化更明显,说明高质量浓度TCEP 的生物学效应更明显。水环境中TCEP 积累的量逐渐增长将成为更为严重的威胁。MHC-Ⅱ α和TNF-α基因表达水平的变化反映了大菱鲆在受到TCEP 不同程度影响后的状态,因此两者可以作为评估和预警TCEP 这种内分泌干扰物造成的污染状况的分子标志物。
4 结语
我们研究不同质量浓度的TCEP 对大菱鲆不同组织中关键免疫因子基因表达的影响,测定了TCEP 胁迫条件下MHC-Ⅱ α和TNF-ɑ基因的时空表达特征,推测其可能会对大菱鲆免疫系统造成急性损伤。
内分泌干扰物是具有低剂量强生物学效应及生物链放大效应的化合物,作为一种新型污染物要警惕其危害性。TCEP 是一种新型内分泌干扰物,近年来随着使用量不断增加,在环境中的积累量也不断增加。TCEP 由于带有氯离子,是一种可以长期稳定存在的有机磷酸酯,需要我们进一步明确其毒性。我们的研究表明TCEP 对大菱鲆的LC50分别为190.76 mg/L(24 h)、159.94 mg/L(48 h)、140.70 mg/L(72 h)和110.71 mg/L(96 h);在海水养殖大菱鲆过程中,海水中TCEP 积累量不可超过33.60 mg/L 的安全浓度,这为大菱鲆的健康养殖提供了数据支持。TCEP 作为内分泌干扰物能对大菱鲆产生免疫胁迫,使免疫相关因子MHC-Ⅱα和TNF-ɑ的基因表达发生变化,即TCEP 促进免疫相关因子基因相对表达量提高。在急性胁迫实验中,受到TCEP 胁迫的大菱鲆MHC-Ⅱ α和TNF-ɑ的相对表达量对比对照组会有明显上升,当质量浓度超过47.69 mg/L()胁迫时间持续超过12 h 时,基因相对表达量会呈现先上升后下降的趋势。这可能是由于TCEP可以影响大菱鲆的免疫系统,而高质量浓度的TCEP 会造成大菱鲆免疫器官的损伤,进而影响免疫相关因子的基因表达。因此MHC-Ⅱ α 和TNF-ɑ可作为潜在的预警污染物的分子标志物,可以为大菱鲆的健康养殖和环境污染物内分泌干扰物TCEP 的检测提供可参考的分子标记参考。TCEP 的毒性和对大菱鲆免疫的影响是其生物学效应的一部分,后续研究其对大菱鲆生殖方面的影响,将是其对大菱鲆繁殖影响的直接证据。

