伏美替尼治疗EGFR突变阳性非小细胞肺癌EGFR-TKI耐药患者的临床观察*
左强,江国强,方芳,李峤珂,周琦
(武警四川总队医院1.呼吸与危重症医学科,2.肿瘤科,四川 乐山 614000)
肺癌为临床常见恶性肿瘤之一,具有发病率、病死率高等特点,其中非小细胞肺癌占比较高,而非小细胞肺癌患者表皮生长因子受体(epidermal growth factor receptor, EGFR)突变率约为55%[1]。相关研究报道,非小细胞肺癌病死率较高,5年存活率<15%[2]。相比传统化疗药物,分子靶向治疗非小细胞肺癌是近年来研究的热点[3]。EGFR 家族及其配体在非小细胞肺癌的发生、发展中发挥重要作用,而表皮生长因子受体酪氨酸激酶抑制剂(epidermal growth factor receptor tyrosine kinase inhibitor, EGFR-TKI)用于肺癌的治疗效果较好,但随着治疗时间的推移,易发生耐药[4-5],严重影响疗效,需寻求更为有效的治疗方法。
伏美替尼为第三代EGFR-TKI,可通过阻断EGFR 分子内络氨酸激酶的自磷酸化,阻止丝裂原活化蛋白激酶等通路的信号传导,抑制肿瘤细胞的增殖、分化等,进而发挥抗肿瘤作用[6]。目前伏美替尼治疗EGFR 突变阳性非小细胞肺癌EGFR-TKI 耐药患者的临床效果鲜见报道。鉴于此,本研究对武警四川总队医院收治的EGFR 突变阳性非小细胞肺癌EGFR-TKI 耐药患者进行研究,对上述问题进行探讨,现报道如下。
1 资料与方法
1.1 研究对象
本研究依据前瞻性、随机、对照、单盲、单中心临床研究方法进行设计。选取2021年3月—2021年9月武警四川总队医院收治的EGFR 突变阳性非小细胞肺癌EGFR-TKI 耐药患者76 例为研究对象,并随机分为对照组37 例,实验组39 例。对照组给予培美曲塞静脉滴注500 mg/m2,1 次/3 周,21 d 为1 个治疗周期。观察组在实验组基础上口服伏美替尼,40 mg/次,2 次/d。所有患者用药至疾病进展或出现无法耐受的不良反应。本研究经医院医学伦理委员会批准,患者及其家属均对本研究知情同意。
1.2 纳入与排除标准
1.2.1 纳入标准①临床病理确诊为非小细胞肺癌,临床分期Ⅲ、Ⅳ期[7];②基因检测为EGFR 突变阳性[8];③一线EGFR-TKI(吉非替尼、厄洛替尼或阿法替尼)治疗发生耐药(治疗时或治疗后出现疾病进展),并经血液标本检测为EGFR T790M 突变阳性[9];④年龄>18 岁;⑤预计生存期>3 个月;⑥卡氏功能状态评分(Karnofsky performance status,KPS)>60 分。
1.2.2 排除标准①合并其他恶性肿瘤;②重要脏器功能严重障碍;③合并精神性疾病或认知功能障碍;④近3 个月接受激素治疗;⑤妊娠、哺乳期女性;⑥滥用药物、吸毒史;⑦免疫缺陷或血液系统疾病;⑧既往使用本研究药物治疗;⑨依从性差或不配合治疗、失访者。
1.3 主要试剂
培美曲塞,规格:500 mg/片,国药准字H20173301,四川汇宇制药有限公司。伏美替尼,规格:40 mg/片,国药准字H20210008,上海艾力斯医药科技股份有限公司。
癌胚抗原(carcinoembryonic antigen, CEA)、糖类抗原(carbohydrate antigen, CA)19-9、细胞角蛋白19片段抗原(cytokeratin 19 fragment antigen,CYFRA21-1)试剂盒购自上海齐源生物科技有限公司,基质金属蛋白酶-9(matrix metalloproteinase-9, MMP-9)、基质金属蛋白酶组织抑制剂-1(tissue inhibitor matrix metalloproteinase inhibitor 1,TIMP-1)试剂盒购自上海酶联生物科技有限公司。
1.4 观察指标
1.4.1 近期疗效评价依据实体瘤疗效评价标准[10]评估疗效,分为①完全缓解(complete response,CR):临床症状和原病灶消失,且持续1 个月以上;②部分缓解(partial response, PR):临床症状明显减轻和原病灶缩小>50%,且持续1 个月以上;③疾病稳定(stable disease, SD):临床症状未见减轻,原病灶缩小≤50%或增大≤25%,且持续1 个月以上;④疾病进展(progressive disease, PD):临床症状加重,出现新病灶或原病灶增大>25%。客观缓解率(objective response rate, ORR)=(CR+PR)/总例数×100%。
1.4.2 酶联免疫吸附试验检测肿瘤标志物水平采集所有研究对象空腹静脉血3 mL,3 200 r/min 离心10 min 分离血清,采用酶联免疫吸附试验检测CEA、CA19-9、CYFRA21-1 水平。
1.4.3 酶联免疫吸附试验检测MMP-9、TIMP-1水平采集所有研究对象空腹静脉血2 800 r/min 离心10 min 分离血清,采用酶联免疫吸附试验检测MMP-9、TIMP-1 水平。
1.4.4 安全性统计患者治疗期间胃肠道反应、骨髓抑制、肝肾功能损伤等情况,不良反应分为Ⅰ~Ⅳ级,等级越高表示越严重[11]。
1.4.5 预后两组患者自纳入起开始随访,随访时间6~12 个月,采用电话、门诊等方式随访,以全因死亡、随访时间截止为随访终点。
1.5 统计学方法
数据分析采用SPSS 19.0 统计软件。计量资料以均数±标准差(±s)表示,两组比较用t检验,多组比较用方差分析,进一步两两比较用LSD-t检验;计数资料以构成比或率(%)表示,比较用χ2检验;预后生存情况用Kaplan-Meier 生存曲线。P<0.05 为差异有统计学意义。
2 结果
2.1 两组临床资料比较
本研究共筛选185 例,成功入组76 例;实验组与对照组性别构成、年龄、临床分期、KPS 评分比较,差异无统计学意义(P>0.05),具有可比性。见表1。

表1 两组临床资料比较
2.2 两组临床疗效比较
对照组与实验组的ORR 比较,经χ2检验,差异有统计学意义(χ2=5.502,P=0.019),实验组高于对照组。见表2。

表2 两组临床疗效比较 例(%)
2.3 两组肿瘤标志物的变化
对照组与实验组治疗前后CEA、CA19-9、CYFRA21-1 的差值比较,经t检验,差异有统计学意义(P<0.05),实验组治疗前后CEA、CA19-9、CYFRA21-1 的差值大于对照组。见表3。
表3 两组治疗前后肿瘤标志物的差值比较 (μg/L,±s)

表3 两组治疗前后肿瘤标志物的差值比较 (μg/L,±s)
组别对照组实验组t 值P 值n 37 39 CEA 16.28±5.46 23.16±6.18 5.133 0.000 CA19-9 28.36±6.03 44.74±7.25 10.678 0.000 CYFRA21-1 21.32±4.21 27.01±3.74 6.236 0.000
2.4 两组MMP-9、TIMP-1水平的变化
对照组与实验组治疗前后MMP-9、TIMP-1 的差值比较,经t检验,差异有统计学意义(P<0.05),实验组治疗前后MMP-9、TIMP-1 的差值大于对照组。见表4。
表4 两组治疗前后MMP-9、TIMP-1的差值比较(ng/mL,±s)
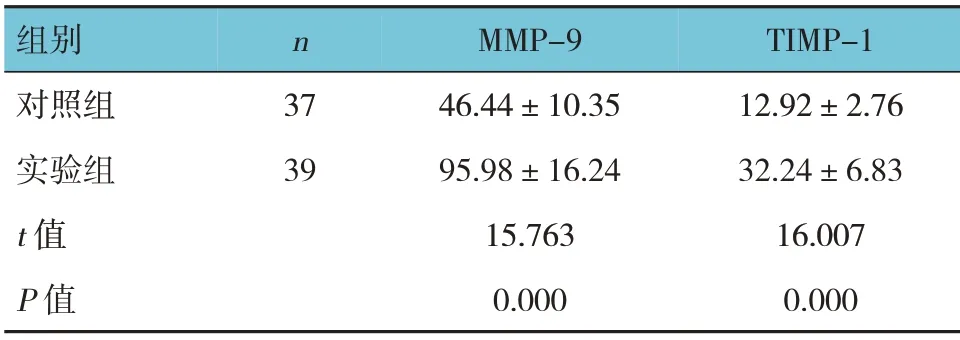
表4 两组治疗前后MMP-9、TIMP-1的差值比较(ng/mL,±s)
组别对照组实验组t 值P 值n 37 39 MMP-9 46.44±10.35 95.98±16.24 15.763 0.000 TIMP-1 12.92±2.76 32.24±6.83 16.007 0.000
2.5 两组安全性比较
实验组不良反应有消化道反应4 例(Ⅰ、Ⅱ级3例,≥Ⅲ级1例),腹泻3例(Ⅰ、Ⅱ级2例,≥Ⅲ级1 例),Ⅰ、Ⅱ级皮疹、甲沟炎及骨髓抑制各2 例,总发生率为33.33%(13/39);对照组的药物不良反应有消化道反应3 例(Ⅰ、Ⅱ级2 例,≥Ⅲ级1 例),腹泻4 例(Ⅰ、Ⅱ级3 例,≥Ⅲ级1 例),Ⅰ、Ⅱ级皮疹、骨髓抑制各2 例,总发生率为29.73%(11/37)。两组不良反应发生率比较,经χ2检验,差异无统计学意义(χ2=0.114,P=0.736)。
2.6 两组预后比较
截止随访结束(随访时间6~12 个月,中位随访时间8 个月),对照组、实验组均无失访;实验组、对照组生存率分别为46.15%(17/39)和27.03%(10/37),差异有统计学意义(χ2=4.378,P=0.036),实验组存活率高于对照组。见图1。

图1 两组患者Kaplan-Meier生存曲线
3 讨论
肺癌为临床常见恶性肿瘤,约80%肺癌为非小细胞肺癌[12]。近年来,随着环境污染加剧,肺癌发病率逐年增加,EGFR 突变阳性非小细胞肺癌患者也随之增加[13]。目前临床对EGFR 突变阳性非小细胞肺癌患者多采用一线EGFR-TKI 药物治疗,但治疗约1年后多数患者出现耐药现象,致使肿瘤进展,其中约65%是由于EGFR T790M 突变阳性所导致的耐药,急需寻求更为有效的治疗方法改善耐药[14-15]。
本研究中,实验组ORR 高于对照组,提示伏美替尼可提高EGFR 突变阳性非小细胞肺癌EGFRTKI 耐药患者临床疗效。分析其原因可能为伏美替尼为EGFR-TKI 药物的一种,可能通过抑制络氨酸激酶区域磷酸化过程,抑制信号传导,进而发挥抑制肿瘤的作用[16]。本研究结果显示,实验组治疗前后CEA、CA19-9 及CYFRA21-1 的差值大于对照组,可能为伏美替尼能够通过抑制EGFR 自身磷酸化,从而影响肿瘤细胞的增殖、侵袭等信号传导途径,更好地发挥抗肿瘤作用[17]。本研究结果表明,实验组治疗前后MMP-9、TIMP-1 的差值大于对照组,可能为恶性肿瘤的浸润、转移为一个多步骤、多阶段的过程,而肿瘤细胞能否形成转移的关键步骤为肿瘤组织对细胞外基质降解、上皮间质转换等。MMP-9、TIMP-1 参与上皮间质转换、肿瘤基底膜降解的过程,其中血清MMP-9 是一种内源性蛋白水解酶,在肿瘤基底膜降解中发挥重要作用,可促进基底膜破坏[18-20]。TIMP-1 为MMP-9 天然活性抑制因子,与MMP-9 结合后可抑制MMP-9 活性,抑制肿瘤的转移、侵袭。因此EGFR 突变阳性的非小细胞肺癌EGFR-TKI 耐药患者采用伏美替尼治疗可降低血清MMP-9、TIMP-1 水平,进而抑制肿瘤进展。本研究结果表明,实验组与对照组的药物不良反应发生率接近,提示安全性良好;实验组生存率高于对照组,提示伏美替尼可提高患者存活率,延长生存时间。伏美替尼通过提高临床疗效,降低肿瘤标志物和血清MMP-9、TIMP-1 水平,延长患者的生存时间。
综上所述,伏美替尼可提高EGFR 突变阳性非小细胞肺癌EGFR-TKI 耐药患者临床疗效,降低肿瘤标志物和血清MMP-9、TIMP-1 水平,延长患者生存时间,且安全性良好,值得在临床推广应用。本研究存在的不足之处在于所纳入的病例数较少,且为单中心研究,在后续的研究中需弥足以上不足,进一步验证本研究结果。

