泌尿肿瘤免疫检查点抑制剂相关性肌炎的临床特征
应沂岑,唐 琦,杨恺惟,米 悦,范 宇,虞 巍,宋 毅,何志嵩,周利群,李学松
(北京大学第一医院泌尿外科,北京大学泌尿外科研究所,国家泌尿、男性生殖系肿瘤研究中心, 北京 100034)
继放化疗、靶向治疗、抗血管生成治疗之后,免疫检查点抑制剂(immune checkpoint inhibitors, ICI)的出现推动了肿瘤免疫治疗的发展。目前,应用于肿瘤治疗的免疫检查点主要包括细胞毒性T细胞相关抗原4(cytotoxic T-lymphocyteassociated protein 4, CTLA-4)、程序性细胞死亡蛋白1(programmed cell death protein 1, PD-1)及其配体(programmed cell death-ligand 1, PD-L1)。ICI通过阻断肿瘤免疫逃逸途径中重要的抑制性信号分子,激活肿瘤免疫微环境中T细胞的免疫反应,促进对肿瘤细胞的免疫杀伤作用。然而,肿瘤患者在接受ICI药物治疗过程中也可能打破机体自身免疫耐受的平衡,导致免疫系统过度激活,出现累及皮肤、胃肠道、肝、肺、心脏、内分泌系统、肌肉骨骼、神经系统等全身多脏器系统的免疫相关不良反应(immune-related adverse events, irAEs)[1]。
ICI治疗后免疫相关性肌炎表现为风湿免疫和肌肉骨骼系统损害,在irAEs中相对罕见[2]。目前irAEs数据主要来自于临床试验和少数病例报告,且尚未见单独在泌尿肿瘤中进行讨论。本研究对北京大学第一医院8例泌尿肿瘤ICI治疗后免疫相关性肌炎患者的临床资料进行分析,总结其起病特点、临床表现、实验室及相关检查结果、治疗经过及转归情况,为泌尿肿瘤ICI治疗后免疫相关性肌炎的诊疗提供依据。
1 资料与方法
1.1 研究对象
选择2018年3月—2022年3月北京大学第一医院泌尿外科收治的8例泌尿肿瘤ICI治疗后免疫相关性肌炎患者的临床资料进行回顾性分析。
纳入标准:(1)出现肌炎之前已经明确诊断为泌尿系统恶性肿瘤,并接受了至少一个周期的抗PD-1/PD-L1 ICI治疗;(2)符合中国《免疫检查点抑制剂相关的毒性管理指南(2019版)》[3]或美国国立综合癌症网络(national comprehensive cancer network, NCCN)免疫治疗相关毒性管理指南(2022年第1版)[4]中免疫相关性肌炎的诊断标准。
排除标准:(1)无法排除既往自身免疫病史或其他与治疗无关原因导致的炎症性肌病;(2)原发肿瘤转移或副肿瘤综合征所致神经肌肉损伤。
1.2 临床及实验室资料
记录患者的人口学资料,包括性别,年龄,起病时间,既往是否合并肌肉骨骼系统、心血管系统及神经系统等相关疾病;既往泌尿肿瘤类型及病理分期、既往手术、术后治疗方案及治疗时间;ICI治疗抗体类型、剂量及疗程;临床表现(如肌痛、肌无力、眼睑下垂、胸闷、心慌、喘憋等);irAEs后初始治疗方案及转归。
起病时的实验室检查,包括肝功能、肌酶谱、心肌损伤标志物、超敏C反应蛋白(high-sensitivity C reactive protein, hs-CRP)、B型利钠肽(B-type natriuretic peptide, BNP)、甲状腺功能、甲状腺自身抗体谱、免疫球蛋白(immunoglobulin, Ig)、抗核抗体(antinuclear antibody, ANA)、抗ENA(anti-extractable nuclear antigen, anti-ENA)抗体谱、抗乙酰胆碱抗体谱、肌炎抗体谱等。相关影像学诊断及病理学检查,包括心电图、超声心动图、肌电图、磁共振成像(magnetic resonance imaging, MRI)、心脏磁共振(cardiac magnetic resonance, CMR)、肌肉活检、肠镜等。
1.3 统计学分析
2 结果
2.1 一般临床资料
8例患者女性2例,男性6例,免疫相关性肌炎诊断年龄为38~73岁,中位年龄为68岁;均因泌尿系统恶性肿瘤接受ICI治疗,其中2例为上尿路尿路上皮癌(upper tract urothelial carcinoma, UTUC), 3例为肾细胞癌(renal cell carcinoma, RCC), 3例为膀胱癌(bladder cancer, BCa)。除2例BCa患者和1例UTUC患者接受膀胱根治术前ICI新辅助治疗外,其余5例患者均接受术后免疫治疗(其中1例患者因术后病理分期较晚、分级较高行辅助治疗,4例患者因术后远处转移行挽救性治疗,表1)。接受帕博利珠单抗治疗3例,接受替雷利珠单抗治疗2例,接受纳武单抗、特瑞普利单抗、信迪利单抗治疗各1例,接受抗PD-1联合化学治疗者2例(表2)。
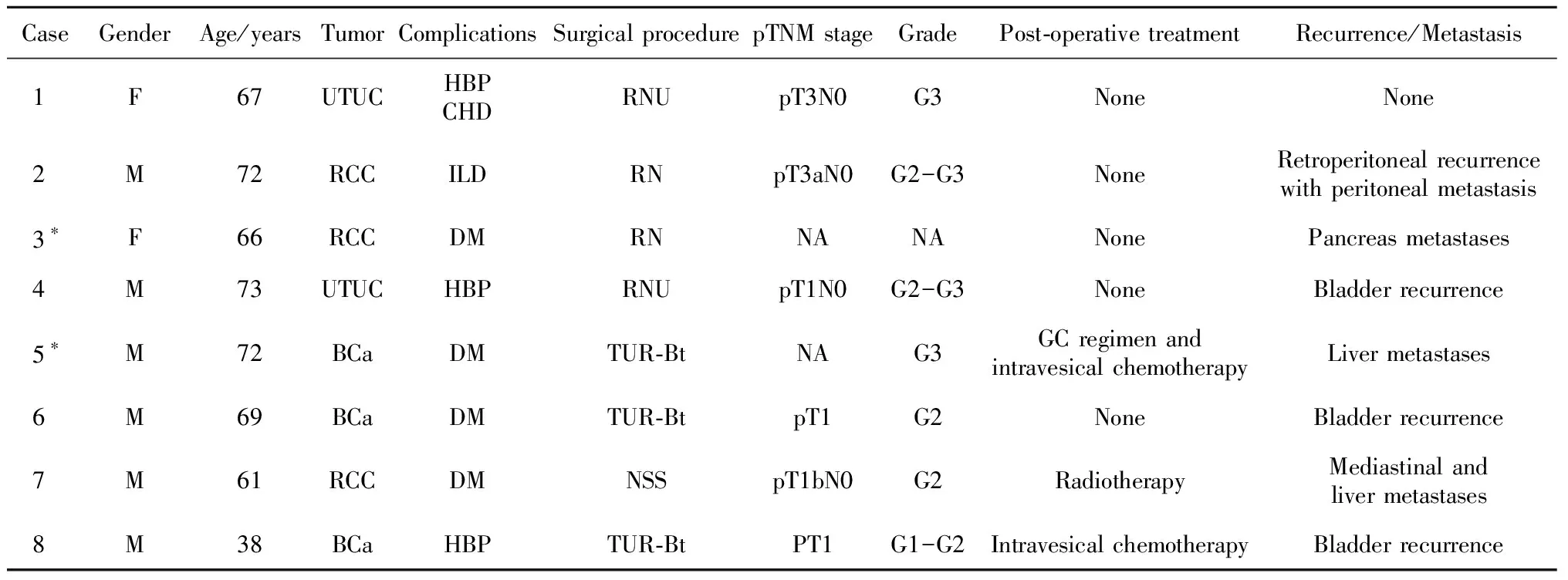
表1 ICI治疗后免疫相关性肌炎患者的一般特征Table 1 General characteristics of patients with immune-related myositis after ICI treatment
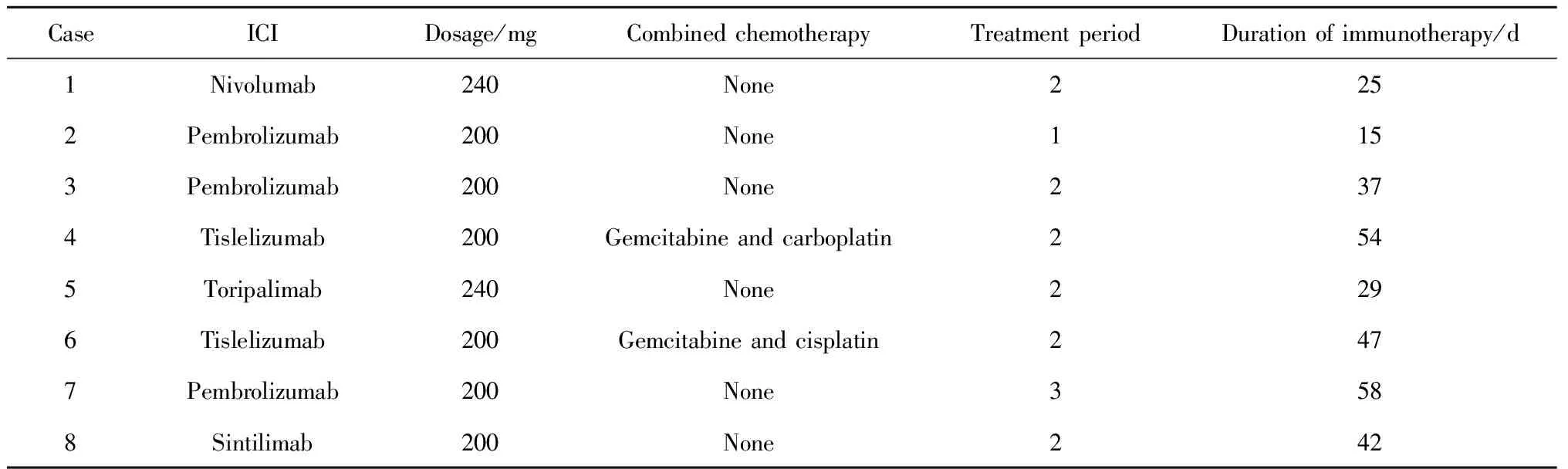
表2 ICI治疗后免疫相关性肌炎患者免疫治疗特点Table 2 Characteristics of immunotherapy in patients with immune-related myositis after ICI treatment
2.2 起病情况与临床表现
8例患者均在接受1~3个抗PD-1治疗周期后罹患免疫相关性肌炎,中位治疗周期为2个疗程;首次接受抗PD-1治疗至免疫相关性肌炎起病时间为15~58 d,中位时间为39.5 d(表2)。
本组患者肌炎相关的症状主要表现为肌肉酸痛乏力,以四肢骨骼肌最为显著,严重者可累及中轴肌或面部肌肉,导致腰背部酸痛乏力、视物或咀嚼受限。5例患者伴有明显的单侧或双侧眼睑下垂、睁眼困难,3例肌炎继发横纹肌溶解的患者出现尿色加深,1例伴有重症肌无力的患者有胸闷、呼吸困难等呼吸肌受累表现。5例合并免疫相关性心肌炎的患者中有2例有明显的心慌、胸闷、头晕等症状,1例合并免疫相关性肠炎的患者出现剧烈腹痛、腹泻伴便血。
将5例合并与3例未合并免疫相关性心肌炎的患者进行比较,首次接受抗PD-1治疗至免疫相关性肌炎起病时间分别为(30.60±12.12) d和(51.33±8.33) d,差异有统计学意义(P=0.042)。
2.3 实验室指标及检查结果特征
8例患者均有转氨酶及肌酶谱指标显著升高,其中肌酸激酶(creatine kinase, CK)中位数4 577 IU/L(范围595~7 590 IU/L), 乳酸脱氢酶(lactate dehydrogenase, LDH)中位数776 IU/L(范围238~1 389 IU/L), 羟丁酸脱氢酶(hydroxybutyrate dehydrogenase, HBDH)中位数657 IU/L(范围190~1 206 IU/L), 肌酸激酶同工酶(MB isoenzyme of creatine kinase, CK-MB)中位数124.1 μg/L(范围9.5~276.6 μg/L), hs-CRP中位数22.86 mg/L(范围1.49~90.47 mg/L)。肌钙蛋白中3例患者检测心肌肌钙蛋白(cardiac troponin I, cTnI),中位数1.010 g/L(范围0.118~2.483 g/L); 5例患者检测高敏肌钙蛋白(high-sensitivity troponin I, hs-TnI),中位数171.6 g/L(范围17.0~2 588.2 g/L,表3)。3例合并横纹肌溶解的患者均有尿或血肌红蛋白(myoglobin, MYO)显著升高。
完善了甲状腺功能检查的5例患者均有甲状腺激素水平异常,其中1例患者T4/FT4升高,1例患者T4/FT4升高伴促甲状腺素(thyroid stimulating hormone, TSH)降低,1例患者T3/FT3和T4/FT4均升高伴TSH降低,1例患者仅FT3降低,1例患者仅TSH水平降低,但5例患者均未表现出甲状腺功能异常特异性症状体征(表3、4)。

表3 ICI治疗后免疫相关性肌炎患者实验室检查结果Table 3 Laboratory findings in patients with immune-related myositis after ICI treatment
3例完善了免疫球蛋白水平检测的患者均表现出IgM水平下降。在自身抗体方面,2例患者ANA体现出不同滴度的阳性,同时伴抗线粒体抗体-M2(anti-mitochondria antibody-M2, AMA-M2)阳性,其中1例伴抗SS-A(Sjögren’s syndrome A)抗体阳性的患者还伴有甲状腺过氧化物酶抗体(thyroid peroxidase antibody, TPOAb)及甲状腺球蛋白抗体(thyroglobulin antibody, TgAb)水平升高。1例TPOAb及TgAb水平升高的患者未检测出阳性的ANA或抗ENA抗体。1例伴有重症肌无力的患者出现抗乙酰胆碱酯酶抗体(acetylcholinesterasen antibody, AchE.Ab)、抗连接素抗体(titin antibody, Titin.Ab)和抗兰尼碱受体钙释放通道抗体(ryanodine receptor antibody, RyR.Ab)阳性,但该患者未完善低密度脂蛋白受体相关蛋白4抗体(low-density lipoprotein receptor-related protein 4 antibody, LRP4.Ab)的检测。2例LRP4.Ab阳性的患者未体现重症肌无力相关临床证据(表3、4)。
5例合并免疫相关性心肌炎的患者在ICI治疗前均报告大致正常心电图或非特异性ST-T改变,但在出现不良反应后均表现出显著的心电图异常,主要表现为房性或室性早搏和ST-T、QRS波改变,其中1例伴Ⅲ度房室传导阻滞,2例伴束支传导阻滞,1例出现房颤。5例合并免疫性心肌炎的患者超声心动图均提示左室射血分数正常,其中2例患者报告室间隔增厚,1例患者报告室间隔高回声灶,2例患者未报告明显异常(表4)。

表4 ICI治疗后免疫相关性肌炎患者症状、诊断及治疗转归Table 4 Symptoms, diagnosis and outcomes in patients with immune-related myositis after ICI treatment
3例患者完善了CMR,未提示明显异常;5例患者完善了双大腿MRI,其中1例患者还完善了眼肌MRI,均提示水肿信号。7例患者完善了针极肌电图/神经传导速度/重频电刺激,其中5例患者提示不同程度的肌肉损害及神经传导速度异常(表4)。
3例患者完善了肌肉活检,均提示类似的炎性肌病样病理改变及免疫组化染色结果(图1)。患者骨骼肌出现肌束衣水肿、血管周围CD3、CD4、CD8阳性淋巴细胞浸润,肌纤维肥大、萎缩、坏死、再生,伴随肌内衣CD20阳性淋巴细胞及CD68阳性巨噬细胞浸润,肌纤维膜及胞浆MHC-Ⅰ(major histocompability complex-Ⅰ)弥漫阳性表达,少数非坏死肌纤维膜及肌内衣毛细血管补体沉积。病例3同时出现小组分布、累及两型的小角状萎缩肌纤维,以及肌纤维组化倾向,提示该患者存在轻微神经源性骨骼肌损害。
另外,1例合并了免疫相关性肠炎的患者完善了肠镜检查,提示盲肠不规则溃疡形成,升结肠、肝曲、横结肠见散在充血、水肿、糜烂、溃疡形成,其中肝曲、横结肠中段见明显水肿充血,黏膜呈“假瘤样”改变。
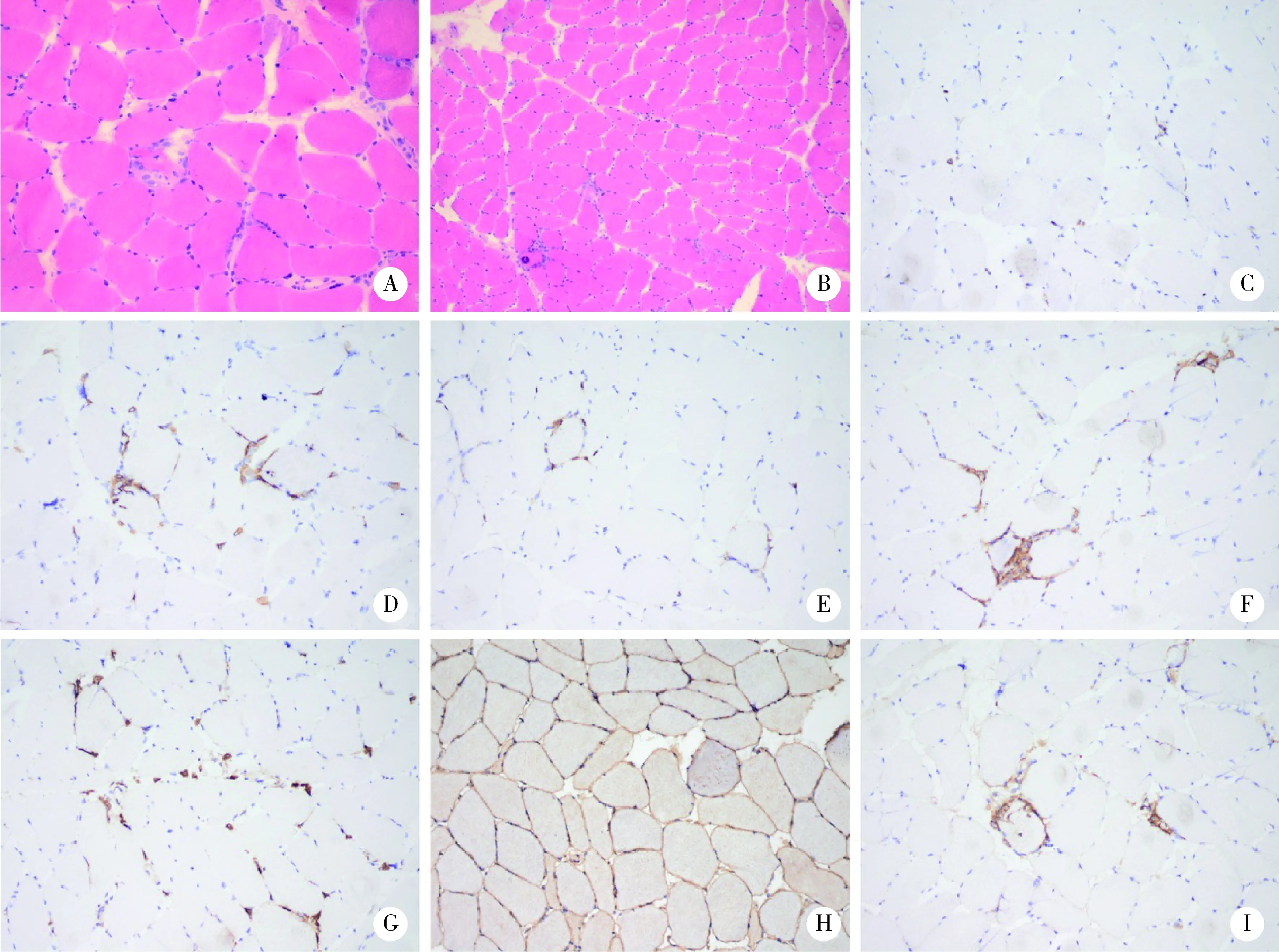
A and B, pathological changes of inflammatory myopathy: muscle necrosis, regeneration, and focal invasion of inflammatory cells (HE, A, ×200; B, ×100); C to I, immunohistochemical staining results (C, CD3, ×200; D, CD4, ×200; E, CD8, ×200; F, CD20, ×200; G, CD68, ×200; H, MHC-Ⅰ, ×200; I, C5b-9, ×200).图1 ICI治疗后免疫相关性肌炎患者肌肉活检结果Figure 1 Muscle biopsy from pathological changes of patients with immune-related myositis after ICI treatment
2.4 干预措施与转归
8名患者在明确诊断为免疫相关性肌炎后均立即停用ICI,随后6例患者使用甲泼尼龙静脉注射治疗,初始用量4例为120 mg,2例为80 mg,其中3例患者加用丙种球蛋白静脉注射 (疗程5 d);1例患者因糖尿病血糖控制不佳仅静脉注射丙种球蛋白而未使用激素治疗;1例患者因症状较轻、肌酶指标上升不高未使用免疫抑制治疗。所有患者均辅以保肝、营养神经等对症治疗(表4)。
将5例合并与3例未合并免疫相关性心肌炎的患者进行比较,合并心肌炎的患者组给予的起始甲泼尼龙中位剂量为120 mg(范围0~120 mg), 未合并心肌炎的患者组为80 mg(范围0~120 mg), 两组差异无统计学意义(P=0.571)。
治疗后8例患者症状均逐渐缓解,血清学肌酶指标均明显下降,到随访终点时均未出现免疫相关性肌炎及免疫相关并发症复发或新发irAEs。7例患者均未再重启ICI,其中2例死于肿瘤进展,2例新辅助免疫治疗的患者病情好转后立即完善根治手术;1例新辅助免疫治疗的轻症患者重启ICI(表4)。
3 讨论
近年来伴随着肿瘤免疫治疗的不断完善和推广,ICI已经被广泛用于治疗非小细胞肺癌、黑色素瘤、尿路上皮癌和肾细胞癌等恶性肿瘤[5],但是,如何更好地诊断和治疗ICI使用导致的irAEs,仍然是一个需要进一步研究的问题。
在抗PD-1/PD-L1治疗中,约12%的患者会出现重型irAEs[1]。相较于化疗不良反应,irAEs具有相对滞后和持续时间更长的特点[6],一旦出现严重的irAEs,患者肿瘤免疫治疗需立即终止,但是终止治疗会导致肿瘤疾病进展甚至危及生命,因此早期识别、诊断和及时有效地治疗irAEs,有助于肿瘤免疫治疗顺利发挥效应,从而使患者获得更好的预后。
在所有irAEs中,累及关节、肌肉、骨骼、滑膜等结缔组织的不良反应为风湿免疫相关不良反应(rheumatic immune-related adverse events, Rh-irAEs),免疫相关性肌炎是其中发病最早、致死率最高的并发症[7]。Aldrich等[8]报道在9 088例接受ICI的患者中,36例免疫相关性肌炎发生中位时间是ICI治疗后27 d,中位疗程为2个疗程。本组8例患者免疫相关性肌炎发病中位时间39.5 d,中位疗程为2个疗程,其差异可能与免疫治疗方案及瘤种不同有关。本组8例患者中,5例合并免疫相关性心肌炎的患者首次接受抗PD-1治疗至免疫相关性肌炎起病时间比未合并心肌炎的患者更短(P=0.042), 这与Moslehi等[9]发现心肌炎发病时间早的报道相符。本组7例完善了肌电图的患者中,5例出现神经传导速度减慢,3例提示神经源性或肌源性损伤,符合肌病及神经肌肉接头功能障碍的特征。Matas-García等[10]发现免疫相关性肌炎的组织病理学特征是肌肉明显坏死、再生,血管周围大量淋巴细胞和巨细胞浸润,伴MHC-Ⅰ类抗原表达,这与本组3名完善了肌肉活检的患者结果相符合。Aldrich等[8]比较接受ICI治疗后16例仅出现免疫相关性肌炎和19例出现肌炎合并其他irAEs的患者,发现两组患者肌酶谱、自身抗体、肌电图、MRI结果差异均无统计学意义,合并多种irAEs的患者出现呼吸衰竭和感染的情况更常见,irAEs特异性病死率更高。在本组患者中,单一肌炎与合并其他irAEs的患者在年龄、瘤种、实验室指标等方面差异均无统计学意义(P>0.05),且经免疫抑制治疗后均明显好转,预后也无不同,这主要可能由于病例数量太少,结果不具有代表性,但也提示可能不易从免疫相关性肌炎患者初发时的化验检查结果准确预测是否合并其他irAEs和其远期预后,尚需进行更大规模、更长随访的前瞻性研究,为分析得到诊断及远期预后的风险因素提供证据。
ICI治疗后免疫相关性肌炎和心肌炎均为罕见并发症,目前报道免疫相关性肌炎发病率为0.4%~0.7%[8,11],免疫相关性心肌炎发病率为0.09%~1.14%[12-13],但是,免疫相关性肌炎和心肌炎经常合并出现。Moslehi等[9]分析101例免疫相关性心肌炎患者,发现25%合并肌炎,10%合并重症肌无力,4%合并肠炎。Moreira等[14]发现32%的免疫相关性肌炎合并心肌炎,Aldrich等[8]报道39%的免疫相关性肌炎合并心肌炎,25%同时合并心肌炎及重症肌无力。
一项包含112个ICI临床试验共计19 217例患者的荟萃分析提示,抗PD-1/PD-L1治疗引起致命性irAEs的发生率分别为0.36%和0.38%,主要致死不良反应为肺炎、肝炎、神经毒性作用和心肌炎[15]。既往研究报道ICI治疗后免疫相关性心肌炎病死率在35%~50%[9,13,16-18]。因此,能够在出现不良反应早期时预测患者出现重型致命性irAEs的风险具有很高的临床价值。Mahmood等[13]发现cTnI超过1.5 g/L时发生严重心血管不良事件(major adverse cardiac events, MACE)的风险增加4倍(HR: 4.0; 95%CI: 1.5~10.9;P=0.003)。本组患者中,5例合并免疫相关性心肌炎的患者并未体现出具统计学意义的特异化验指标(P>0.05),但其中有3例患者超声心动提示室间隔新发高回声灶或增厚,提示可能与心肌组织水肿有关。
目前,大剂量糖皮质激素仍是抑制ICI治疗引起过度活跃的免疫反应的一线治疗方法,建议使用甲泼尼龙起始剂量1~2 mg/(kg·d)静脉输注,然后缓慢减量并改为口服。若出现单独使用糖皮质激素不足以应对的严重irAEs,如暴发性的免疫相关性心肌炎等,也可合并血浆置换、静脉注射丙种球蛋白、霉酚酸酯、他克莫司和英夫利昔单抗等其他免疫抑制治疗[19]。本组患者仅给予单独或联合甲泼尼龙及丙种球蛋白静脉注射,且均未使用冲击剂量激素,但及时治疗后均好转。
严重irAEs是否可重启ICI治疗、适宜的重启时机及是否需要更换不同作用通路的ICI目前尚无定论。Pollack等[20]评价了出现irAEs的80例ICI治疗患者重启ICI的安全性和有效性,其中14例(18%)在恢复治疗后中位14 d出现irAEs复发,17例(21%)出现新发irAEs,激素减量的持续时间、其他免疫抑制剂的使用和初始irAEs的严重程度均不能预测患者对ICI重启的反应。本组2例死亡患者均合并免疫相关性心肌炎,但经过免疫抑制治疗患者的肌炎/心肌炎相关症状均明显好转,肌酶/心肌损伤标志物均显著下降,但最终死于停止ICI治疗后原发肿瘤进展导致的多器官功能衰竭。因此,严重免疫相关性心肌炎的预测因素以及重启ICI治疗的时机需要更大样本量的前瞻性研究进行分析佐证。
本研究为单中心小样本回顾性研究,存在一定的局限性,未能在不同泌尿肿瘤中观察到显著的临床资料差异。未来本课题组将前瞻性研究泌尿肿瘤irAEs发生情况,并扩大例数及瘤种纳入进行对比分析、增加中心数量减少混杂偏倚,尤其关注致死率高的严重不良事件,为irAE精准诊疗提供高质量的循证医学证据支持。
综上所述,ICI治疗后免疫相关性肌炎是相对罕见但具有独特临床及病理特征的irAEs,常见合并心肌炎等其他不良反应。本研究发现在ICI治疗后出现irAEs的泌尿肿瘤患者中,合并心肌炎的患者比单纯出现肌炎的患者发病时间更早,但并未发现可以早期识别合并多种irAEs的预测因素。立即停用ICI并开始大剂量糖皮质激素治疗是控制irAEs的一线治疗方案,可以及时缓解病情,改善预后。

