基于UPLC-Q-Exactive Focus-MS/MS技术分析飞蛾藤中的化学成分
王小彤,胡静,任慧,崔小敏,曲彤,李宁,吴靳荣*,陈志永*(.上海中医药大学中药学院,上海 003;.陕西省中医药研究院,西安 70003)
旋花科飞蛾藤属植物在全世界有约20 余种,主要分布于亚洲热带及亚热带,非洲及邻近岛屿、大洋洲、美洲也存在少量分布。我国飞蛾藤属植物资源丰富,有14 种,8 个变种,主产云南,部分种分布于长江以南各省,1 种延伸至陕西、甘肃[1]。飞蛾藤属植物有广泛的药用记载,如大果飞蛾藤P.sinensis已成为商品丁公藤药材的主流替代品种[2];美飞蛾藤P.spectabilis在广西民间以全草入药,用于治疗子宫脱垂[3];小萼飞蛾藤P.mairei据《中华本草》记载,以根入药,有镇咳平喘的功效[4]。然而,我国法定药品质量标准体系至今尚未收载任何飞蛾藤属植物。
飞蛾藤(Porana racemosaRoxb.)据《全国中草药汇编》记载,以全草入药,具发表、消食积之功效,主治伤风感冒、食积不消[5];在湖南民间,俗称黄乌龙,用于治疗风湿病[6]。现代研究表明,飞蛾藤还具有抗风湿、抗炎、抑制前列腺素和白三烯生物合成等作用,可治疗风湿病及神经疼痛[7]。目前有关飞蛾藤化学成分的研究较少,虽有少数研究表明飞蛾藤中含有机酸类、香豆素类、黄酮类、甾醇类等化合物[7],却缺乏系统性研究。本试验采用超高效液相色谱-四极杆-静电场轨道离子阱联用质谱(UPLC-Q-Exactive Focus-MS/MS)技术,对飞蛾藤全草中化学成分进行全面、快速的定性分析,以期为飞蛾藤的药效物质基础及质量控制研究提供依据。
1 材料
UPLC-Q-Exactive Focus-MS/MS 型高分辨质谱仪,UltiMate 3000 型超高效液相色谱系统(ThermoFisher Scientific 公司),BT25S 型0.01 mg 电子分析天平及BS210S 型0.1 mg 电子分析天平[赛多利斯科学仪器(北京)有限公司],KQ-100 型超声波清洗机(昆山市超声仪器有限公司)。飞蛾藤药材分别于2020年7月采集于云南文山,2020年9月采集于云南昆明,2020年10月采集于湖北恩施,干燥后保存待用,药材经陕西省中医药研究院陈志永副研究员鉴定为飞蛾藤,样品保存于陕西省中医药研究院中药所中药化学室。东莨菪苷(批号:16040805)、东莨菪内酯(批号:161208)、绿原酸(批号:1701904)、新绿原酸(批号:17062003)、异绿原酸A(批号:19061201)、异绿原酸B(批号:17121201)、异绿原酸C(批号:18070401)、伞形花内酯(批号:18010202)和咖啡酸(批号:17122804)(对照品,上海圻明生物科技有限公司,纯度≥98%),水为屈臣氏蒸馏水,甲醇、甲酸为色谱纯,其他试剂均为分析纯。
2 方法
2.1 样品溶液的制备
飞蛾藤药材干燥后打粉,过40 目筛,精密称取样品粉末0.5 g,置100 mL 具塞锥形瓶中。精密加80%甲醇50 mL,称重后常温下超声提取30 min(频率40 kHz,功率100 W),静置冷却至室温,用80%甲醇补足质量损失,摇匀,过滤,取续滤液5 mL 转移至10 mL 量瓶中,加入80%甲醇定容至刻度,经0.22 μm 微孔滤膜过滤,即得。
2.2 对照品溶液的制备
分别精密称取东莨菪苷、东莨菪内酯、伞形花内酯、咖啡酸、绿原酸、新绿原酸、异绿原酸A、异绿原酸B、异绿原酸C 对照品适量,置10 mL 量瓶中,加甲醇溶解并定容,制备单一对照品储备液,各单一对照品储备液混合并稀释得混合对照品溶液,均置于冰箱中4℃保存。
2.3 色谱条件
Thermo Accucore aQ C18色谱柱(2.1 mm×150 mm,2.6 μm),流动相甲醇(A)-0.1%甲酸水溶液(B)梯度洗脱(0 ~12 min,5%~25%A;12 ~20 min,25% ~30%A;20 ~28 min,30% ~38%A;28 ~40 min,38% ~50%A;40~55 min,50%~60%A),流速0.3 mL·min-1,柱温30℃,进样量3 μL。
2.4 质谱条件
高性能加热电喷雾离子源(HESI),正、负离子检测模式,喷雾电压3.5 kV,毛细管温度350℃,雾化室温度320℃,鞘气流速45 arb,辅助气流速15 arb,扫描模式为Full MS/dd-MS,Full MS 分辨率70 000,dd-MS 分辨率17 500,扫描范围为m/z80 ~1200。MS/MS 模式时所用碰撞能量为30 eV。
2.5 数据处理
取飞蛾藤样品溶液及对照品溶液适量,进样分析,根据Xcalibur 2.0 软件计算出高分辨精确质量数,与自建飞蛾藤化学成分数据库进行匹配,按照实际测得的相对分子质量与理论相对分子质量两者偏差<5×10-6的原则对目标化合物进行初步快速鉴定,推测色谱峰相对应的化合物分子式,再通过二级碎片的信息、相关文献及与对照品比较,确认并推导出化合物的结构及裂解规律。
3 结果与分析
飞蛾藤在正离子模式和负离子模式下的总离子流图见图1。通过对飞蛾藤化合物一级、二级质谱裂解规律的分析,最终共鉴定出30 个化合物,包括有机酸类13 个、香豆素类5 个、酰胺类4 个、黄酮类3 个及其他类5 个,其中9 个成分通过与对照品比对后确认。化合物保留时间、分子式、分子质量、一级质谱及二级质谱碎片离子具体见表1。
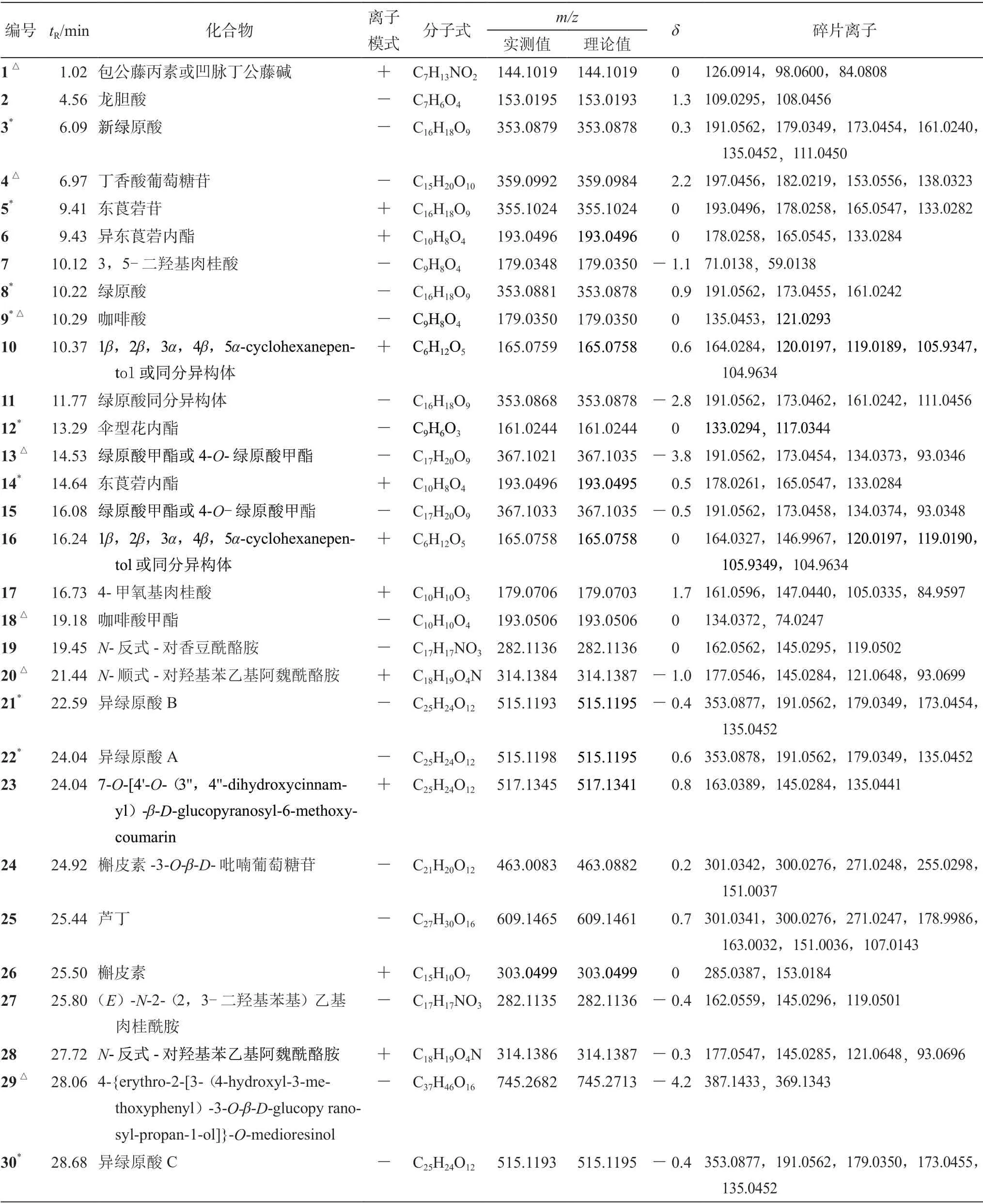
表1 飞蛾藤中化学成分的UPLC-Q-Exactive Focus-MS/MS 鉴定Tab 1 Identification of chemical constituents in Porana racemosa by UPLC-Q-Exactive Focus-MS/MS
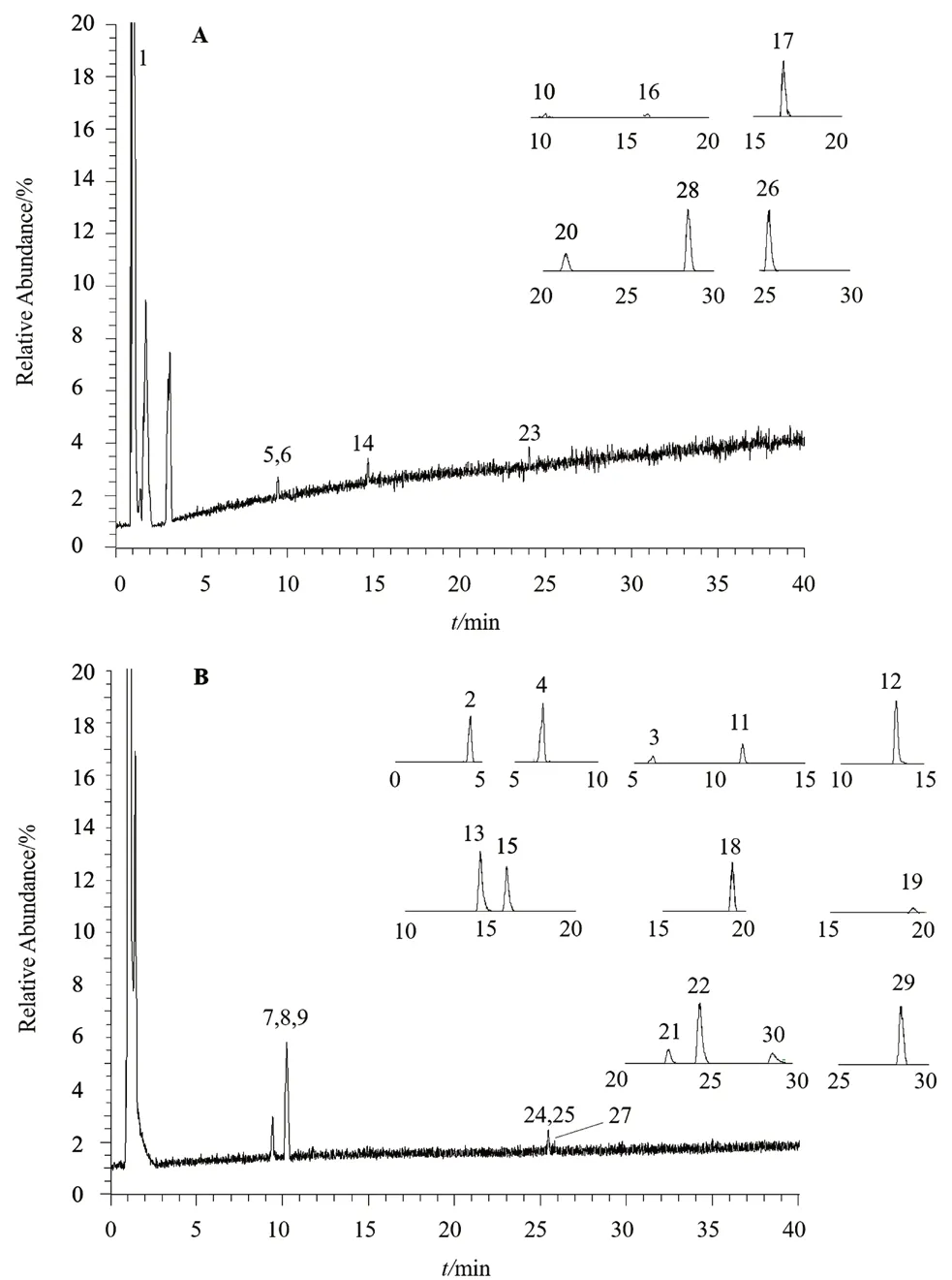
图1 飞蛾藤在正离子(A)和负离子(B)模式下的总离子流及部分化合物的提取离子流图Fig 1 Total ion chromatograms of Porana racemosa in both positive(A)and negative(B)ion modes and extracted ion chromatograms of some compounds
3.1 有机酸类
从飞蛾藤中共鉴定出13 种有机酸类的化合物,包括苯丙素类4 个,分别为化合物2、7、9、17;绿原酸类衍生物共8 个,分别为化合物3、8、11、13、15、21、22、30,以及有机酸类的衍生物化合物18。
简单苯丙素类化合物中多含羟基、糖基,且较多化合物为中药中的有效成分。负离子模式下化合物2 分子离子峰为153.0195 [M-H]-,二级碎片推测其裂解途径为母离子丢掉1 个羧基,得到碎片离子109.0295 [M-H-COO]-,根据文献[8]报道飞蛾藤近似种属植物中含有龙胆酸,并结合质谱相关文献[9],推测化合物2 为龙胆酸。化合物9 的准分子离子峰为179.0350 [M-H]-,化学结构为C9H8O4,二级质谱中失去1 个羧基得到咖啡酸的特征碎片离子135.0453 [M-H-COO]-,参考相关文献[10]及对照品质谱行为,鉴定化合物9 为咖啡酸。化合物7 和咖啡酸为一对同分异构体,由于咖啡酸中苯环上存在邻位酚羟基,易形成氢键,极性相较于化合物7 偏小,保留时间靠后,且其二级质谱中存在碎片离子71.0138 [M-HC6H4O2]-,59.0138 [M-H-C6H4O2-C]-,结合文献报道[11],推测化合物7 为3,5-二羟基肉桂酸。正离子模式下,化合物17 的准分子离子峰为179.0706 [M +H]+,高能撞击后产生的二级碎片离子,得到碎片离子161.0596,参考文献[12]后推测此成分为4-甲氧基肉桂酸。
绿原酸类衍生物具有明显的抗氧化及抗炎作用[13],飞蛾藤提取物中共鉴定出8 种此类型化合物,且多为同分异构体。新绿原酸和绿原酸在负离子模式下分子离子峰分别为353.0879 [MH]-,353.0881 [M-H]-,由于两者均由咖啡酸和奎宁酸酯化形成,仅连接位置存在差异,因此裂解方式相似。以新绿原酸为例,二级质谱中母离子分别失去咖啡酸部分和奎宁酸部分得到特征碎片179.0349 [M-H-C7H10O5]-及191.0562 [M-HC9H6O3]-,进一步失去1 个H2O 得到特征碎片161.0240 [M-H-C7H10O5-H2O]-,173.0454 [M-HC9H6O3-H2O]-;或在179 碎片离子上继续失去1 个CO2得到特征碎片135.0452 [M-H-C7H10O5-CO2]-。结合新绿原酸、绿原酸对照品的质谱行为、成分性质及相关文献,鉴定出化合物3、8 分别为新绿原酸和绿原酸。具体推测的化合物裂解方式见图2。化合物11 的准分子离子峰及碎片离子峰与绿原酸基本吻合,推测化合物11 为绿原酸的同分异构体。此外,还通过对照品比较鉴定出化合物21、22、30 这3 个同分异构体,分别为异绿原酸B、异绿原酸A、异绿原酸C。以异绿原酸A的质谱为例,一级质谱中分子离子峰为515.1198[M-H]-,在高能碰撞下其酯键断裂,失去1 个肉桂酸酯,得到碎片离子353.0878 [M-H-C9H6O3]-,接着与单咖啡酰奎尼酸的裂解途径相似,开环后得到碎片离子179.0349 [M-H-C9H6O3-C7H10O5]-,并继续丢失1 个CO2,得到碎片离子135.0452[M-H-C9H6O3-C7H10O5-CO2]-; 或353.0878 碎片离子的酯键断裂,得到碎片离子191.0562 [M-HC9H6O3-C9H6O3]-。

图2 新绿原酸负离子模式下的二级质谱图及裂解途径Fig 2 MS2 spectrum and fragmentation pathways of 5-O-caffeoylquinic acid at negative ion mode
化合物13 在负离子模式下,分子离子峰为367.1021 [M-H]-,二级质谱中,存在191.0562,173.0454,134.0373 等碎片离子,化合物15 与化合物13 的一级与二级质谱行为均高度相似,且两者都与绿原酸的裂解途径基本相似,参考质谱裂解文献[14],推测这两个化合物为绿原酸甲酯或4-O-绿原酸甲酯。化合物18 在负离子模式下一级质谱中分子离子峰为193.0506 [M-H]-,二级质谱中,能量撞击后丢掉1 个甲酯,得到134.0372[M-H-COOCH3]-碎片离子,接着失去CH4O2得到苯环碎片离子74.0247 [M-H-COOCH3-C2H4O2]-,结合文献[15],推测化合物18 为咖啡酸甲酯。
3.2 香豆素类
从飞蛾藤中共鉴定出5 种香豆素类化合物,分别为化合物5、6、12、14、23,其中化合物5、12、14 经与对照品比较后鉴定为东莨菪苷、伞形花内酯、东莨菪内酯。香豆素类化合物具有相同母核,母离子裂解过程中,主要丢失CO、CH3等基团,例如化合物5 在正离子模式下准分子离子峰为355.1024 [M +H]+,其对应分子式为C16H18O9,二级质谱中失去1 分子葡萄糖残基,产生碎片离子193.0496 [M +H-C6H10O6]+,再失去1 个CO3,得到碎片离子133.0282 [M +H-C6H10O6-CO3]+;或失去1 个甲基,得到碎片离子178.0258 [M +H-C6H10O6-CH3]+;或直接失去1 个中性碎片CO,获得碎片离子165.0547 [M +H-C6H10O6-CO]+,结合文献[16]参考,并与对照品的保留时间及质谱碎片相比较,鉴定该化合物为东莨菪苷。同样在正离子模式下,化合物6 与化合物14 为一对同分异构体,两者主要区别在羟基及甲氧基于C-6,C-7 的位置异构。两个化合物准分子离子峰均为193.0496 [M +H]+,推测化学式为C10H8O4,裂解方式基本一致,二级质谱中碎片离子均存在178.0258 [M +H-CH3]+,133.0284 [M +H-CO3]+,结合文献参考[16],推测化合物6 为异东莨菪内酯,同时与对照品的保留时间及碎片离子相比较,鉴定化合物14 为东莨菪内酯,推测此化合物可能的裂解途径见图3。化合物23 一级质谱中准分子离子峰为517.1345 [M +H]+,推测对应分子式为C25H24O12,根据其二级质谱中香豆素的特征碎片163.0389 [M +H-CH2O-C15H16O8]+,结合此成分的相关研究[17-18],推测此化合物为7-O-[4'-O-(3'',4''-dihydroxycinnamyl)-β-D-glucopyranosyl]-6-methoxycoumarin。负离子模式下,化合物12准分子离子峰为161.0244 [M-H]-,对应分子式C9H6O3,二级质谱中丢失1 个羰基或1 个羧基,分别得到碎片离子133.0294 [M-H-CO]-,117.0344 [M-H-COO]-。相同质谱条件下,此化合物与具有伞型花内酯母核的化合物5、6、14二级碎片裂解方式存在吻合,结合对照品及相关文献[19],鉴定此化合物为伞形花内酯。
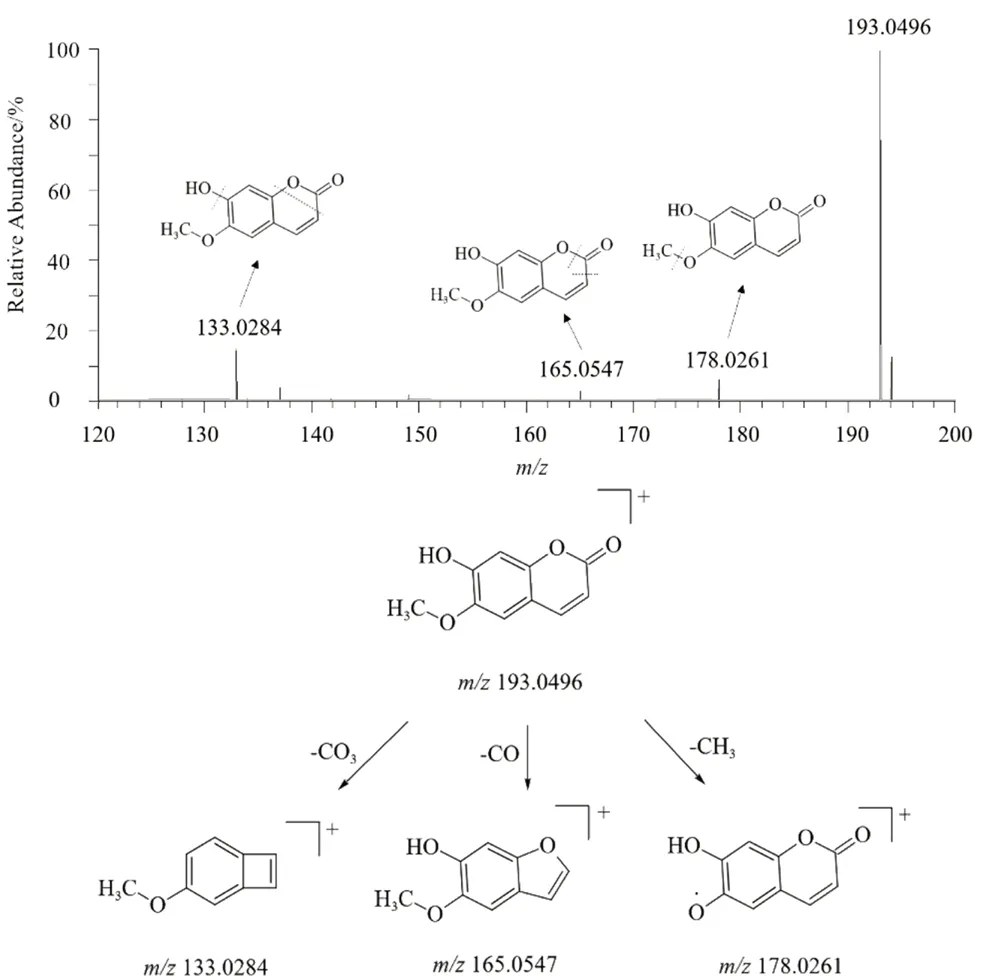
图3 东莨菪内酯正离子模式下的二级质谱图及裂解途径Fig 3 MS2 spectrum and fragmentation pathways of scopoline at positive ion mode
3.3 酰胺类
从飞蛾藤中鉴定出酰胺类化合物4 个,分别为化合物19、20、27、28,其中化合物19 与27、20 与28 分别为同分异构体。负离子模式下,化合物19 分子离子峰为282.1136 [M-H]-,化合物27 分子离子峰为282.1135 [M-H]-,对应化合物分子式为C17H17O3N,化合物19 的极性相较于化合物27 更大,初步推测化合物19 为N-反式-对香豆酰酪胺,化合物27 为(E)-N-2-(2,3-二羟基苯基)乙基肉桂酰胺。化合物19 的二级质谱中,282.1136 [M-H]-失去C8H8O,得到香豆酰胺部分的碎片离子162.0562 [M-H-C8H8O]-,162碎片离子继续失去1 个酰胺基团得到特征碎片离子119.0502 [M-H-C8H8O-CONH]-。化合物27 的二级质谱中282.1135 [M-H]-直接丢失C8H9O2,得到肉桂酰胺部分碎片离子145.0296 [M-HC8H9O2]-,或在162 碎片基础上继续丢失1 个酰胺基团得到特征碎片离子119.0501 [M-H-C8H9O2-CONH]-。结合相关文献[20-22],推测化合物19 为N-反式-对香豆酰基酪胺,化合物27 为(E)-N-2-(2,3-二羟基苯基)乙基肉桂酰胺。化合物19可能裂解途径见图4。

图4 N-反式-对香豆酰基酪胺负离子模式下的二级质谱图及裂解途径Fig 4 MS2 spectrum and fragmentation pathways of N-transcoumaroyltyramine at negative ion mode
正离子模式下,化合物20 与28 分别推测为N-顺式-对羟基苯乙基阿魏酰酪胺、N-反式-对羟基苯乙基阿魏酰酪胺。其中以N-顺式-对羟基苯乙基阿魏酰酪胺为例,其准分子离子峰为314.1384 [M +H]+,碎片离子峰存在母离子直接丢失基团得到的177.0546 [M +H-C8H9O2]+或121.0648 [M +H-C10H11O3N]+,参考本团队此前对光叶丁公藤的研究[14],结合质谱行为及保留时间,推断化合物20为N-顺式-对羟基苯乙基阿魏酰酪胺,化合物28为N-反式-对羟基苯乙基阿魏酰酪胺。
3.4 黄酮类
黄酮类化合物结构特征明显,质谱特征较强,易产生甲基、羧基、糖苷等碎片离子峰。本研究共从飞蛾藤提取物中鉴定出3 个黄酮类成分,其中化合物24 在负离子模式下,准分子离子峰为463.0083 [M-H]-,推测化合物分子式为C21H20O12,二级质谱中此化合物连续失去1 个吡喃葡萄糖,1 个氢离子,1 个醛基,1 个氧离子,分别得到特征离子301.0342 [M-H-C6H10O5]-,300.0276 [M-H-C6H10O5-H]-,271.0248 [M-HC6H10O5-H-COH]-,255.0298 [M-H-C6H10O5-HCOH-O]-;或2-苯基色原酮部分发生Retro Diels-Alder 反应,C 环裂解得到特征离子151.0037[M-H-C6H10O5-C8H6O3]-,结合相关文献[23-24],推测化合物24 为槲皮素-3-O-β-D-吡喃葡萄糖苷,相关裂解途径见图5。此外,化合物25 与化合物24 母核相同,在负离子模式下二级质谱中先失去1 分子芸香糖,得到碎片离子301.0341 [M-Hrutulosyl]-,其后续裂解途径与化合物24 相似,根据文献参考[25]后,推测化合物25 为芦丁。化合物26 与化合物24 及25 的裂解方式相似,根据其分子离子峰303.0499 [M +H]+,碎片离子峰285.0387 [M +H-H2O]+,153.0184 [M +H-C8H6O3]+,同时参考色谱行为及相关文献[26],推测其为槲皮素。

图5 槲皮素-3-O-β-D-吡喃葡萄糖苷负离子模式下的二级质谱图及裂解途径Fig 5 MS2 spectrum and fragmentation pathways of quercetin-3-O-β-Dglucopyranoside at negative ion mode
3.5 其他类
化合物1 为生物碱类,因此采用响应较好的正离子模式,其准分子离子峰为144.1019 [M +H]+,推测其分子式为C7H13NO2,通过高能碰撞后得到二级质谱中各碎片离子,包括丢失1 个H2O 的碎片离子126.0914 [M +H-H2O]+;或直接丢失C2H6O 得到的碎片离子98.0600 [M +H-C2H6O]+,继续失去1 个甲基得到的碎片离子84.0808 [M +H-C2H6O-CH2]+,根据相关文献报道推测其为包公藤丙素或凹脉丁公藤碱[27],但两者为同分异构体,色谱柱保留时间,裂解方式相似,无法完全根据现有信息区分,因此推测化合物1 为包公藤丙素或凹脉丁公藤碱。化合物4 为糖苷类化合物,在负离子模式下,一级质谱出现分子离子峰359.0992 [M-H]-,推测对应结构式为C15H20O10,二级质谱中失去1 个葡萄糖残基得到碎片离子197.0456 [M-H-C6H10O5]-后,苷元部分与丁香酸的裂解途径相似,分别连续失去甲基、COH、甲基,产生碎片离子182.0219 [M-HC6H10O5-CH3]-,153.0556 [M-H-C6H10O5-CH3-COH]-,138.0323 [M-H-C6H10O5-CH3-COH-CH3]-,结合文献[28-29],推测其为丁香酸葡萄糖苷。化合物10 为醇类化合物,在正离子模式下,其一级质谱的准分子离子峰为165.0759 [M +H]+,推测其对应化合物分子式C6H12O5,二级质谱碎片存在环烷烃的特征碎片簇峰165.0759 [M +H]+,164.0284 [M +H-H]+,120.0197 [M +H-C2H5O]+,119.0189 [M +H-H-C2H5O]+, 或105.9347 [M +H-C2H4O2]+,104.9634 [M +H-HC2H4O2]+,化合物16与化合物10质谱行为基本相同,结合飞蛾藤属有关报道[11],推测化合物10或16 为1β,2β,3α,4β,5α-cyclohexanepentol或其同分异构体。化合物29 为木脂素类化合物,根据其负离子模式下的质谱行为可知,其一级质谱中分子离子峰为745.2682 [M-H]-,二级质谱中连续丢失C7H7O2、C3H5O2、glucopyranosyl 得到碎片峰387.1433 [M-H-C7H7O2-glucopyranosyl-C3H5O2]-,继续丢失1个H2O 得到369.1343 [M-HC7H7O2-glucopyranosyl-C3H5O2-H2O]-, 结合文献[30]推测此化合物为4-{erythro-2-[3-(4-hydroxyl-3-methoxyphenyl)-3-O-β-D-glucopyranosyl-propan-1-ol}-O-medioresinol。
4 讨论
本研究中目标化合物存在较多的同分异构体,如有机酸中的绿原酸及新绿原酸,香豆素中的东莨菪苷及异东莨菪苷,生物碱中的包公藤丙素或凹脉丁公藤碱。由于高分辨质谱技术在一些同分异构体构型指认上的局限性,通常需结合其他信息进行区分。大多根据不同类型化合物的裂解方式进行初步区分,但飞蛾藤中的同分异构体多为同类型或相同母核,裂解方式相似,因此需结合色谱行为、参考文献区分出峰顺序,或根据相关报道的保留时间进行推测鉴定,部分同分异构体核对对照品进一步确认。这些同分异构体化合物的发现,在丰富飞蛾藤成分的同时也给各成分的定性增加了难度。
本研究从飞蛾藤中共鉴定出30 个化合物,包含有机酸类、香豆素类、酰胺类、黄酮类和其他类,其中7 个化合物为飞蛾藤属中首次报道。新报道的化合物中,咖啡酸、绿原酸甲酯及咖啡酸甲酯均为有机酸类的衍生物,具备良好的生物活性,其中咖啡酸可通过降低促炎因子的活性起到抗炎作用,其有机酯衍生物也具有潜在药理活性[31-32];甲酯化绿原酸衍生物能够抑制巨噬细胞RAW 264.7 中肿瘤坏死因子-α(TNF-α)的分泌,抗炎活性强于绿原酸[33];N-顺式-对羟基苯乙基阿魏酰酪胺及N-反式-对羟基苯乙基阿魏酰酪胺此类酰胺类生物碱对NO 的释放均有不同程度的抑制作用[34]。这些活性成分的发现可为飞蛾藤药效物质基础及质量控制的研究提供参考。
本研究利用UPLC-Q-Exactive Focus-MS/MS技术具有高灵敏度、高质量精度、高分辨率等特点,结合现有关于飞蛾藤中已报道的成分,建立了一种快速分析鉴定飞蛾藤中化学成分的方法。结果表明有机酸类、香豆素类、黄酮类、酰胺类成分在飞蛾藤中含量丰富,且因各类型成分性质、结构差异,呈现出多数成分在负离子模式现响应更好的现象。除此以外,正离子模式下存在1 个,负离子模式下存在2 个响应度较高的化合物未推测鉴定出,表明飞蛾藤中尚有大量未知成分需要进行系统地植物化学分离、鉴定。

