外来入侵植物病毒在我国的发生、危害与管理
陈雅琳, 乔 蕊, 潘萌娇, 周雪平, 李方方
(中国农业科学院植物保护研究所, 植物病虫害生物学国家重点实验室, 北京 100193)
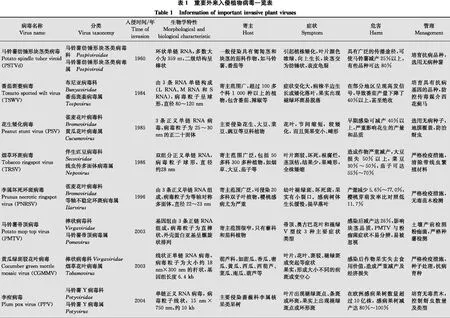
由于全球气候变暖和国际贸易等行业快速发展的全球经济一体化,外来生物入侵已成为严重的全球性问题,对各国的生态环境、农业发展造成了重大阻碍。目前外来生物入侵也被认作是21世纪五大全球性环境问题之一,开展外来入侵生物的防控已是全球各国政府关注的主要环境问题和工作重心之一[1-2]。在国际环境中,气候变化和人口压力正在推动农业实践和种植制度的迅速改变,这将会导致破坏性的植物病毒病的暴发。由于农业全球化和国际贸易,病毒及其载体传播到新的地理区域,给粮食生产和自然生态系统带来意想不到的后果,植物病毒病已成为21世纪全球农业面临的重大挑战。根据病毒入侵时间[3],我们总结出我国重要外来入侵植物病毒的种类包括:马铃薯纺锤形块茎类病毒potato spindle tuber viroid (PSTVd)、番茄斑萎病毒tomato spotted wilt virus (TSWV)、花生矮化病毒peanut stunt virus (PSV)、烟草环斑病毒tobacco ringspot virus (TRSV)、李属坏死环斑病毒prunus necrotic ringspot virus (PNRSV)、马铃薯帚顶病毒potato mop-top virus (PMTV)、黄瓜绿斑驳花叶病毒cucumber green mottle mosaic virus (CGMMV)、李痘病毒plum pox virus (PPV)、番茄黄化曲叶病毒tomato yellow leaf curl virus (TYLCV)、木尔坦棉花曲叶病毒cotton leaf curl Multan virus (CLCuMuV)、玉米褪绿斑驳病毒maize chlorotic mottle virus(MCMV)和番茄褐色皱果病毒tomato brown rugose fruit virus (ToBRFV)等。本文将对这12种重要外来入侵植物病毒的相关知识进行梳理,提出适合我国入侵植物病毒的防治建议。
1 重要外来入侵植物病毒
1.1 马铃薯纺锤形块茎类病毒(PSTVd)
马铃薯Solanumtuberosum是我国第四大粮食作物,自2015年起, 我国开始逐步推进马铃薯主粮化战略。由于马铃薯在生产上主要靠种薯无性繁殖,病毒可通过马铃薯块茎进行世代积累和传递,导致马铃薯产量和品质大大降低。马铃薯纺锤形块茎类病毒potato spindle tuber viroid (PSTVd)是严重影响我国马铃薯生产的检疫性病毒,感病马铃薯会出现严重的症状。PSTVd是侵染植物的最小的植物病原物之一,它是一种环状、单链、无蛋白质包被的RNA。其RNA长度通常为359 nt,由于其碱基高度配对,可折叠成稳定的棒状二级结构,能够在寄主体内增殖和移动[4-5]。
1922年在北美发现PSTVd引起的病害,1971年PSTVd被首次分离出来。目前,PSTVd已经在40多个国家被发现,分布于欧洲东部、中亚地区、中美洲、澳大利亚等地区。在我国,PSTVd引起的病害于1960年在黑龙江省首次发现,之后在河北、江苏、内蒙古、青海等省份相继发生[6-7]。在田间,除马铃薯外,PSTVd还可侵染番茄Lycopersiconesculentum、辣椒Capsicumannuum等多种作物,造成严重的经济损失[8]。
感染PSTVd 后马铃薯表现的症状与植株生长环境、病原的致病株系以及马铃薯的品种有关。一般PSTVd可引起植株矮化、叶片皱缩、块茎畸形变小、产量降低等,一些易感品种感病后减产达 80%。感病较轻的马铃薯不表现症状,感病重的马铃薯则接近绝产,并且其症状可随感染代数的增加逐年加重。田间生产中,带毒马铃薯种薯传播PSTVd的效率很高,因此北美等地区主要是通过严格控制种薯质量来达到清除田间PSTVd的目的[9]。PSTVd在田间主要以无性繁殖的方式通过农具机械、块茎切分等接触的途径在马铃薯间传播。PSTVd 也可以通过种子传播,或通过花粉或者卵细胞传给马铃薯实生种子,使其杂交后代携带PSTVd,严重影响马铃薯杂交育种工作。
1.2 番茄斑萎病毒(TSWV)
番茄斑萎病毒tomato spotted wilt virus (TSWV)是蔬菜作物生产的主要威胁之一,造成全世界超过10亿美元的损失,宿主范围超过1 090种植物,超过100个科,包括番茄、豆类、生菜Lactucasativavar.ramosa、花生Arachishypogaea、辣椒、马铃薯和烟草Nicotianatabacum等。番茄斑萎病于1915年在澳大利亚首次被发现,然而,直到1930年才确定该病的病原为番茄斑萎病毒。随后TSWV逐渐蔓延到欧洲、非洲、北美洲和南美洲,亚洲东亚、中东国家[10]。我国1984年首次在广州发现TSWV,之后TSWV相继在甘肃、贵州、青海、云南、四川、宁夏、陕西、山东、台湾等地大面积发生,造成巨大的经济损失[11 -12]。
TSWV不仅通过西花蓟马Frankliniellaoccidentalis传播,也在其体内复制,因此,该昆虫不仅是传毒介体,还是一种病毒宿主[12]。西花蓟马在其幼虫期从受侵染的植株获得病毒,并在幼虫期结束时将病毒转移到健康植株上。由于西花蓟马的大面积发生,TSWV已经在部分地区呈现高发信号。土耳其对感染TSWV的番茄的产量开展了研究,发现 TSWV分别导致番茄产量和市场价值下降了42.1%和95.5%[13]。
TSWV的基因组由3条RNA单链,L RNA、M RNA和S RNA构成。L RNA长约8.9 kb,是反义RNA链,编码331 kD的RNA依赖的RNA聚合酶(RdRP);M RNA长约4.8 kb,是双义RNA链,M片段的反义RNA链编码2个糖蛋白G1和G2,正义RNA链编码33.6 kD非结构蛋白NSm;S RNA长约2.9 kb,是双义RNA链,S片段的反义RNA链编码28.8 kD的 CP蛋白,正义RNA链编码52.4 kD 非结构蛋白 NSs[14]。TSWV病毒粒体有包膜,大致呈球形,直径80~120 nm[14]。
不同发育期的番茄受TSWV侵染后的症状有所不同。苗期:生长点和新生叶片颜色变为铜色并上卷,后出现黑环状斑块,叶背沿叶脉部位变紫,植株矮化,生长速度变缓,出现萎蔫等病症;坐果期:果实表面出现淡绿环形斑,表面轻微凸起并有细微轮纹;青果期:果实表面出现褐色坏死斑块、瘤状突起,果实极易脱落;果实成熟期:轮纹更加明显,出现许多红白或红黄相间的轮纹斑块,严重时整个果实褐色坏死,且果实脐部症状与脐腐病十分类似[15]。
番茄种植者为控制这种致命病毒付出过巨大的努力,然而想要彻底控制TSWV难度很大,主要有几个因素,包括TSWV分离株具有多样性、TSWV在传毒媒介中的增殖、传播效率高、西花蓟马分布广泛以及对杀虫剂易产生耐药性等。因此,培育具有抗病基因的番茄品种是防治这种病毒的当务之急[11, 15-16]。

1.3 花生矮化病毒(PSV)
1966年花生矮化病毒peanut stunt virus (PSV)在美国被首次报道,迄今已报道过该病毒病的国家包括法国、德国、匈牙利、中国、日本、韩国等。我国于1985年才首次报道了PSV,但从20世纪70年代开始由PSV引起的花生病害就一直存在,其中山东、河北、河南等北方主产区损失相对较大。一些相关调查显示,该病害1976年-1977年在山东省花生生产区的流行尤其严重,病株率20%~30%,重者60%以上,严重的地块几乎绝产[17]。PSV弱毒株系PSV-Mi于1985年在我国被分离和鉴定,但直到2005年其全长序列才被克隆,进化树和遗传多样性分析表明,来源于我国的PSV-Mi属于一个新的PSV亚组[18-19]。
PSV的基因组为正单链 RNA,含 3条正义单链RNA(RNA1,RNA2和RNA3),此外还有亚基因组 RNA4。RNA1全长3 347~3 357 nt,RNA2全长2 942~2 966 nt,RNA3全长2 177~2 188 nt。RNA1编码1a蛋白,RNA2含两个开放阅读框(ORF),编码2a和2b蛋白,部分序列重叠。1a、2a蛋白与病毒复制相关,2b蛋白与病毒的寄主范围和症状表现相关。RNA3上游编码3a蛋白,为运动蛋白(MP),与病毒在细胞间移动相关;下游ORF为CP基因,CP蛋白由亚基因组RNA4翻译。病毒粒子为25~30 nm的正二十面体,PSV的外壳蛋白是分子量为26 kD单体多肽[19 -20]。
我国PSV 引起的病害又称花生普通花叶病,为我国北方花生产区常见的病害,在流行年份其发病率通常大于50%。花生矮化病毒可通过种子传播,在田间也可由豌豆蚜Acyrthosiphonpisum、桃蚜Myzuspersicae传播[17, 21]。花生生长早期感染 PSV 后可减产40%以上,感染后的花生表现为荚果变小畸形,花生的产量和品质严重下降。在自然条件下,PSV可侵染大豆Glycinemax、豌豆Pisumsativum、菜豆Phaseolusvulgaris等豆科植物,以及芹菜Apiumgraveolens、烟草等,寄主范围广泛[21]。
1.4 烟草环斑病毒(TRSV)
烟草环斑病毒tobacco ringspot virus (TRSV)是伴生豇豆病毒科Secoviridae线虫传多面体病毒属Nepovirus的代表种,是我国公布的二类进境检疫性有害生物。TRSV于1927年首次发现于美国,目前已在50多个国家发生,且广泛分布于美国中西部和加拿大、欧洲、亚洲、非洲、澳大利亚。我国于1986从1981年采集的样品中首次鉴定出TRSV[22]。除烟草外,TRSV还能侵染豆科和茄科作物,引起大豆产量损失50%以上, 菜豆减产30%~50%, 茄子减产可达55%~70%[23]。
TRSV的寄主范围广泛,能够侵染马铃薯、烟草、大豆等54科300多种的植物,可通过嫁接、带毒种子以及昆虫介体传播,种子和无性繁殖材料是TRSV远距离传播的主要方式。其传播媒介有美洲剑线虫Xiphinemaamericanum、桃蚜、烟蓟马Thripstabaci等。其病毒粒子球形,基因组为两条正义单链RNA,RNA1编码RdRP,RNA2编码MP和CP[24 -25]。
TRSV侵染后的症状因寄主不同而有所不同。一般在生长初期,新生幼嫩植株上呈现的症状较严重,在生长后期不显著。通常植株感染TRSV后的症状表现为叶片上出现环状或线状纹、褪绿斑或坏死斑,根腐烂,茎顶枯,结果少,果畸形,节间缩短及矮缩,有些产量降低[26 -29]。
1.5 李属坏死环斑病毒(PNRSV)
李属坏死环斑病毒prunus necrotic ringspot virus(PNRSV)是一种在世界范围内广泛发生的病毒,属于雀麦花叶病毒科Bromoviridae等轴不稳定环斑病毒属Ilarvirus成员。自1941年在桃Prunuspersica和李Prunussalicina树上首次发现PNRSV以来,该病毒已经在世界多个地区被报道[30]。我国于1996年在陕西省西安市甜樱桃Prunuspseudocerasus园首次发现并报道了PNRSV[31],目前该病毒在我国东北、华北、华南、西南地区均有过发生和报道。2016年在我国甘肃、河北、河南、辽宁和山东的国产苹果Maluspumila中发现该病毒,感病苹果树叶片均出现花叶和黄脉带状症状[32]。据统计,在桃树上PNRSV单独侵染使植株生长量和产量分别降低12.2%~32.8%和5.6%~77.0%;当其与李矮缩病毒prune dwarf virus (PDV) 混合侵染时,生长量和产量减少49.5%和32.8%,由此失去商品价值;在苗圃内受PNRSV侵染的樱桃芽萌发率比对照低11.7%[32]。
PNRSV为多分体病毒,基因组由3条正义单链RNA组成:RNA1和RNA2分别编码复制酶蛋白P1、P2,RNA3编码MP和CP。病毒粒子形态为等轴对称多面体,直径22~23 nm[33]。
PNRSV的寄主范围广泛,在天然和人工接种的条件下,可侵染的双子叶植物达21科,其中木本寄主植物中李属有400余种,包括桃、李和樱桃,对樱桃的危害尤其严重。其他的木本寄主有西洋梨Pyruscommunisvar.sativa、森林苹果Malussylvestris、秋海棠Begoniagrandis等[34]。
在桃树上, 被PNRSV侵染的植株, 有些在春季新生叶片上出现褪绿环形斑、坏死斑,但在夏季时症状不易被识别;有些品种在春季不会出现明显的症状,夏季果实缝合线处会出现细小裂口。在樱桃上,尚未完全展开的叶片上会产生淡黄绿色至绿色环形斑或穿孔,穿孔孔洞的边缘微突。在苹果树上,叶片上形成花叶、条斑、镶边、环斑、斑驳等不同类型症状,感病树体的生长速度缓慢并提早落叶[35]。
PNRSV传播途径包括人为的运输、嫁接等,也可通过线虫、菟丝子等媒介传播[34]。
1.6 马铃薯帚顶病毒(PMTV)
马铃薯帚顶病毒potato mop-top virus (PMTV)为马铃薯帚顶病毒属Pomovirus成员。1966年在苏格兰和北爱尔兰地区首次发现通过土壤传播的PMTV。近几年该病毒分布的范围逐渐扩大,主要分布在北欧地区以及北美地区。虽然张仲凯等在2003年通过电镜观察发现云南省马铃薯病样中存在疑似PMTV的病毒颗粒[36],一些综述文章也声称我国早就存在PMTV,但并未通过血清学与分子生物学鉴定。直到2013年,在我国广东惠东县冬季马铃薯中发现了具有坏死环/弧的马铃薯块茎,随后通过核酸检测和PMTV抗体酶联免疫吸附试验正式确认PMTV在我国发生[37]。最近几年在国内多个地区,频繁地出现PMTV发生的报道[38],表明PMTV的传播速度比较迅速且不容易被控制,需要引起高度重视。
PMTV病毒粒子为直棒状,一般100~150 nm或(250~300)nm×(18~20)nm。其基因组由3条正链的RNA组成。感病植株主要呈现出3种症状:奥古巴花叶,植株基部叶片出现不规则黄色斑块、环纹和线状纹,植株不矮缩;帚顶,主要表现节间缩短,叶片簇拥变小,叶缘波浪状卷起,植株矮化束生;褪绿V形纹,常发生在植株上部的叶片,由无症状到表面产生环斑、裂缝和畸形,发生程度依品种而异[39 -40]。
PMTV寄主范围较窄,一般为藜科和茄科植物。PMTV可以通过马铃薯粉痂菌Spongosporasubterranean和汁液摩擦两种方式侵染番茄、烟草和龙葵Solanumnigrum,通过人工接种的方式侵染菠菜Spinaciaoleracea、甜菜Betavulgaris和杂草藜Chenopodiumalbum[40]。PMTV除通过土壤传播外,还可以通过带毒的马铃薯块茎传播且传播迅速。此外粉痂菌是PMTV的主要寄主,并且PMTV的分布也同粉痂菌的分布大致相同,说明PMTV在没有马铃薯块茎和土壤时也可以通过其寄主增殖和传播[40]。
1.7 黄瓜绿斑驳花叶病毒(CGMMV)
黄瓜绿斑驳花叶病毒cucumber green mottle mosaic virus(CGMMV)属于棒状病毒科Virgaviridae烟草花叶病毒属Tobamovirus。该病毒粒子呈杆状,大小约300 nm×18 nm。CGMMV的基因组为正义单链RNA,全长约6.4 kb,编码4个蛋白质,其中186 kD和129 kD蛋白质为病毒复制和转录相关蛋白,29 kD蛋白质为MP,17.3 kD蛋白质为CP[41 -42]。
在世界上很多国家和地区,CGMMV都是葫芦科作物上的重要检疫性病毒。该病毒可引起植株叶片黄化以及畸形、生长缓慢、结果推迟、果实黄化或变白并可产生墨绿色水疱状坏死斑块,产量损失十分严重[43-44]。1935年英国首次报道了CGMMV,随后西班牙、波兰、乌克兰等欧洲国家相继报道了CGMMV。60年代由于西瓜Citrulluslanatus、黄瓜Cucumissativus等作物的引种,CGMMV传入了亚洲的印度和日本。随后在沙特阿拉伯、以色列等国家也发现该病毒,目前CGMMV已在世界上30多个国家和地区发生。2003年,在我国辽宁地区的黄瓜和西瓜中报道了一种具有典型CGMMV所致症状的病害,经鉴定其病原为CGMMV[41]。值得重视的是,2005年,我国辽宁盖州由于种子带毒而导致的大面积西瓜感染了CGMMV,使其失去了食用价值。在西瓜上,2011年-2013年,在我国山东、江苏、浙江等省份均有报道CGMMV大面积发生[45]。近年来,CGMMV已成为我国许多省份葫芦科作物上常见的病毒。根据目前在NCBI上登录的我国CGMMV全长序列分离物的信息以及CGMMV病症描述的报道,该病毒已经广泛分布于我国辽宁、河北、山东、河南、安徽、江苏、浙江、上海、湖北、湖南、广西、广东和海南等地。
CGMMV侵染的大多数植物都属葫芦科。这些包括很多瓜类水果和蔬菜,如甜瓜Cucumismelo、西瓜、黄瓜、南瓜Cucurbitamoschata、笋瓜Cucurbitamaxima、冬瓜Benincasahispida、葫芦Lagenariasiceraria、广东丝瓜Luffaacutangula、苦瓜Momordicacharantia等。通常寄主被CGMMV侵染后叶片主要的表现为花叶、斑驳、褪绿、突起等症状,果实上会形成大小不一的病斑或空心,发病严重时可导致无法结果。黄瓜受侵染后最开始在新生叶片上出现黄色小点,后扩展为花叶并伴随有深绿色瘤状突起;在侵染初期果实出现淡黄色圆形斑,后发展为绿色突起并产生畸形[42, 46]。CGMMV寄主范围虽然较为狭窄,但是其分布广泛,一旦传入后,扩散的可能性非常大。CGMMV 既可通过整枝、打杈和嫁接等农事操作传播,也可通过土壤、灌溉水、花粉、种子和菟丝子传播[46]。可见该病毒可通过多种渠道传播,预防和治理非常困难。
1.8 李痘病毒(PPV)
李痘病毒plum pox virus (PPV)为马铃薯Y病毒科Potyviridae马铃薯Y病毒属Potyvirus成员,引起李痘病,是核果作物中最具毁灭性的病毒病害。该病毒于1932年在欧洲东部保加利亚被发现并迅速传播至地中海沿岸及欧洲大部分地区,之后又在南美以及北美等地区被发现[47]。2004年在我国湖南发现其危害杏树Prunusarmeniaca[48],并于2007年被列入《中华人民共和国进境植物检疫性有害生物名录》。我国作为世界上最大的核果生产国,其核果病毒的发生频率和分布仍不清楚。 2008年-2018年对我国核果类果树进行了系统调查[49],结果发现PPV主要分布在杏和梅Prunusmume上,后者的平均发病率大于30%;在北京、南京、上海、武汉、无锡和运城采集的样本中, 96% (67/70) 的样品表现病毒症状,77% (85/110) 样品可以通过免疫层析条带试验和RT-PCR检测到PPV;对4个分离株 (3个来自梅,1个来自杏) 的全基因组序列测定和系统发育分析表明,尽管基因组大小略有差异,但4个分离株均属于PPV-D分支。 这些发现不仅揭示了PPV在我国的广泛发生和分布,而且为我国PPV分离株的基因组特征和进化位置提供了详细的信息。
PPV含有1条正义单链RNA,其病毒粒子线状,长750 nm,宽15 nm,基因组长度约10 kb,包被在由2 000个亚基构成的外壳蛋白中。与其他马铃薯Y病毒属的病毒一致,该病毒的蛋白翻译策略为:先翻译一个特殊的长的开放阅读框,后通过蛋白酶加工产生成熟的病毒蛋白[50]。
PPV主要侵染蔷薇科李属果树,包括桃、杏、李、日本李P.salicina等及其杂交种。处于不同生长期的寄主均可被PPV侵染,并且在叶片、树枝、树皮、花瓣、果实及果核等不同组织都可以表现出病毒症状。春季感病的桃树叶片上产生的症状尤其明显,如产生褪绿斑点、条斑或环斑甚至畸形等症状,并且有些桃树的品种还出现了断花等症状[51]。PPV主要的传播介体是蚜虫,有翅蚜在感病后的植株上取食后可迁飞到其他健康植株上继续为害。因此, 感染PPV的植株数量一般与有翅蚜的种群密度相关[52]。此外,PPV还可以通过嫁接或出芽传播,感染病毒的树是无法治愈的,病毒症状会随着时间恶化。现阶段抗PPV的种质资源十分稀缺,目前还没有优良的自然抗性被整合到李属的优良品种中。
1.9 番茄黄化曲叶病毒(TYLCV)
番茄黄化曲叶病有“番茄癌症”之称,其主要病原番茄黄化曲叶病毒tomato yellow leaf curl virus (TYLCV)是一种毁灭性的蔬菜病毒。TYLCV属双生病毒科Geminiviridae菜豆金色花叶病毒属Begomovirus成员。TYLCV是具有孪生颗粒形态的单链DNA病毒,病毒粒子为双联体结构,大小约为18 nm×30 nm,无包膜[53]。该病毒于1939年在以色列被发现,1959年在约旦大面积暴发,2006年传入我国[54]。该病毒病害在中东、东亚、东南亚、非洲等多个国家以及地区发生,给番茄造成严重的损失。随全球气候变化、农耕制度改变、国际贸易活动加强以及介体昆虫烟粉虱Bemisiatabaci在世界的扩展,TYLCV有蔓延的趋势,其已经成为影响全世界番茄生产减产的主要因素之一[53 -54]。
TYLCV主要通过烟粉虱传播,烟粉虱获毒后,可以终生传毒但不经卵传播,一些研究表明TYLCV也可通过嫁接传播,但不能通过摩擦或种子传播。据报道,目前该病毒可以侵染茄科、豆科等20多种植物,在这其中,易感病的寄主为:本氏烟Nicotianabenthamiana、曼陀罗Daturastramonium、烟草、心叶烟Nicotianaglutinosa、苦苣菜Sonchusoleraceus、菜豆等。受侵染的植株发病症状与病毒株系、寄主的遗传背景、生长阶段以及寄主所处的环境条件有关。发病植株的典型症状为顶部叶片变小、皱缩卷曲黄化,节间缩短以及植株明显矮化,开花延迟、花朵减少,坐果少而小,成熟期果实不能正常由绿转红,且成熟状况不均匀[55]。番茄各生长阶段均可感染该病,若在开花前感病,果实产量和商品价值均会大幅下降,严重时可造成100%的产量损失[55-56]。值得注意的是,由于该病毒的传毒介体B型和Q型烟粉虱的大规模暴发,该病毒自从2006年在我国上海发现后,目前已经快速传播和分布到我国绝大多数省市[54]。
1.10 木尔坦棉花曲叶病毒(CLCuMuV)
在棉花生产上,棉花曲叶病是世界范围内最具毁灭性的病毒病害, 木尔坦棉花曲叶病毒 cotton leaf curl Multan virus(CLCuMuV)是造成棉花曲叶病的主要病原之一。CLCuMuMV也是双生病毒科菜豆金色花叶病毒属成员[57-58]。CLCuMuV的病毒粒子大小、形态以及基因组结构与TYLCV类似。在自然条件下CLCuMuV由烟粉虱传播,也可以通过嫁接方式传播,但无法通过摩擦接种传播。棉花曲叶病最早报道于尼日利亚,随后在苏丹(1924年)发现该病害。1967年在巴基斯坦发现棉花曲叶病,1988年后该病在巴基斯坦棉区开始大流行,给棉花生产造成巨大的经济损失。另外,印度、埃及和南非等国也报道了该病害的严重发生与为害。在我国,2006年首次发现由CLCuMuV侵染引起的朱槿曲叶病[57]。随后,陆续在广东、广西等多个省市发现CLCuMuV侵染棉花Gossypiumhirsutum、垂花悬铃花Malvaviscusarboreus等多种植物。
通过测定和分析34个地理上和/或时间上不同的CLCuMuV分离株和其他6个在我国公开的CLCuMuV基因组的全序列,40株CLCuMuV分离株具有99%的同源性。CLCuMuV和CLCuMuV伴随的卫星CLCuMuB在我国具有较高的遗传同源性,表明它们是由单一的毒株进化的[59]。此外,来自不同地区CLCuMuV的卫星群体表现出较高的突变率。虽然在进化上有联系,但这些种群在不同地区独立进化[60]。这些研究结果将有助于全面了解世界主要产棉区CLCuMuV群体的遗传变异现状和进化模式。
受该病毒侵染后的植株表现的症状为全株的叶片上卷、叶脉肿大、产生叶耳、开花少甚至不开花等[58]。在我国各地,该病毒病的传播媒介烟粉虱已普遍发生,该病害很可能随烟粉虱快速扩散传播[61-62]。因此,CLCuMuV对我国棉花等作物的威胁日益增强, 相关部门应采取有效的防控措施进行管控,防止其进一步扩散。
1.11 玉米褪绿斑驳病毒(MCMV)
玉米褪绿斑驳病毒maize chlorotic mottle virus (MCMV) 是我国重要的检疫性病毒,属于番茄丛矮病毒科Tombusviridae玉米褪绿斑驳病毒属Machlomovirus,并且是该属的唯一成员。MCMV于1971年首次在秘鲁发现,目前在巴西、美国等美洲国家,泰国、中国等亚洲国家以及刚果、肯尼亚等非洲国家都有广泛的分布。2009年我国首次在进境玉米种子中检测到MCMV[63-64]。MCMV单独侵染玉米时产生轻微的病毒症状,主要可使玉米叶片产生褪绿斑驳的症状以及使植株生长缓慢等,可致使玉米的产量比对照降低10%~15%,但当与玉米矮花叶病毒 maize dwarf mosaic virus (MDMV)、小麦线条花叶病毒 wheat streak mosaic virus (WSMV) 或甘蔗花叶病毒sugarcane mosaic virus (SCMV) 等马铃薯Y病毒科的病毒复合侵染时可发生协生作用,引起非常严重的玉米病毒病害—玉米致死性坏死病 (maize lethal necrosis disease, MLND),可导致植株系统性坏死,使玉米产量损失达到90%[63-65]。
MCMV含有一条长约4.4 kb的基因组RNA,并且能在寄主细胞中合成两条亚基因组RNA (subgenomic RNA, sg RNA),分别为1.47 kb的sg RNA1、0.34 kb的sg RNA2。病毒粒子的直径约30 nm,由CP蛋白及其包裹的单链正义RNA构成,病毒粒子呈二十面体结构[66]。玉米Zeamays和甘蔗Saccharumofficinarum等是MCMV的天然寄主。MCMV不能侵染双子叶植物,但能侵染多种单子叶植物。大麦Hordeumvulgare、小麦Triticumaestivum、高粱Sorghumbicolor、黍Panicummiliaceum等均可被MCMV侵染,是MCMV的实验寄主[66]。
1.12 番茄褐色皱果病毒(ToBRFV)
近年来,一种新的烟草花叶病毒属Tobamovirus病毒番茄褐色皱果病毒tomato brown rugose fruit virus (ToBRFV) 在欧洲、美洲和亚洲等多个国家和地区的茄科作物产区发生为害,严重影响了茄科作物的产品质量以及产量。2014年,在约旦温室种植的番茄上发现了轻微的花叶以及叶片畸形等病毒病的症状,并且其果实上出现了严重的着色不均、褐色皱纹等症状,使番茄的商品质量以及产量受到影响。在全球范围,该病毒已快速扩展至欧洲、美洲多地,ToBRFV已经被欧洲及地中海植物保护组织(European and Mediterranean Plant Protection Organization, EPPO)添加到了警戒名单中。我国山东于2019年首次报道该病毒侵染番茄,鉴于其传播速度快,在我国茄科产区急需加强该病毒的监测[67]。2019年,山东禹城地区3个大棚的番茄,ToBRFV发病率约为50%[67]。山东省是我国最大的蔬菜生产和苗木调度中心,也是我国最重要的设施蔬菜种植区。因此,相关部门应该警惕ToBRFV在茄科作物上的暴发性危害以及在我国的快速扩展[68]。
ToBRFV为正义单链RNA病毒,病毒粒子呈杆状,宽约18 nm,长约300 nm,与典型的烟草花叶病毒属病毒粒子形态特征类似[69]。
目前报道 ToBRFV的自然寄主主要有番茄和辣椒。感染病毒的番茄叶片的主要症状为花叶、深绿色突起、叶片变狭窄、叶脉黄化等,严重时叶片坏死,花和果实数量减少,果实上出现黄色或褐色的斑块,果实变小,出现皱纹,严重时会导致果梗的坏死;在辣椒上的症状主要表现为植株发育缓慢,叶片上有褶皱和黄色的斑驳状,严重时果实畸形[70]。ToBRFV 通过机械接触传播,这意味着该病毒的传播媒介极其广泛,只要能与其接触的都有一定几率会成为ToBRFV传播的媒介。对于此类病毒的防控,主要集中在切断传播途径这一方向上[71]。
2 检疫性植物病毒管理对策
根据我国农业部门的初步调查总结,目前我国外来物种入侵的严峻形势,主要存在3个特点:入侵物种发生种类多、入侵物种分布范围广、入侵生物危害严重[72]。为减少入侵植物病毒在我国的为害与扩散,提出以下建议:
首先,为了防止破坏性的植物病毒大流行,必须实施检疫限制,还要在陆地边境、海港和机场防止病毒传入[73]。当阻止病毒进入的尝试失败时,需要立即应用旨在根除或遏制入侵的检疫规定,以防止进一步的传播。应尽量减少任何入侵成功的可能性,这对于防止破坏性植物病毒病害向更多的地方传播至关重要。值得注意的是,当通过种子传播的病毒通过国际贸易在不知情的情况下远距离传播时,为了避免这种无意的引入,不仅要在收获前监测种子作物的病毒症状,采集其叶片进行病毒检测,还需要在收获后对具有代表性的种子样本进行病毒检测[73]。此外,在这种检测不够严格的情况下,作为预防措施,进口国仍需要在每个进口种子发布前检测具有代表性的样品。
当植物病毒已经入侵时,需要制定综合的病毒病管理计划,以确保有效地控制。设计这些方法需要了解致病病毒的生物学特性以及流行病学。通过结合适当的植物检疫、栽培、化学农药和寄主抗性等防控措施来优化病毒病害控制的有效性,进行综合病害管理,这些措施的作用各不相同,并针对病毒病害周期的不同部分。目前我国也正在制定包括植物检疫和栽培控制措施在内的更全面的方法,以管理由入侵性植物病毒引起的病害[72]。
为了遏制病毒入侵的源头,从其他国家引进新品种以及在国家或地区之间进行育种材料交流、保存植物种质时必须生产脱毒植株。体外技术是根除病毒最成功的方法,离体培养技术是生产脱毒植株最成功的策略。到目前为止,已经建立了多种根除植物病毒的方法,包括茎尖培养(也称分生组织培养)、微嫁接、化疗、热疗和茎尖冷冻治疗[74]。积累的数据证明,多种方法结合比单独使用更可有效地去除病毒。例如,茎尖冷冻疗法完全不能根除树莓丛矮病毒raspberry bushy dwarf virus (RBDV)[75]和苹果茎沟病毒apple stem grooving virus (ASGV)[76],而热疗法与茎尖冷冻疗法相结合,分别有33%和100%的植株脱除了RBDV[77]和ASGV[75]。
使用抗病毒作物品种是减少病毒感染造成损失的一种传统而有效的方法。然而,传统的抗病毒育种策略,即使加上现代分子技术,如数量性状位点定位、标记辅助选择和基于全基因组序列的方法,都是缓慢和费力的,并且需要对多个世代的大型作物群体进行监测[78]。因此,为了优化外来入侵植物病毒控制的管理措施,还应采用新技术,例如利用目前高效的新工具技术NGS(next generation sequencing,二代测序)和生物信息学方法来研究病毒多样性和宿主在转录组上对病毒侵染的反应[79],可以加快入侵植物病毒的研究进程。通过利用基于核酸的生物防治技术,如RNAi(RNA interference, RNA干扰)和CRISPR/Cas9技术[79],可以大大缩短抗病毒作物育种的周期。现阶段围绕RNAi和CRISPR应用的商业预期正在上升,农业生物技术领域的巨头,如拜耳作物科学,孟山都和先正达,以及许多其他新开发的公司[80]对基于RNA的喷洒技术有着极大的兴趣。这一趋势得到了RNAi相关物质的简单化生产和成本降低的支持[81]。目前研究人员正在开展大量工作,以扩展和优化基于RNAi的工具(dsRNAs、amiRNAs、tasiRNAs等),用于局部施用以增强植物对病毒的抗性[82]。CRISPR/Cas9系统具有操作简便、突变效率高和成本低等优势,能够通过寻找和编辑外源的核酸或者内源的隐性抗病基因产生抗病毒的植物材料。然而,类似其他技术,CRISPR/Cas9在传递病毒的抗性方面也有一些缺陷,比如容易脱靶以及切割后产生新病毒的风险。因此CRISPR基于CRISP/Cas免疫系统设计抗病毒的策略在大规模应用田间之前应该合理、谨慎设计靶点序列。此外,还包括结合精准农业部署遥感等在内的高效新工具技术[73],可分析预测:1)通过卫星监控某区域范围内病毒病害的发生和流行;2)通过轻型无人飞行器在小范围内监察外来入侵植物病毒;3)制定防控措施的具体目标。最后,为了有效地防止外来入侵植物病毒在我国的发生和流行,需要组织多学科之间的协作研究。这需要我们国家的植保研究人员,包括植物病毒学者、昆虫学者和作物育种学者,以及生物信息学专家、统计学专家和社会经济学专家之间的紧密联系。

