2株分泌型铁载体真菌对番茄青枯病的防效
赵江源, 邹雪峰, 何 翔, 张 庆, 杨济达,朱红业, 杨佩文*, 李铭刚
(1. 云南大学云南省微生物研究所, 昆明 650091; 2. 云南农业大学植物保护学院, 昆明 650201;3. 云南省农业科学院农业环境资源研究所, 昆明 650205)
云南省哀牢山国家级自然保护区地处云南横断山脉纵谷地带。东亚季风气候、青藏高原季风气候和南亚东南亚热带季风气候均在此汇集,形成特殊的地形-气候-水文特征耦合。该地区土壤有机质含量丰富,蕴藏着丰富的种质资源[1]。从前期我们对土壤微生物分离、筛选和拮抗试验结果看,该区域原始森林土壤环境中存在丰富的铁载体微生物资源,值得进行深入发掘与利用[2]。
铁元素对微生物生长、发育及代谢过程有重要影响[3-4]。自然界中铁元素主要以不溶解三价态稳定形式存在,为获取铁元素,微生物通常会分泌对铁离子(Fe3+)有螯合能力的铁载体(siderophore)来实现这一过程[5]。微生物铁载体主要类型包括异羟肟酸盐型(hydroxamates)、儿茶酚盐型(catecholates)及羧酸盐型(carboxylates)[6]。
目前,植物病害如番茄青枯病[7]、马铃薯青枯病[8]、烟草青枯病[9]的暴发、主要是青枯雷尔氏菌Ralstoniasolanacearum大量繁殖扩增所导致[10-11],而这其中环境铁元素的分配可能是一个重要原因[12]。正因为如此,如何利用自然界中非病原菌所产铁载体,通过干扰病原菌对铁元素的正常摄取来抑制植物病原微生物生长已成为近年来的研究热点[13]。比如,Solanki等[14]发现,具有铁载体活性的根瘤菌株对水稻纹枯病菌Rhizoctoniasolani抑制活性较强,而不产铁载体菌株的拮抗活性较弱。Dutta等[15]对生防菌进行筛选时,发现防效较强的菌株普遍具有分泌儿茶酚盐型铁载体的能力。Ambrosi等[16]发现,荧光假单胞菌Pseudomonasfluorescens代谢产物中存在大量的羧酸盐型铁载体化合物;其通过分泌一系列铁载体物质来抑制土壤环境中植物病原菌的生长。Fgaier 等[17]基于微生物铁载体铁螯合原理,建立铁载体介入下的微生物群落模型,得出产生铁载体的菌种比其他菌种更具竞争优势的结论,并以此来调控植物病原微生物群落结构和组成[18]。
目前有关铁载体对植物病原菌抑菌活性的研究还相对较少,本研究以分离自云南省哀牢山原始森林土壤中高活性铁载体菌株为材料,分析其铁载体结构类型及其对特定植物病原微生物的拮抗效果和对植物病害的防治效果,可扩充植物病害拮抗菌(剂)范围,揭示铁载体在植物病害防控中的应用前景,为铁载体拮抗菌剂(制剂)的研发、相关作用机制的深入研究奠定基础。
1 材料与方法
1.1 供试菌株
云南木霉Trichodermayunnanense(编号2-14F2)与拟球孢白僵菌Beauveriapseudobassiana(编号2-8F2)分离自云南省哀牢山国家自然保护区原始森林土壤,菌株保藏于中国普通微生物菌种保藏管理中心,保藏编号为CGMCC No.17926与CGMCC No. 21047。青枯雷尔氏菌Ralstoniasolanacearum分离自番茄青枯病病株。供试真菌均在20%甘油中保存于-80℃。试验前先将相关菌株接种在PDA平板上活化至少2代,使其恢复旺盛生长。
1.2 供试溶液及培养基的制备
CAS显色液配制:取0.060 5 g铬天青S (chromeazurol S, CAS)溶于50 mL去离子水中,加入0.002 7 g FeCl3搅拌混匀,标记为A液;再称取0.072 9 g十六烷基三甲基溴化铵溶于40 mL去离子水,标记为B液;最后将A液缓慢倒入B液中,搅拌均匀即可。
指示菌悬液配制:青枯雷尔氏菌斜面试管中加入2 mL无菌水,刮取菌苔,之后用无菌水进行梯度稀释(用酶标仪或分光光度计检测OD625读数),取OD625=0.1菌液配制菌悬液(浓度为1×108cfu/mL)。
PDA培养基:马铃薯200 g/L、葡萄糖20 g/L、琼脂15~20 g、去离子水1.0 L、pH(7.0±0.1);无铁查氏液体培养基:葡萄糖30.0 g/L、硝酸钠2.0 g/L、三水合磷酸钾1.0 g/L、氯化钾0.5 g/L、七水合硫酸镁0.5 g/L、8-羟基喹啉0.75 g/L、去离子水1.0 L、pH(7.0±0.1);NA培养基:蛋白胨10.0 g/L、牛肉粉3.0 g/L、氯化钠5.0 g/L、琼脂15.0 g/L、pH(7.3±0.1);双层显色培养基:底层为5 mL的水琼脂培养基(加2 mL CAS液),上层为5 mL的PDA培养基。
1.3 菌株产铁载体活性测定
用打孔器取菌饼(直径0.5 cm),接种在双层显色培养基的中心上层,每菌株3个重复。将完成接种的培养基放置在(27±1)℃恒温培养箱中培养7 d,观察显色层颜色变化。
挑选培养基底层颜色变红的菌株,加入到无铁查氏液体培养基中,在28℃ 150 r/min的恒温摇床(型号:HS-200B)上培养 48 h,培养结束后吸取2~5 mL培养液用0.22 μm无菌滤膜过滤后加入等体积的CAS检测液,静置1 h后用全波长酶标仪(型号:Multiska GO)测定其 OD630(记作“As”),用相同方法测定未接菌的液体培养基的 OD630作为参比值(记作“Ar”)。铁载体的浓度用铁载体活性单位(siderophore unit, SU)表示,SU=[(Ar-As)/Ar]×100%,测定重复3次,取平均值进行比较分析。
1.4 铁载体活性物质分离
将25 g蒸熟大米装入到500 mL组培瓶中,121℃高压蒸汽灭菌30 min,然后加入1 mL 2-8F2或 2-14F2菌悬液,充分搅拌,放入(37±1)℃恒温培养箱内静置培养30 d。完成发酵后在发酵瓶中加入95%甲醇充分浸泡24 h,用5 mm孔径滤纸过滤。旋转蒸发仪(R-210 BUCHI)温度设置45℃,转数700 r/min,将滤液中有机溶剂完全蒸发。
通过柱层析色谱法分离活性物质。先用正相硅胶 G(200~300目,青岛海洋化学工业制品厂)进行初步划段分离,采用Pan等[20]的方法利用流动相梯度恒速洗脱。经正相硅胶分离的馏分选用Sephadex-LH20凝胶(GE,美国)继续纯化,流动相为甲醇,流速为10 mL/30 min,用自动收集仪收集馏分,每个馏分10 mL,采用CAS液与2% FeCl3检测各馏分显色情况,其中与CAS液反应显红色,同时与2% FeCl3反应显褐色或棕褐色的馏分为活性馏分。根据显色情况合并浓缩活性馏分备用。
获得的铁载体活性馏分减压蒸干后置于冰箱4℃保藏,使用时用去离子水溶解,配制成不同浓度的铁载体溶液。
1.5 铁载体类型判定
1 mL铁载体活性物质中加入1 mL 2% FeCl3溶液,出现红色或紫色表明测试样品中含有铁载体。用紫外分光光度计检测(EU-2200R),在 420~450 nm 之间出现吸收峰则说明螯合物质为异羟肟酸盐型铁载体。
1.6 铁载体活性物质抑菌活性测定
用双层平板培养基测定铁载体活性物质对青枯雷尔氏菌的抑制效果。将圆形滤纸片(直径0.5 cm)在抑菌待测液(0.25 mg/mL的铁载体溶液)中浸泡5 min,备用。在融化的NA培养基(约55℃)中加入400 μL青枯雷尔氏菌菌悬液(1×109cfu/mL),充分摇匀后倒在水琼脂平板上层,待培养基凝固后接入浸泡待测液的滤纸片和未处理的滤纸片(空白对照),滤纸片以培养皿圆心为中心对称放置。每处理3次重复(3个平板)。25℃培养72 h后记录抑菌圈面积。
使用96孔板测定铁载体活性物质对青枯雷尔氏菌的抑制率。板孔中加入100 μL青枯雷尔氏菌菌悬液(浓度为1×108cfu/mL)与100 μL NA液体培养基,之后在96孔板A/B 两排的第一孔中,分别加入100 μL的缺铁(未加FeCl3溶液)与富铁(含1 mol/L FeCl3)的铁载体活性物质溶液,从第一孔开始进行倍半稀释。每孔对应铁载体活性提取物的浓度分别为0.60、0.30、0.15、0.075、0.038、0.0187 5、0.009 mg/mL……以此类推。每处理3个重复(96孔板中3行)。将96孔板放入37℃恒温培养箱16~20 h后,用酶标仪测定 625 nm 处的吸光度,换算成麦氏比浊浓度或微生物的近似浓度,计算杀菌(抑菌)率。计算公式为:抑制率=[对照组微生物浓度(或麦氏比浊浓度)-抑菌待测组微生物浓度(或麦氏比浊浓度)]/对照组微生物浓度(或麦氏比浊浓度)×100%。对照组未添加任何抑菌物质。
1.7 铁载体活性物质抑制番茄青枯病盆栽验证
设置对照组1(CKA):蒸馏水405 mL;对照组2(CKB):蒸馏水400 mL+青枯雷尔氏菌悬液5 mL;处理组1:0.45、0.15 mg/mL和0.05 mg/mL 2-8F2菌株铁载体活性物质处理, 记为2-8F2A、2-8F2B和2-8F2C;处理组2:0.45、0.15 mg/mL和0.05 mg/mL 2-14F2菌株铁载体活性物质处理,记为2-14F2A、2-14F2B和2-14F2C。处理组1、2均为蒸馏水350 mL+各浓度的铁载体活性物质50 mL+青枯雷尔氏菌悬液5 mL。另设置不同浓度的活性物质中添加50 mL FeCl3溶液使其终浓度为1 mol/L 的处理。每处理3次重复。将不同处理的溶液对5株幼苗期的番茄植株进行灌根,然后置于温度(24±1)℃、湿度(85±5)%的恒温恒湿光照人工气候培养箱(MGC-450HP,L∥D=12 h∥12 h),培养30 d,统计植株发病情况。
病害调查采用番茄青枯病分级标准[19]。0级,叶片无症状;1级,植株1/4以下的叶片表现萎蔫症状;2级,植株1/4~1/2叶片表现萎蔫症状;3级,植株1/2以上叶片表现萎蔫症状;4级,全株萎蔫死亡。病情指数=∑(各级病株数×相应级值)/(调查总株数×最大级值)×100。防治效果=(空白对照病情指数—处理病情指数)/空白对照病情指数×100%。数据采用SPSS进行方差分析,R语言作图。
2 结果与分析
2.1 产铁载体活性菌株菌落形态及所产铁载体体外活性
本研究中两株具有高铁载体活性的真菌编号分别为2-14F2与2-8F2,其菌落形态见图1(a及b)。两菌株在CAS双层显色培养基上培养后,均可产生明显的红色晕圈(图1c和1d),表示2个菌株均能产生螯合铁离子的铁载体。通过对两菌株产铁载体活力值定量分析,得出2-14F2与2-8F2菌株产铁载体活性单位(SU)分别为62.02%和52.06%。

图1 菌株2-14F2与2-8F2 在PDA和CAS平板上的培养形态Fig.1 The culture morphology of 2-14F2 and 2-8F2 strains on PDA and CAS plates
2.2 铁载体活性馏分分离
对2-14F2和2-8F2真菌固体发酵粗提物反复经正相硅胶、C18反相硅胶分离及凝胶层析系统纯化后(图2),真菌2-14F2铁载体活性物质(CAS 显色为红色,同时与 2% FeCl3反应显褐色或棕褐色的馏分)集中在3、5馏分(图2c),2-8F2铁载体活性物质集中在2、3馏分(图2d)。

图2 菌株 2-14F2和2-8F2分泌的铁载体活性馏分分离Fig.2 Separation of siderophore active fractions from 2-14F2 and 2-8F2 strains
2.3 活性部位铁载体类型判定
通过紫外分光光度计(EU-2200R)全波段扫描后发现,2-8F2与2-14F2菌株铁载体活性物质分别在423 nm和421 nm处吸光度值最高(图3),故判定两菌株所产铁载体类型为异羟肟酸盐型(hydroxamates)。

图3 2-8F2和2-14F2菌株产铁载体在全波段下吸光度值Fig.3 Full-band absorbance values of 2-8F2 and 2-14F2 siderophores
2.4 铁载体活性物质抑菌活性测定
纸片扩散可快速判断铁载体活性物质对青枯雷尔氏菌的抑制效果。与空白对照(CK)相比,2-14F2与2-8F2菌株铁载体活性物质表现出明显的抑菌效果(图4)。
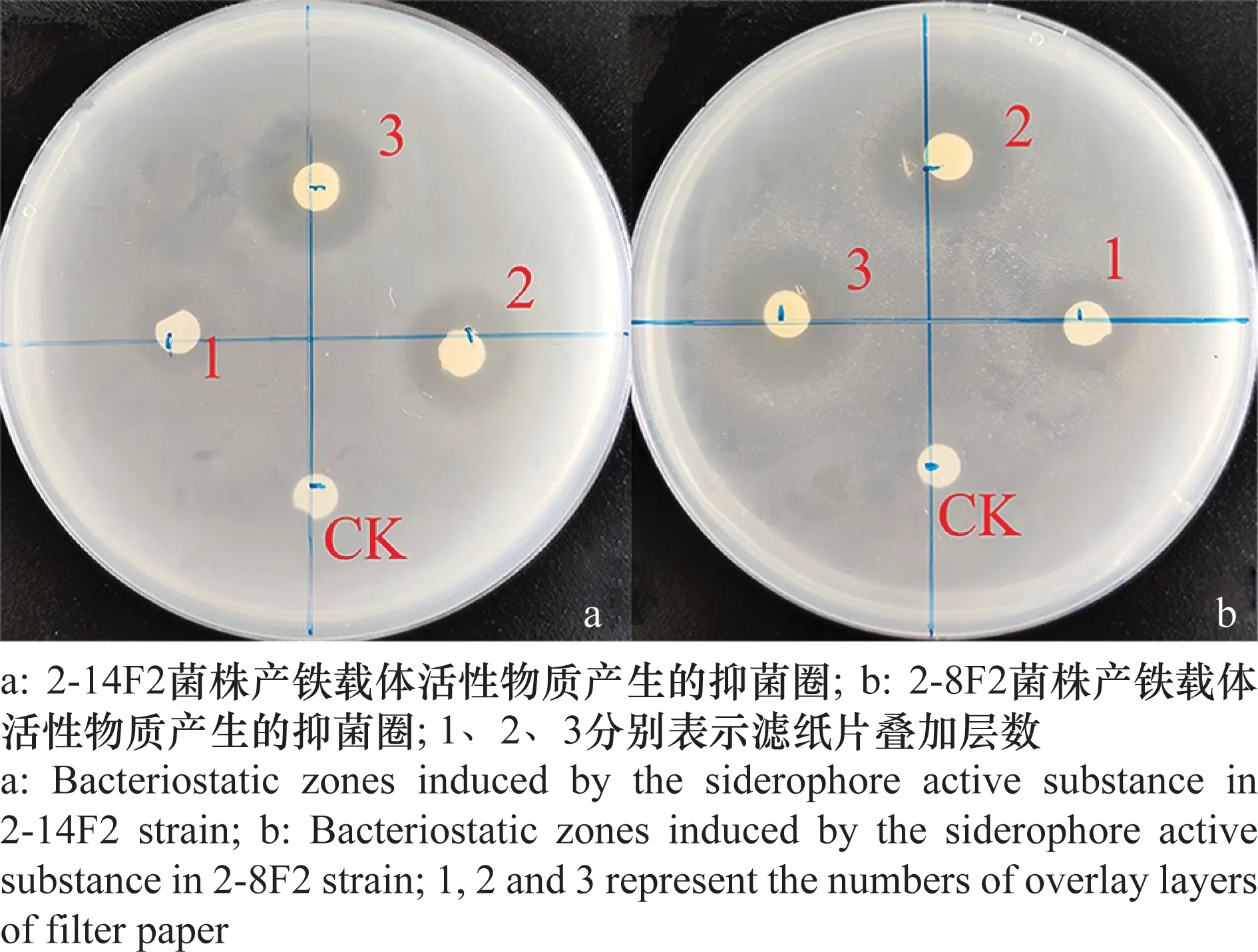
图4 2-8F2与2-14F2菌株产铁载体活性物质抑菌定性测定Fig.4 Qualitative determination of the antibacterial activity of siderophores in strains 2-8F2 and 2-14F2
2-8F2与2-14F2的抑菌率随着铁载体活性物质浓度下降而降低。此外,当2-8F2菌株与2-14F2菌株铁载体活性物质中添加FeCl3后,其抑菌率与未加FeCl3样品相比,抑菌率在高浓度范围内明显下降(图5)。表明抑菌效果与铁载体所处的环境铁离子浓度相关。

图5 2-8F2与2-14F2菌株铁载体活性物质对青枯雷尔氏菌的抑菌率Fig.5 Detection of the antibacterial rate of siderophore active substances from strains 2-8F2 and 2-14F2 against Ralstonia solanacearum
2.5 盆栽试验验证铁载体活性物质对番茄青枯病的防治效果
番茄植株接种青枯雷尔氏菌15 d后,未接种青枯菌的CKA对照组植株未出现萎蔫的症状,发病率为0。接种青枯菌的CKB对照组,植株均出现茎基部萎蔫的症状,病情指数可达97.31。与CKB处理组相比,2-14F2与2-8F2(A、B和C)处理组的发病率和病情指数明显降低。表1所示,当铁载体活性物质浓度为0.15 mg/mL时,防治效果为51.36%(2-14F2B)与50.27%(2-8F2B),此外当添加等体积的1 mol/mL FeCl3溶液后防治效果下降40.55百分点(2-8F2)和41.09百分点(2-14F2)。该结果再次表明:2-14F2和2-8F2菌株的铁载体活性物质对番茄青枯病具有较好的防治效果(图6),且抑菌效应与铁载体所处的环境铁离子浓度相关。
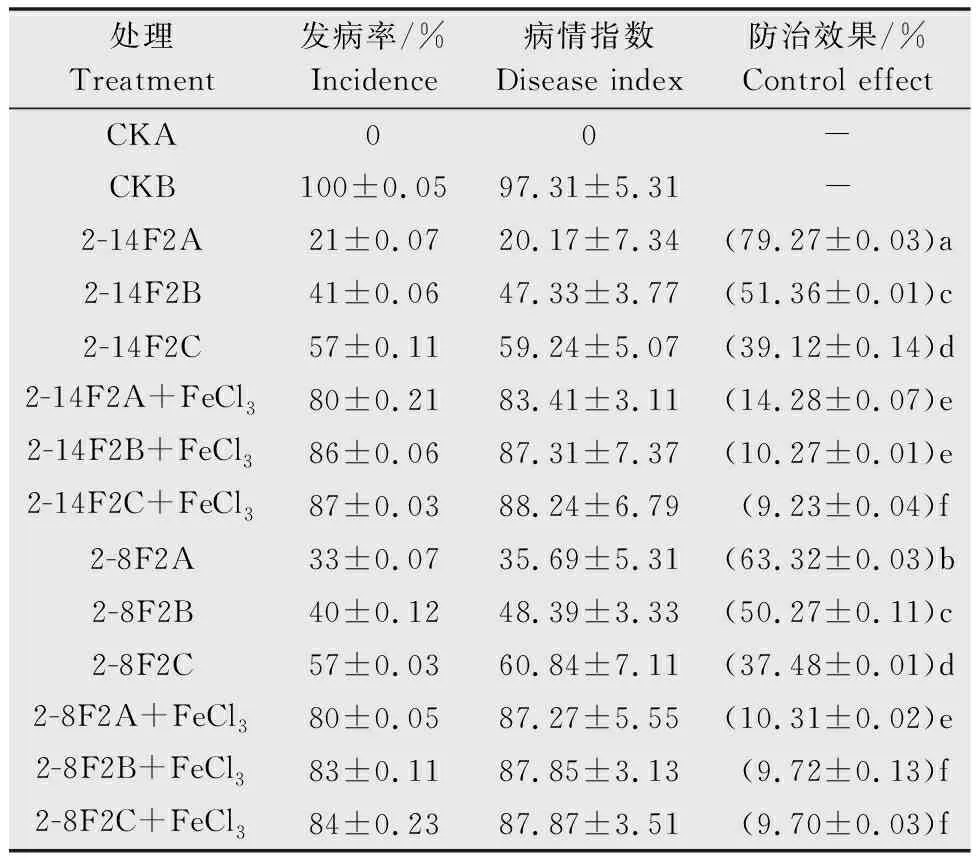
表1 2-8F2与2-14F2菌株铁载体活性物质对番茄青枯病的防治结果1)Table 1 Control results of 2-8F2 and 2-14F2 siderophore active substances against tomato bacterial wilt

图6 2-8F2与2-14F2铁载体活性物质对番茄青枯病的抑制效果Fig.6 Inhibitory effect of siderophore active substances from strains 2-8F2 and 2-14F2 against tomato bacterial wilt
3 结论与讨论
许多真菌均可产生铁载体,已报到的有曲霉属Aspergillus[21]、青霉属Penicillium[22]、链格孢属Alternaria[23]、木霉属Trichoderma[24]及白僵菌属Beauveria[25]等。本研究获得的2个高铁载体活性菌株2-8F2及2-14F2分别属于白僵菌属和木霉属微生物(拟球孢白僵菌及云南木霉)。通过文献检索,我们发现:布氏白僵菌Beauveriabrongniartii[26]、球孢白僵菌B.bassiana[27]与木霉Trichodermaharzianum[28]、棘孢木霉T.asperellum[29]、绿木霉T.virens[30]、T.peudokoningii[31]均具有铁载体活性报道,但活性均低于本研究菌株,因此,2-8F2与2-14F2均为同属微生物中的高铁载体活性菌株。根据文献报道,白僵菌属微生物对交链格孢Alternariaalternata[32]、青枯雷尔氏菌[33]、枯斑拟盘多毛孢Pestalotiopsisfunera[34]、乌黑皮壳菌ValsasordidaNits.[35]、红曲霉Aspergillusruber、松球壳孢菌Sphaeropsissapinea[36]等植物病原菌具有拮抗活性。木霉属微生物对大丽轮枝菌Verticilliumdahliae、大雄疫霉Phytophthoramegasperma[37]、立枯丝核菌Rhizoctoniasolani[38]、青枯雷尔氏菌[39]、褐根病菌Phellinusnoxius和尖孢镰刀菌Fusariumoxysporum[40]等植物病原菌具有拮抗活性。本文首次开展了相关属微生物产铁载体活性物质对青枯雷尔氏菌抑菌活性研究,有效验证了分泌型铁载体真菌对植物病原菌的防控,具有广谱性。
本研究离体及活体盆栽试验均发现,在铁充足条件下,2-8F2与2-14F2两株菌铁载体活性物质的活性均显著降低,表明环境铁离子是2-8F2与2-14F2菌株发挥抑菌作用的重要影响因子。出现这一现象的可能原因是:铁载体抑菌效应与其较强的Fe3+竞争螯合能力有关;当环境中铁离子丰富时,靶标菌株有充足的铁资源进行生长,从而钝化了铁载体物质的铁竞争性抑菌作用。
本研究从云南省哀牢山国家级自然保护区森林土壤中分离到2株产铁载体菌株,分别是云南木霉及拟球孢白僵菌。其铁载体化学结构类型均为异羟肟酸型。两菌株的铁载体活性物质对番茄青枯病防治效果高于50%,具有开发成新型植物病原生物拮抗剂的潜力。

