1个脆性X综合征家系的FMR1基因CGG重复及甲基化状态分析*
钟青燕,刘晓丽,罗世强,袁德健,王敬仁,王秋华b,黄钧b,严提珍(柳州市妇幼保健院 & 广西科技大学附属妇产医院、儿童医院 .医学遗传科,b.柳州市出生缺陷预防与控制重点实验室,c.柳州市生殖与遗传研究所,广西柳州 545001)
脆性 X 综合征(fragile X syndrome,FXS)作为最常见的X连锁的智力低下综合征,是发病率仅次于唐氏综合征的第二大智力低下疾病[1],同时也是孤独症谱系障碍常见的遗传因素。人群发病率男性约 1/4 000,女性约为 1/8 000[2-3]。约 99%的脆性X综合征患者发病的分子机制是由于FMR1 基因5′端非编码区的三核苷酸重复序列CGG过度扩增引起其上游约250 bp处CpG岛发生不同程度的异常甲基化,从而抑制FMR1 基因正常转录,造成FMR1不表达或低表达,进而引起一系列的临床症状。绝大部分男性全突变患者有典型脆性X 综合征的临床表现,也有30%~50%女性全突变携带者表现为轻重程度不等的智力低下,严重程度明显低于男性[4]。目前脆性X 综合征的相关研究更多的是关注患者的CGG 重复数或甲基化情况,对甲基化程度和表型关系研究的较少,本研究应用PCR微流控芯片毛细管电泳联合MS-MLPA技术对脆性X综合征家系进行CGG重复序列和甲基化状态分析,同时探讨甲基化程度和临床表型的关系。
1 对象与方法
1.1 研究对象 2017年8月于柳州市妇幼保健院医学遗传科遗传咨询的1 个脆性X 综合征家系,5代共22人(家系图谱见图1)。先证者(Ⅳ4)为男性,21岁,表现为特殊面容(长脸、大耳朵)、智力障碍、自闭症、社交障碍等临床表现,另外3 名男性患者(Ⅳ5、Ⅳ6 和Ⅳ9)和先证者有相似的临床症状,其余家系成员未发现有类似临床表现(表1)。本研究经柳州市妇幼保健院医学伦理审查委员会审批(批准文号:20160227042),所有研究对象或家属均知情同意。

图1 脆性X综合征家系图
1.2 样本采集与处理 采集先证者及家系成员外周血2~3 mL于EDTA-K2真空抗凝管中,颠倒混匀用于DNA提取及PCR扩增。
1.3 主要仪器及试剂 Chemagic360 全自动提取仪、LabChip FGX微流控毛细管电泳仪、FMR1 基因检测试剂盒(PCR 微流控芯片毛细管电泳法)、核酸提取试剂盒(苏州新波公司),3500Dx 遗传分析仪(美国ABI公司)。SALSA MLPA ME029 试剂盒(荷兰 MHC-Holland 公司),QIAampDSP 全血 DNA提取试剂盒(德国Qiagen公司)。
1.4 方法
1.4.1 DNA 样本准备 使用核酸提取试剂盒,在Chemagic360全自动提取仪上提取受试者外周血基因组DNA,提取的基因组DNA用于PCR反应。使用QIAampDSP 全血DNA 提取试剂盒提取基因组DNA用于Southern 印记杂交。所有实验步骤严格按照试剂盒说明书进行。
1.4.2 PCR 微流控芯片毛细管电泳技术 使用FMR1基因检测试剂盒(PCR微流控芯片毛细管电泳法)进行FMR1基因检测,对受试者基因组DNA进行 PCR 扩增,PCR 反应体系共 20 μL,包括 FX反应液 15 μL,FX 稀释液 3.8 μL,FX 聚合酶0.2 μL,DNA 模板 1 μL。反应条件:95 ℃ 预变性5 min,98 ℃变性 35 s,61 ℃ 退火 35 s,72 ℃ 延伸4 min,共 25 个循环,72 ℃终延伸 10 min。将 PCR产物进行核酸纯化,具体操作步骤参见试剂盒说明书。纯化后的PCR产物在LabChip FGX 微流控毛细管电泳仪上进行PCR产物片段大小分析。将所得的样本核酸片段大小等信息导入FMR1 基因检测报告软件,根据软件说明书对数据自动进行分析和拟合,计算出CGG 重复数。本研究同时采用已知重复数的参考样本(质控DNA,5 个不同CGG重复数的 DNA 片段,29/43/56/100/375 CGG 重复数)构建标准曲线,测定样本核酸片段大小通过标准曲线换算得到更高精度的CGG重复数。CGG重复数按照美国人类遗传学学会(American College of Medical Genetics,ACMG)指南[5]对基因型进行分型:正常型(CGG 重复次数<45);前突变型(CGG重复次数为55 ~200)以及全突变型(CGG 重复次数>200)。
1.4.3 MS-MLPA 检测 采用 SALSA MLPA ME029试剂盒检测样本FMR1 基因缺失和重复及FMR1基因上游CpG岛甲基化状态。具体步骤按照试剂盒说明书操作。参照文献[6],用3500Dx遗传分析仪进行产物分析,原始数据通过Coffalyzer.Net软件(荷兰MRC-Holland 公司)进行数据归一化分析。将FMR1基因7个甲基化特异性探针比值的平均值作为甲基化比值。男性甲基化比值为0,表明不存在甲基化,甲基化比值>0.64表明存在异常甲基化。
1.4.4 Southern 印记检测 所有全突变阳性样本均送到中南大学生命科学院遗传研究中心进行Southern 印记杂交验证[7]。
1.5 统计学分析 采用SPSS 24.0 统计学软件进行数据统计分析。组间比较采用t 检验,检验水准α =0.05,以 P<0.05 为差异有统计学意义。
2 结果
2.1 PCR微流控芯片毛细管电泳结果 22个家系成员中检出正常型9例(1男,8女),检出女性前突变携带者8例,其FMR1 基因CGG 重复数在100 ~128 之间,其中 1 例 (12.5%)卵巢早衰,5 例(62.5%)女性前突变携带者出现月经紊乱,明显高于正常型(25%);检出脆性X 综合征男性患者4例,全突变女性携带者1 例,均由前突变携带者母亲动态突变传递而来。22个家系成员的CGG重复数见表1、部分家系成员PCR微流控芯片毛细管电泳图谱见图2。

图2 PCR微流控芯片毛细管电泳检测FMR1基因电泳图
2.2 MS-MLPA检测结果 22例家系成员MS-MLPA分析,均未发现FMR1基因缺失和重复。男性正常型甲基化比值为0,女性正常型和前突变携带者甲基化比值范围分别为 0.25 ~0.48(中位数 0.33)和0.33~0.46(中位数 0.38),两组差异无统计学意义(t= 0.095,P>0.05);1 例女性全突变携带者(Ⅳ:16)甲基化比值为0.52,高于正常型和前突变携带者中位数(0.33,0.38);4 例男性全突变患者(Ⅳ:4、Ⅳ:5、Ⅳ:6、Ⅳ:9)CpG 岛为异常甲基化状态,甲基化比值均>0.64(表1)。部分图谱见图3。

图3 MS-MLPA检测FMR1基因缺失、重复和甲基化状态的图谱

表1 22个家系成员的CGG重复数,MS-MLPA结果及临床表现
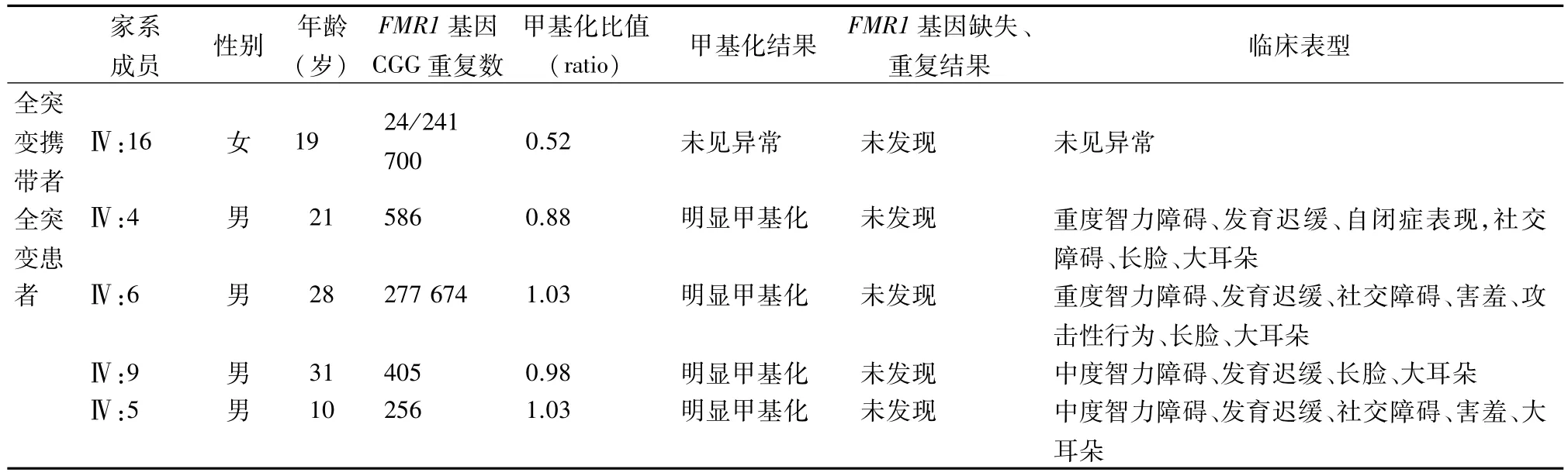
续表1
2.3 Southern印迹杂交结果 4例男性脆性X综合征患者均出现>5.8 Kb条带(男性全突变型),1例女性全突变携带者出现 2.8 Kb、5.2 Kb 和>5.8 Kb 条带(女性全突变型)。
3 讨论
FMR1基因CGG 重复数的动态突变递增仅遵循母源传递,父源传递时一般不发生大范围递增反而缩减,Mulley等[8]报道1例中度智力低下的脆性X综合征(FXS)男性患者生育的女儿表现为前突变型,Kambouris 等[9]发现 1 例前突变和全突变嵌合男性生育的女儿也表现为前突变型,其CGG 重复数跟父亲一样,Willems 等[10]发现 1 例表型正常的全突变甲基化嵌合男性其精子CGG重复数与女儿相同,段然慧等[11]通过对 2 例 FXS 男性胎儿(1例全突变、1 例全突变和前突变嵌合)睾丸组织进行CGG重复数及甲基化水平检测,进一步证实父源CGG重复数在子代传递呈现缩减渐进过程。本研究的家系中Ⅲ代的女性成员均为前突变携带者,CGG重复数在100~128 之间,其母亲(Ⅱ:2 和Ⅱ:4)为正常型,因父亲已故,根据咨询者反馈其父亲临床表现无特殊,推测前突变携带者的父亲可能表现为前突变,父亲CGG 重复传给其女儿时发生了较小的递增或保持一致。
前突变CpG岛一般不发生甲基化,FMR1 基因可以正常地转录,具有相对正常的蛋白质水平,不表现出脆性X综合征临床症状,但是可能会与老年性震颤、共济失调和卵巢早衰、卵巢功能不全等发生相关。脆性X相关震颤/共济失调综合征(fragile X-associated tremor/ataxia syndrome,FXTAS)可能是由于过多的RNA结合蛋白的毒性作用引起的一组以神经退行性病变为主的疾病[12-13]。约40%或以上前突变携带者在60岁之后罹患迟发型进行性神经系统疾病——FXTAS,此病好发于男性,年纪越大发病率越高[14]。本研究中的 1 例女性(Ⅱ:2,CGG重复数为29/38)在66 岁开始出现老年性震颤、共济失调,排除了脆性X综合征基因变异,其临床症状的出现可能是其他神经系统病变引发。前突变携带者中有20%罹患卵巢早衰的风险,卵巢早衰的发生可能是由于前突变mRNA 对卵巢组织的毒性积累导致卵泡闭锁或凋亡增加[15]。女性前突变携带者CGG 重复数在55 ~80 之间时,重复数越大,发生卵巢早衰的年龄越小,CGG 重复数大于80时发生卵巢早衰的风险明显增高;然而CGG 重复数大于或等于100 时几乎不再增加卵巢早衰的风险,反而还会下降[15]。本研究中8 例女性前突变携带者的CGG重复数均大于或等于100,只有1例(Ⅲ:9)出现卵巢早衰,在 40 岁绝经,发生率为12.5%,这可能与其CGG重复数不属于卵巢早衰的高发区间有关;另外有5例(62.5%)女性前突变携带者出现月经紊乱,高于正常型女性,可能跟前突变mRNA毒性作用有关系,其机制有待进一步研究。
本研究采用MS-MLPA 技术进行甲基化分析,女性正常型和前突变携带者甲基化比值范围为0.25~0.48 和 0.33 ~ 0.46,两组差异无统计学意义(t=0.095,P>0.05),1 例女性全突变携带者甲基化比值为 0.52,高于女性正常型和前突变型均值(0.33,0.38),其未出现脆性 X 综合征相关的临床症状。由于存在无活性、甲基化的X 染色体,在正常型和全突变型之间产生重叠的峰值比率,女性样本MS-MLPA分析时得不到可靠的结果,因此,女性阳性样本需采用Southern 印迹杂交法结合PCR 微流控芯片毛细管电泳进行综合分析。4 例男性全突变患者甲基化比值均>0.64,为高度异常甲基化状态,其中2例表现为中度智力障碍,2例为重度智力障碍,两组患者的甲基化比值差异无统计学意义(t=0.58,P>0.05),提示男性患者的临床表型和甲基化程度有关,但非正相关。Nobile 等[16]发现DNA甲基化不是调节FMR1表达的唯一因素,胞嘧啶甲基化、组蛋白修饰、染色质重组、RNA转录的作用也可影响FMR1基因转录调控。
通过CGG 重复数检测和甲基化分析,为脆性X综合征家系成员提供准确全面的分子诊断,男性患者临床表型和甲基化程度相关。前突变和全突变女性的FMR1基因CGG 重复数会发生动态突变递增传给子代,有生育脆性X 综合征患儿的风险。因此,在婚前、孕前进行遗传咨询和基因检测,若是女性携带者,可通过产前诊断或胚胎植入前遗传学检测技术避免患儿的出生。此外,女性携带者有卵巢早衰的风险,应提供风险评估,必要时提前完成生育计划。

