1 058例初诊急性白血病患者46种融合基因筛查分析
邹媛,唐远燕,杜翠,董越,郭福晓,程建兵(杭州艾迪康医学检验中心有限公司病理实验室,杭州 310030)
白血病(leukemia)是一组高度异质性的恶性肿瘤,在我国的发病率约为2.67/10万,急性和慢性的发病率比值约 5.5 ∶1[1]。在 2017 年修订的第四版《WHO 造血与淋巴组织肿瘤分类》中,急性白血病(acute leukemia,AL)分为三大类:急性髓系白血病(acute myeloid leukemia,AML),急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL)和急性系列未明白血病(acute leukemia of ambiguous lineage,ALAL)。同时根据免疫表型、细胞遗传学和分子遗传学的发现,定义了多个亚类[2]。其中,融合基因是常见且重要的重现性遗传学异常,它对AL 的诊断、预后及治疗都具有指导意义。本研究通过回顾分析1 058 例AL 初诊患者样本46 种常见融合基因的检测结果,以明确AL 患者中融合基因的分布情况,并探讨46种融合基因筛查的临床应用价值。
1 材料和方法
1.1 样本来源 收集 2017 年 4 月至 2021 年 6 月送检至杭州艾迪康医学检验中心实验室检测46 种融合基因筛查的样本中,明确诊断为AML、ALL 及ALAL的患者共1 058例,年龄1 个月~93 岁,中位年龄11岁。男性样本582 例,女性样本474 例,性别不详2例;骨髓946 例,外周血35 例,类型不明的全血样本77例。其中AML 499 例,中位年龄46岁;ALL 510例,中位年龄5岁;ALAL 49例,中位年龄10岁。经杭州艾迪康医学检验中心医学伦理委员会审批(伦理审查编号:ADICON 医伦审[2021]第005号)。其中临床诊断来自送检医院或本中心血液病综合诊断室。
1.2 仪器和试剂 ABl7500荧光PCR仪(美国Applied Biosystems公司)。SuPerfecTRITMTotal RNA isolation Reagent购自上海普飞生物技术公司,ReverTra Ace qPCR RT Kit 和Thunderbird qPCR Mix试剂购自东洋纺(上海)生物科技公司。引物购自通用生物系统(安徽)公司。
1.3 方法
1.3.1 全血RNA提取及逆转录反应 通过多重荧光PCR法筛查46种融合基因[3-5]:按表1所列进行分组检测。引物探针序列部分参考文献[6],另外一部分为本实验室通过Genamics Expression 软件设计;与筛查方法一并申请了专利[3-5]。每组总反应体系为50 μL,包括THUNDERBIRD Probe qPCR Mix 25 μL,cDNA 5 μL,10 μmol/L 引物探针混合物,RNase-free dH2O补足至50 μL。检测程序及结果分析参考专利[3-5]。MECOM 基因表达通过ΔΔCt=ΔCt待检EVI1-ΔCt正常EVI1计算判定[7];当 ΔΔCt>3SD正常EVI1时为高表达。当少见的融合基因首次检测到阳性时,比对相应的染色体核型分析结果;若不一致或无对应的染色体核型分析结果时,在样本量足够的前提下进行Sanger测序再次确认。

表1 融合基因筛查列表
1.3.2 数据统计
1.3.2.1 统计 1 058 例样本的 46 种融合基因筛查结果 分别计算AML、ALL及ALAL患者样本中各种融合基因的阳性率,比较相同融合基因在AML和ALL患者中的分布差异。将患者按年龄分成<18岁、18~59岁和≥60岁3组,比较不同年龄段患者的融合基因阳性率情况。
1.3.2.2 MECOM 表达的分组 将患者按 KMT2A重排阳性、NUP98 家族融合基因阳性、复杂核型(除包含KMT2A重排和NUP98 家族融合基因的病例)及其他(剩余的样本)进行分组,统计MECOM高表达在上述分组中的分布差异。
1.4 统计学分析 采用 IBM SPSS Statistics 25.0 统计学软件进行处理分析,分布差异采用卡方(χ2)检验,以P<0.05为差异具有统计学意义。
2 结果
2.1 各类疾病中融合基因的阳性率 499 例AML样本检测出251 例阳性,含20 种融合基因(1 例BCR-ABL1和 RUNX1-MECOM 双阳性);检出率为50.30%。510例ALL样本检测出241例阳性,含12种融合基因(1 例为首次发现的PCM1-FGFR1 阳性,测序结果见图 1A);检出率为 47.25%。49 例ALAL样本检测出8例阳性,含5种融合基因;检出率为16.33%。部分少见融合基因测序图谱见图1B~1D;融合基因在各类疾病中的分布情况见图2。
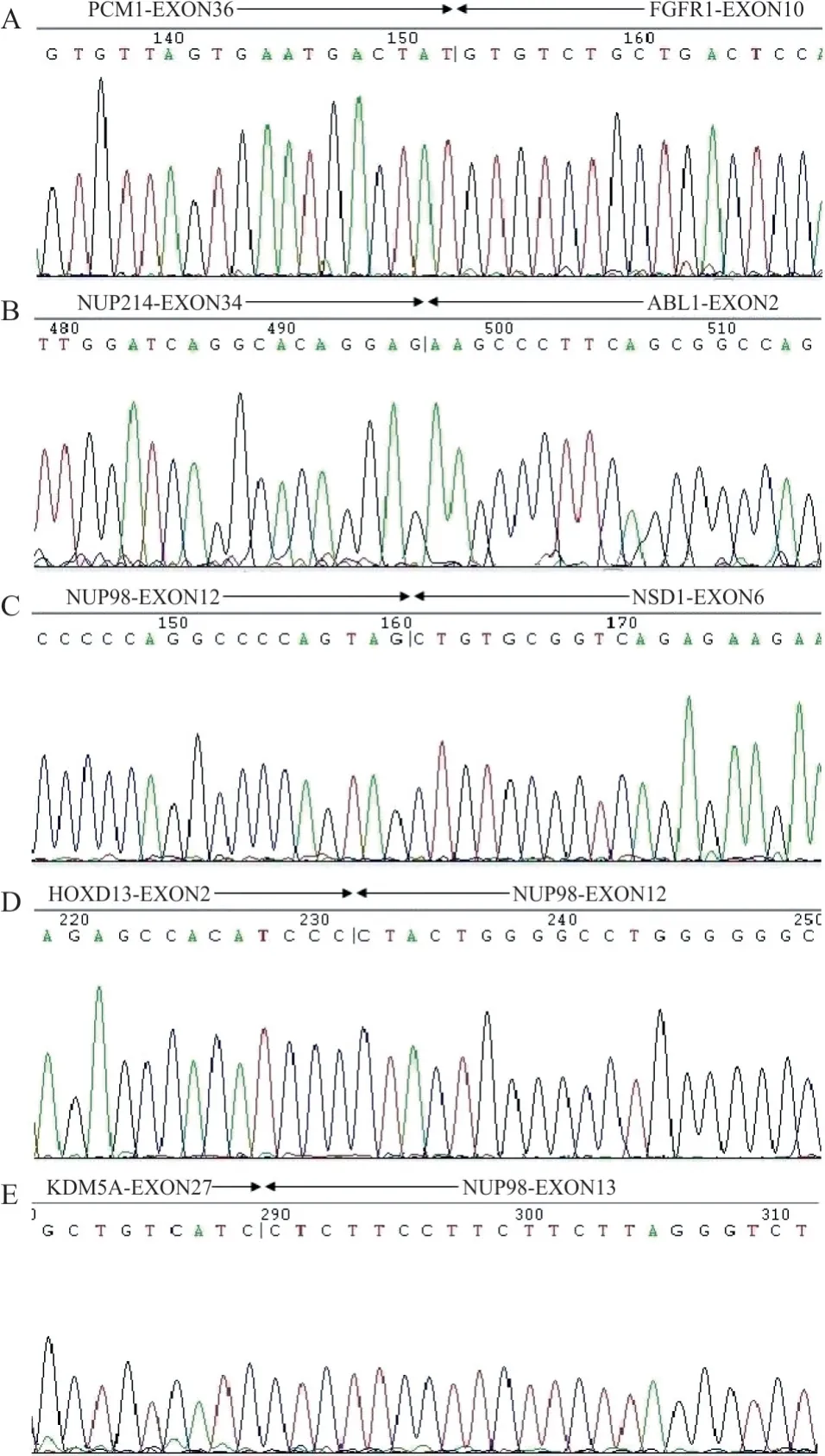
图1 测序验证图谱
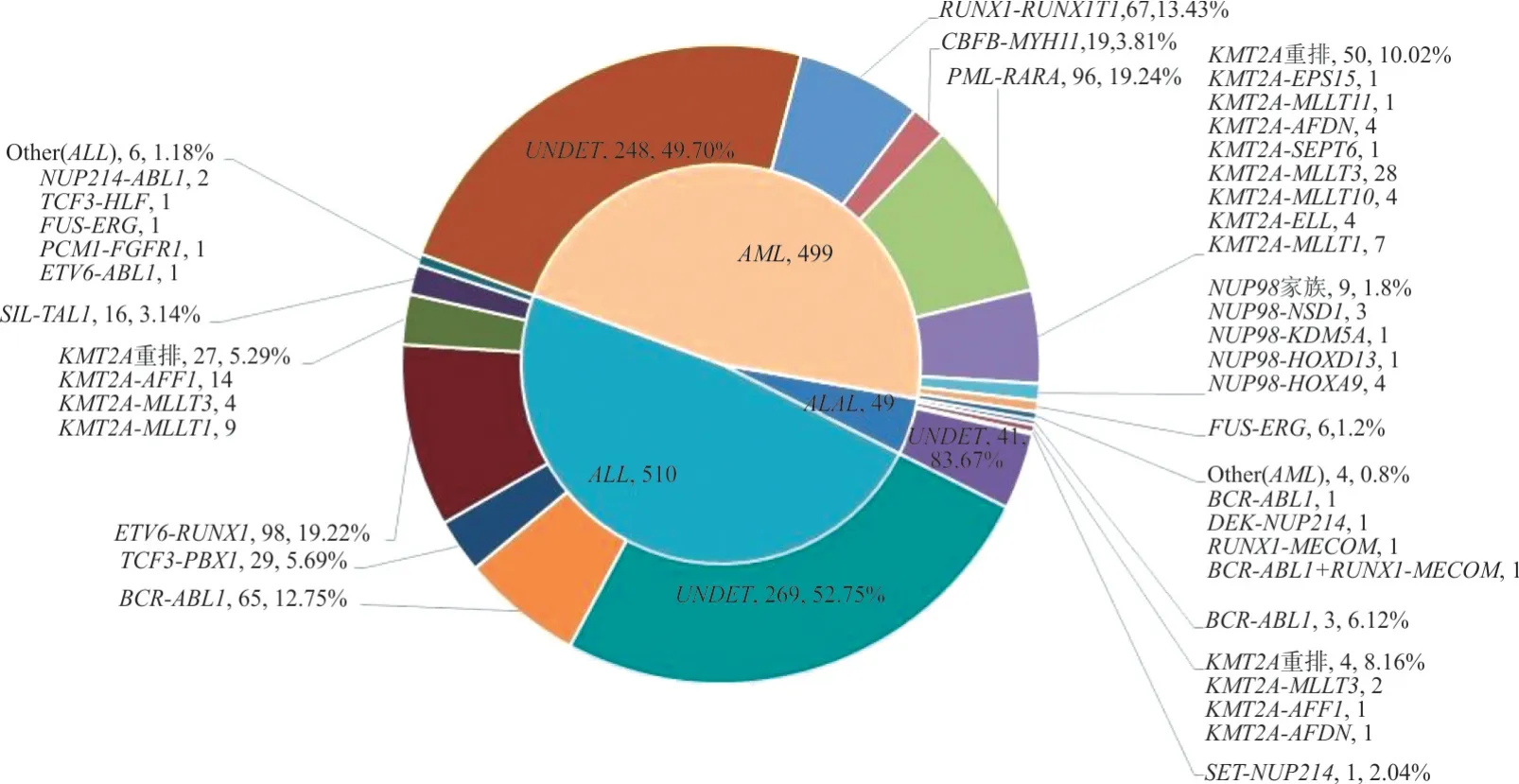
图2 AL患者中融合基因的分布情况
2.2 融合基因在AML 和ALL 患者中的分布差异NUP98家族融合基因只分布于 AML(P<0.01);而MECOM高表达和KMT2A重排相关融合基因在AML 中的阳性率显著高于 ALL(P <0.01);但KMT2A-AFF1 融合基因只出现于 ALL(P <0.01)。FUS-ERG融合基因虽多见于AML,但与ALL 相比差异无统计学意义(P >0.05)。其他融合基因在AML和ALL中的分布差异见图3。
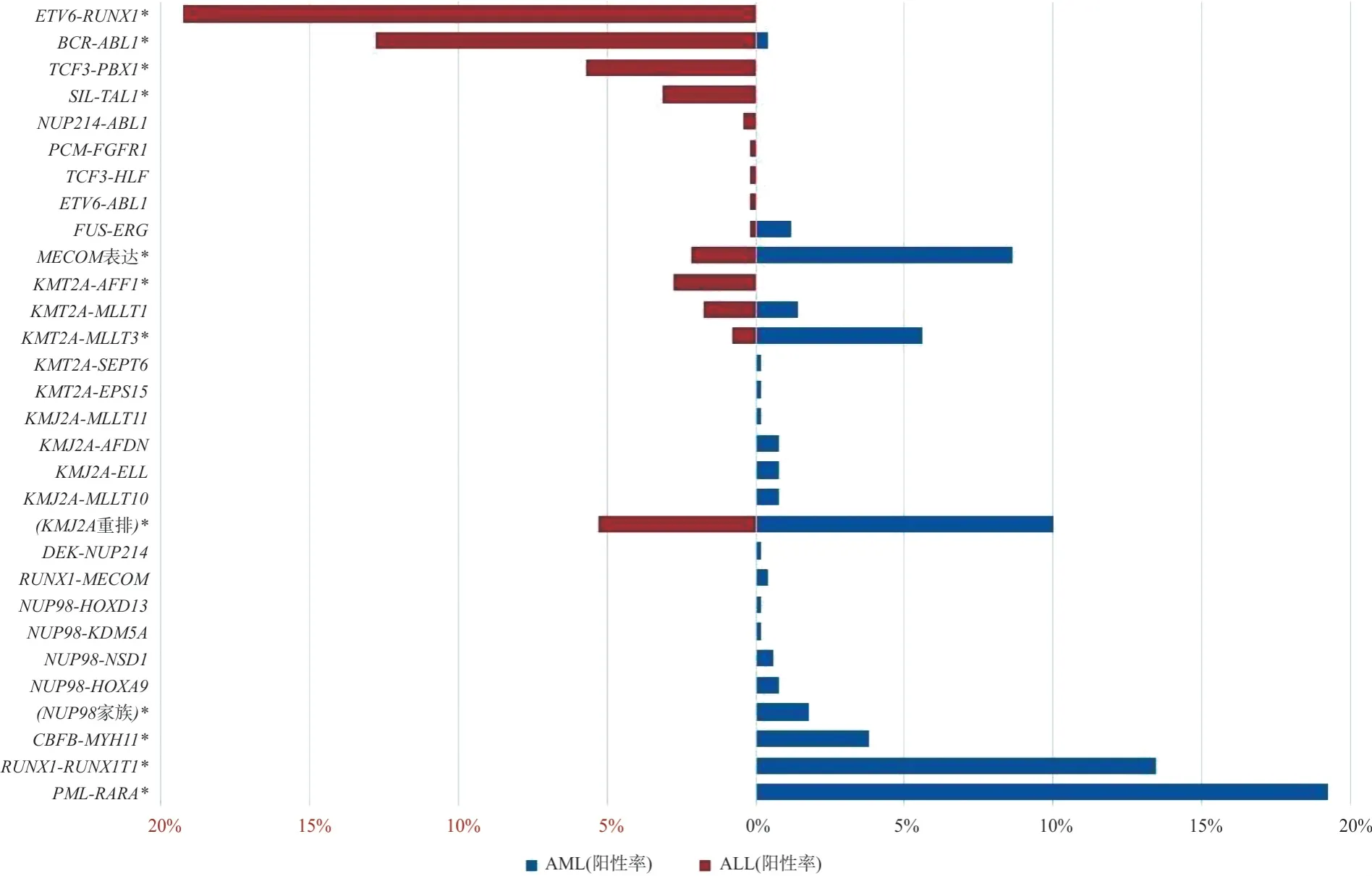
图3 融合基因在AML和ALL患者中的分布差异
2.3 不同年龄段患者的融合基因阳性率 在AML患者中,年龄<18 岁、18 ~59 岁和≥60 岁 3 组之间的融合基因阳性率差异具有统计学意义(P <0.01);在 ALAL 患者中,年龄<18 岁和 18 ~59 岁组之间的融合基因阳性率差异具有统计学意义(P<0.05)。在ALL患者中,上述3 个年龄段的融合基因阳性率差异无统计学意义(P>0.05)。
2.4 MECOM高表达样本的差异性分布 和其他组相比,MECOM 高表达在 KMT2A 重排(P<0.01)、NUP98 家族(P<0.01)和复杂核型(P<0.05)中的分布差异有统计学意义。KMT2A 重排、NUP98 家族和复杂核型组之间的差异无统计学意义(P >0.05)。MECOM的表达水平在不同融合基因或核型中的分布比例见表3。
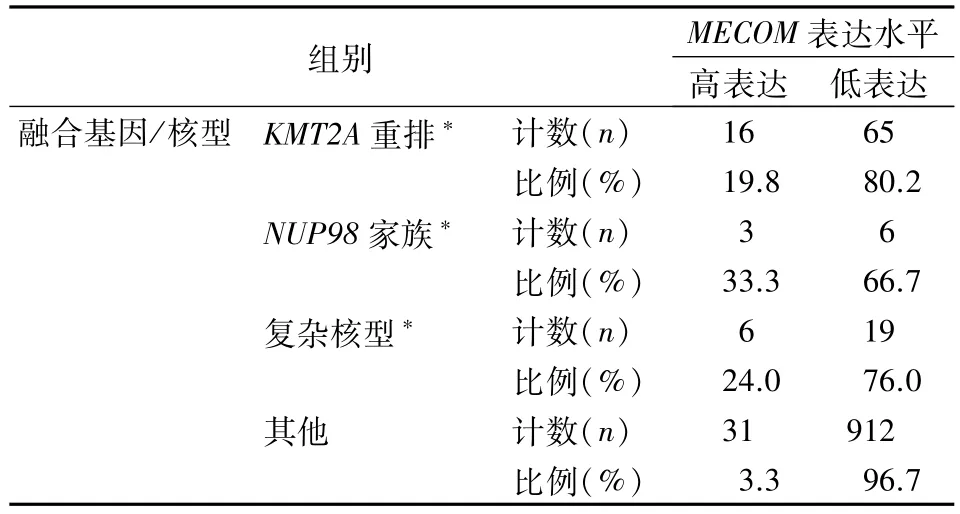
表3 MECOM的表达水平在不同融合基因/核型中的分布差异
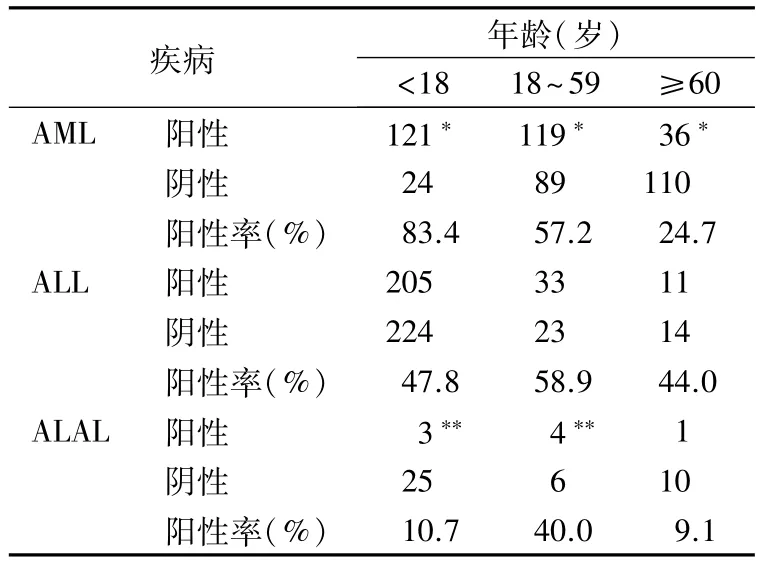
表2 各类疾病中不同年龄段的融合基因的比较
3 讨论
融合基因是AL 中常见的重现性遗传学异常,有文献报道,在年轻成人AML 中的检出率约为34%[8],在 BCP-ALL 中的检出率约为 50%[9];对初诊患者进行常见融合基因筛查利于及时诊断和评估预后,并确定微小残留病灶监测的分子靶标[6]。近几年国内陆续出现多重荧光PCR 法筛查融合基因的商品化试剂,但检测的融合基因种类一般为30种左右,数量相对不足[10]。本研究增加了NUP98家族融合基因、JAK2 及FGFR1 重排相关融合基因及NUP214-ABL1 等融合基因,以提高融合基因筛查的阳性率。
在AML患者中,不同年龄段的融合基因阳性率差异有统计学意义。<18 岁的年龄组,融合基因阳性率更是高达83.4%,这一数据与黄倩雯等[10]报道的≤14岁儿童AML融合基因阳性率(75.5%)接近;随着年龄的增加,融合基因的阳性率逐渐降低。在ALAL组中,18~59岁患者的融合基因阳性率显著高于<18 岁,与 AML 呈现相反的趋势。而在ALL 组中各个年龄段的融合基因阳性率无显著性差异。这一结果是否意味着不同年龄群驱动AML和ALAL发生的主要因素是在变化的,值得探讨。
在AML和ALL中,有10种融合基因的分布是有显著性差异的。除了PML-RARA、RUNX1-RUNX1T1等常见融合基因只出现于AML 外,本研究检测出9例NUP98家族融合基因阳性,4 例儿童,5 例成年,均为AML患者。研究表明[11-13],伴有NUP98 融合基因的患者预后不良。McNeer 等[12]的研究显示,约50%的化疗耐药的儿童AML 患者伴有NUP98融合基因。这类患者还常同时伴有FLT3-ITD 和/或 WT1 的突变[11,13]。Ostronoff 等[13]的报道显示,同时伴有NUP98融合与FLT3-ITD 突变的AML 患者组的复发率和死亡率是无上述遗传异常患者组的2倍。并且NUP98融合多为隐匿性的遗传学异常,常规染色体检查易造成漏检[11]。因此,将NUP98融合纳入常规AML相关融合基因的检测是有必要的。
MECOM高表达主要见于 AML,是 AML 患者生存的一个独立的不良预后指标,与3q26 重排的存在无关[7]。MECOM 高表达与预后不良的核型(如-7/7q-)或复杂核型相关,也与 KMT2A 重排具有显著相关性[7,14],与本研究观察到的结果相一致。本研究还发现伴NUP98 融合的患者MECOM高表达率也显著增高,这在少量病例报道中也有提及[15],充分证实了MECOM高表达与疾病不良后果存在相关性。在初诊AML患者中进行MECOM 基因高表达的筛查,可能有助于更好的风险分层和治疗调整。此外,本研究中MECOM 高表达也见于2.16%的ALL患者,虽然其在ALL预后评估中的意义并没有在AML中如此明确,但在ALL的发生、进展和转化中发挥重要作用[16]。
KMT2A重排是AL中常见的融合基因,因其伴侣基因众多,需要大范围地进行筛查。本研究仅对常见的 12 种进行检测,其中 KMT2A-MLLT3、KMT2A-MLLT1 和 KMT2A-AFF1 是最为常见的类型。KMT2A 重排在 AML 中的阳性率显著高于ALL,且类型也较多。但是KMT2A-AFF1 融合基因只出现于ALL和ALAL,对疾病的辅助诊断具有重要的指导意义。此外,笔者在ALL 中检测出1 例PCM1-FGFR1 阳性样本。Kasbekar 等[17]也报道在伴有嗜酸性粒细胞增多的髓系肿瘤中发现了该融合基因,并通过口服选择性小分子FGFR1-4抑制剂(Futibatinib)获得持久的血液学和细胞遗传学完全缓解。此外,本研究还检测出2 例NUP214-ABL1阳性和1 例ETV6-ABL1 阳性样本,这类伴ABL1 重排阳性的ph样ALL患者可从达沙替尼(Dasatinib)等酪氨酸激酶抑制剂治疗中获益[18],上述融合基因的检测可为临床提供更合适的治疗方案。
综上所述,46种融合基因筛查有助于急性白血病的诊断分型,预后评估及治疗指导。目前尚有许多种融合基因并未纳入《WHO 造血与淋巴组织肿瘤分类》中作为具有重现性遗传学异常的分类标志,希望随着临床病例数的增加及其临床特征的总结归纳,越来越多的融合基因检测结果可以为临床血液疾病的诊治提供帮助。

