孕妇外周血游离DNA 检测用于胎儿16-三体筛查的临床价值*
林颖,李航,周冉,梁栋,王艳,胡平,许争峰(南京医科大学附属妇产医院&南京市妇幼保健院产前诊断中心,南京 210004)
孕妇血浆游离DNA(cell-free DNA,cf-DNA)检测技术用于评估胎儿罹患21-三体综合征(21-三体)、18-三体和13-三体的风险,并获得良好的临床应用效果[1]。目前有学者提出该技术可扩展至其他染色体的筛查,包括罕见三体(除21-三体、18-三体和 13-三体以外的常染色体三体)等[2]。16-三体是cf-DNA 检出的高频罕见三体之一,但目前基于cf-DNA检测的16-三体高风险的报道较少,临床意义也不明确。因此,本研究回顾性分析了南京市妇幼保健院2017 年至2021 年cf-DNA 检出结果为16-三体高风险的孕妇,对其产前诊断验证结果和妊娠结局情况进行回访,从而评估cf-DNA检测用于胎儿16-三体筛查的临床应用价值,以期为该类孕妇的妊娠咨询和管理提供有价值的信息。
1 材料和方法
1.1 研究对象 收集2017年1月至2021年12月于南京市妇幼保健院产前诊断中心进行孕妇血浆cf-DNA检测的孕妇。将其中cf-DNA 检测结果为16-三体高风险且有完整回访结果的孕妇作为研究对象,排除回访信息不全或失访的孕妇。本研究经南京市妇幼保健院医学伦理委员会批准(伦理批号:NFLZ2019-KY-004)。所有孕妇均进行详细的检测前咨询,并签署知情同意书。
1.2 试剂与仪器 核酸提取试剂盒、胎儿染色体非整倍体检测试剂盒、胎儿染色体非整倍体测序反应试剂盒(武汉华大生物科技公司)。BGIseq-500基因测序仪、SP-300自动化工作站(深圳华大智造科技公司),Qubit 2.0 荧光计(美国赛默飞世尔公司),ABI 9700 PCR 仪(美国 ABI 公司),CytoScan 750K array检测平台(美国Afymetrix公司)。
1.3 方法
1.3.1 血浆DNA提取及文库制备 采集孕妇空腹静脉血5 mL 于EDTA-K2抗凝的采血管中,8 h 内分离血浆,将分离好的血浆储存于-80 ℃冰箱备用。采用SP-300 自动化工作站进行血浆DNA 提取及文库制备,按照核酸提取试剂盒说明书操作,主要步骤包括:末端修复,接头连接,接头连接后纯化,PCR 反应,PCR反应产物纯化,Qubit 荧光定量检测(文库浓度>3 ng/μL为合格)。
1.3.2 高通量测序 将以上合格文库进行pooling,混匀后进行环化,环化后的文库采用BGIseq-500基因测序仪测序。按照BGIseq-500 基因测序仪及试剂盒说明书进行操作,主要步骤包括:核酸纳米球(DNB)制备,Qubit 荧光定量检测(DNB 浓度≥3 ng/μL为合格),DNB 自动样本加载系统操作,全自动样品加载系统上机操作,测序仪清洗,新建测序。测序数据通过序列比对获得每条染色体有效DNA序列条数,与参考值(hg19,NCBI build 37)进行比较,计算出胎儿患染色体异常的风险。采用BGI HALOS NIFTY项目信息分析系统进行自动化分析,当Z值介于-6~6时判定为16-三体低风险,当Z值>6时则判定为16-三体高风险。主要质量控制要求,包括有效数据量≥3.5 Mb、GC 含量范围为38%~42%、胎儿浓度≥3.5%。
1.3.3 羊水染色体核型分析和染色体微阵列分析(chromosomal microarray analysis,CMA) 取cf-DNA检测结果为高风险的孕妇进行羊水染色体核型分析和CMA检测,染色体核型分析采用传统的G 显带法,CMA使用CytoScan 750K array检测平台及其配套的染色体分析软件进行分析。
1.4 妊娠结局回访及数据收集 回访内容主要依据《孕妇外周血胎儿游离DNA 产前筛查与诊断技术规范》[3],内容包括:胎儿细胞遗传学结果、流产、引产、早产或足月产、死产、死胎等情况,在分娩后3个月将通过电话对其妊娠结局进行回访。孕妇的基本信息、cf-DNA检测结果和检测相关参数从BGI HALOS NIFTY 项目信息分析系统中收集。新生儿出生体重百分位数根据《胎儿生长受限专家共识(2019 版)》[4]计算,早产定义为分娩时妊娠孕周<37周。所有数据均采用Excel 2012软件计算例数和比例。
2 结果
2.1 16-三体高风险的检出情况 共56 247 例孕妇进行了外周血cf-DNA 检测,检出16-三体高风险22例,检出率为 0.04%。22 例16-三体高风险中,孕妇年龄(31.2±4.1)岁,孕周(17.8±2.4)周,其中12 例(54.54%,12/22)为高龄或血清学筛查高风险,cf-DNA 检出的平均胎儿浓度为(10.0±4.0)%,16 号染色体的平均 Z 值为 14.2±6.2。见表 1。
2.2 16-三体高风险的验证情况 22 例 16-三体高风险孕妇中,8 例(36.4%,8/22)孕妇进行了羊水单核苷酸多态性微阵列分析(single nucleotide polymorphism array,SNP-array)。SNP-array 结果显示,2 例为 UPD(16),其中 1 例为 arr[hg19]16p 13.3p13.2(94,807-8,418,576)×2hmz,1 例为 arr[hg19]16q22.1q24.3(69,860,932-90,146,366)×2hmz(图1);其余6例SNP-array未检出异常。8例中未发现胎儿16-三体真阳性,阳性预期值为0。
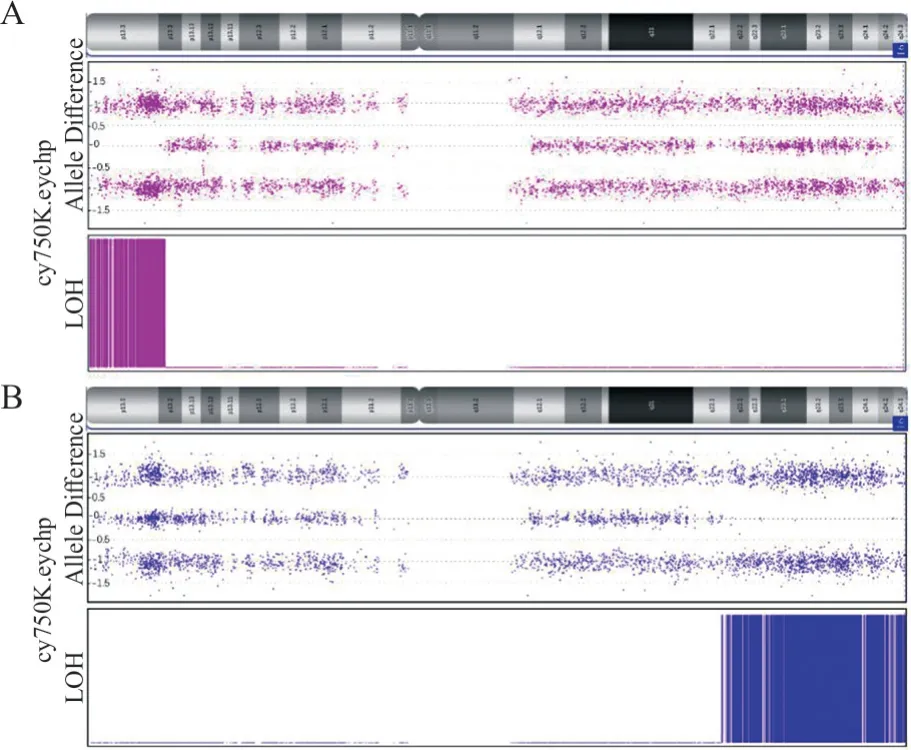
图1 羊水单核苷酸多态性微阵列验证结果
2.3 16-三体高风险的妊娠结局 22 例 16-三体高风险孕妇的妊娠结局全部随访成功,其中4 例(18.2%,4/22)发生流产或胎儿发育异常。其余 18例继续妊娠的孕妇中,6 例(27.3%,6/22)在孕期患有妊娠期高血压或重度子痫,11 例(50.0%,11/22)发生早产,13 例(59.1%,13/22)小于胎龄儿出生,3 例(13.6%,3/22)新生儿健康出生(足月分娩、新生儿无畸形以及新生儿体重正常)。见表1。
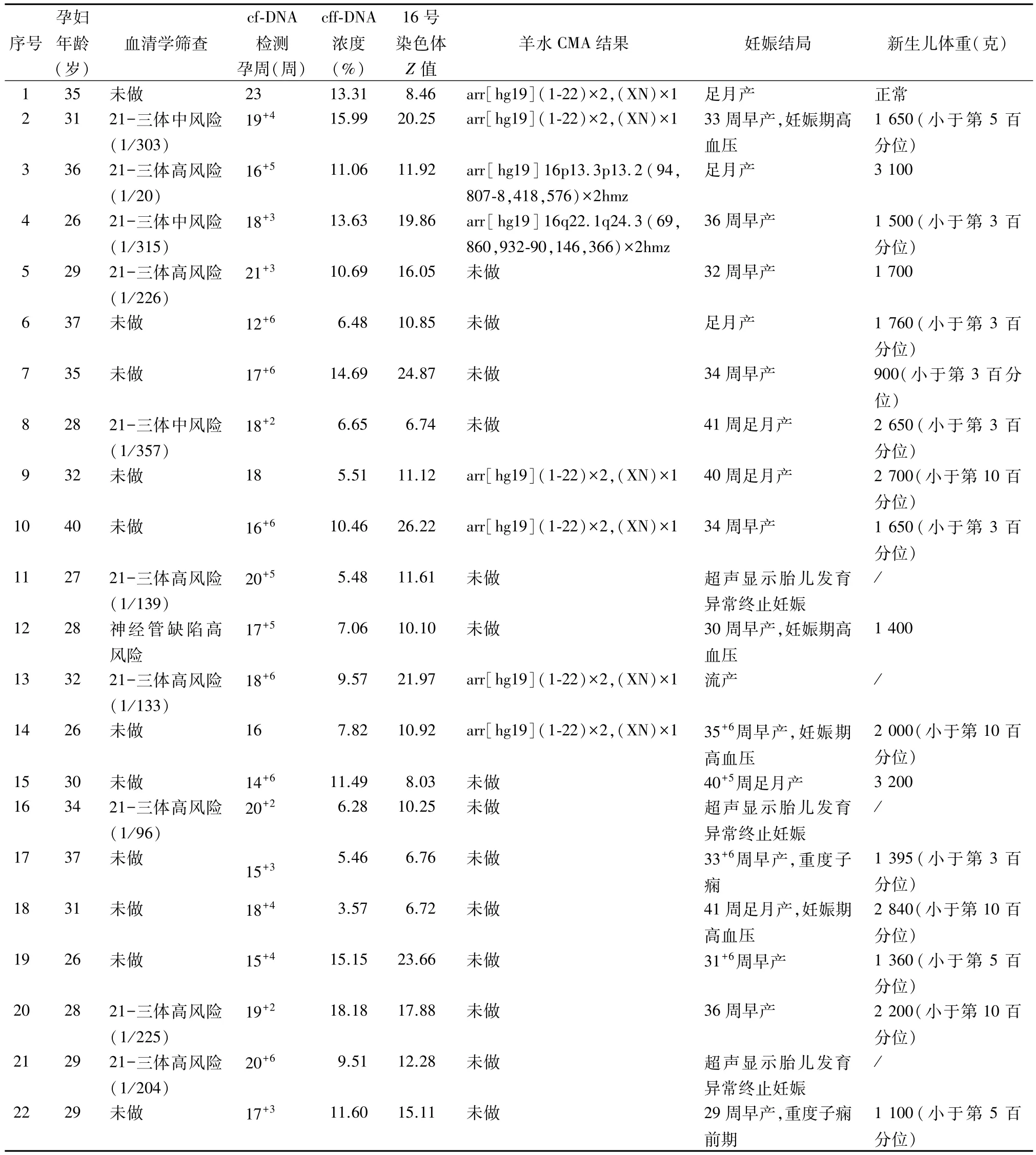
表1 22例cf-DNA检测结果为16-三体高风险孕妇的临床信息及妊娠结局
3 讨论
本研究回顾性分析了2017 年1 月至2021 年12月基于cf-DNA检出16-三体高风险的情况,证实16-三体高风险的检出率为0.04%,与Benn等[5]报道类似(66/155 213)。尽管侵入性产前诊断验证未发现胎儿16-三体真阳性,但笔者的回访结果证实,约86.4%的16-三体高风险孕妇会发生胎儿发育异常以及流产、早产等妊娠并发症,提示cf-DNA检出的16-三体高风险与不良妊娠结局有一定的关联。
孕妇外周血中cf-DNA主要包括母源性和胎源性的cf-DNA,胎源性的cf-DNA 主要来源于胎盘滋养层细胞,因此,孕妇血浆cf-DNA检测实际评估的是胎盘染色体非整倍体的风险。限制性胎盘嵌合(confined placental mosaicsm,CPM)是孕妇血浆cf-DNA检测假阳性的主要原因之一[6-7]。Hartwig等[6]系统地阐述了1997 至2016 年间报道的有关cf-DNA检测假阳性的文章,共60 例存在生物遗传学原因分析的假阳性样本中,19 例(32%)假阳性是 CPM 导致的。Malvestiti等[7]对 1 001 例产前诊断绒毛样本进行回顾性分析,发现约87%的样本是CPM,而罕见三体的 CPM 发生率则更高,可达97%。因此,尽管本研究中侵入性产前诊断未发现胎儿 16 -三体真阳性,但这并不能排除存在CPM16。
16-三体高风险孕妇有较高的不良妊娠结局风险。Benn 等[5]统计了近年来基于 cf-DNA 筛查报道的共31例16-三体高风险的妊娠结局,结果显示64.5%的孕妇存在流产、宫内生长发育迟缓或真胎儿嵌合体。本研究回访结果同样提示cf-DNA检出的16-三体高风险与不良妊娠结局有一定的关联,22例高风险中18.2%(4/22)发生流产或胎儿发育异常,27.3%(6/22)在孕期患有妊娠期高血压或重度子痫,50.0%(11/22)发生早产,59.1%(13/22)小于胎龄儿出生。因此,对于cf-DNA 筛查检出的16-三体高风险孕妇建议进行相关的遗传咨询和妊娠管理,尤其要密切监测胎儿的生长发育情况和可能的妊娠并发症。
16号染色体是容易发生非整倍体的染色体之一,这也导致了16号染色体UPD 的高发。研究表明,在绒毛染色体结果为16-三体或16-三体嵌合体时,其中约15%的胎儿羊水染色体为 UPD(16)[7]。本研究纳入的 8 例侵入性产前诊断验证中有2例确诊为UPD(16),其中1例为早产且出生体重小于第3百分位数,另1例为足月出生的健康新生儿。因此,对于cf-DNA 检测提示16-三体高风险孕妇产前诊断时建议采用SNP-array 进行检测以排除UPD,而UPD(16)导致印记基因的异常表达是否与胎儿生长发育迟缓有关尚存在争议[8]。
综上所述,cfDNA检测的16-三体高风险中胎儿真正阳性的可能性很小,CPM是假阳性高的主要原因,因此对于该类孕妇进行产前诊断需慎重。由于16-三体高风险的孕妇比其他三体高风险有更高的不良妊娠结局,因此,有研究者提出16-三体是最值得cfDNA检测的罕见三体[9],但由于检测精度、假阳性率尚不明确,目前国外一些指南并不支持cfDNA检测扩展至胎儿罕见三体的筛查[10]。故而在cfDNA检测前需做好检测前的咨询,对于需要扩展性筛查结果的孕妇要详细告知检测的局限性以及可能的风险。

