成纤维细胞生长因子受体2在肾透明细胞癌中的表达及意义
蔡天玉,朱振鹏,徐纯如,吉 星,吕同德,郭振可,林 健
(北京大学第一医院泌尿外科,北京大学泌尿外科研究所,国家泌尿男生殖系肿瘤研究中心, 北京 100034)
肾细胞癌(renal cell carcinoma,RCC)是一类起源于肾小管上皮细胞的恶性肿瘤[1],在泌尿系统中常见,约占男性所有癌症发病病例的5%,占女性新诊断癌症病例的3%[2]。肾透明细胞癌(clear cell renal cell carcinoma,ccRCC; or kidney renal clear cell carcinoma, KIRC)作为RCC最常见的组织学亚型,大约占所有RCC的70%~80%[3-4]。大部分ccRCC病例对放疗或者化疗不敏感[5],部分或根治性肾切除术是ccRCC的主要治疗方法,但术后仍有20%以上患者可出现复发,并且这部分患者预后较差[6-7]。然而,ccRCC致癌的具体分子机制尚不清楚,探索其相关生物标志物可能有助于改善ccRCC患者的预后。
成纤维细胞生长因子受体(fibroblast growth factor receptor,FGFR)家族包含四种高度保守的跨膜酪氨酸激酶受体(FGFR1、FGFR2、FGFR3和FGFR4),它们通过与成纤维细胞生长因子(fibroblast growth factor,FGF)配体结合来发挥作用[8]。既往研究显示成纤维细胞生长因子受体2 (fibroblast growth factor receptor 2,FGFR2;Ensembl ID:ENSG000000-66468.20)与多种肿瘤相关,例如,在结直肠癌中,FGFR2可通过JAK / STAT3途径上调细胞程序死亡-配体1(programmed cell death ligand 1,PD-L1)表达,调节肿瘤免疫逃避,且FGFR2表达水平与预后密切相关[9]。此外,研究者发现FGFR2改变在低黏附性胃癌(poorly cohesive gastric carcinoma,PCGC)中比其他类型中更常见,TACC2-FGFR2融合可以增加FGFR2的mRNA和蛋白质水平表达,并且具有TACC2-FGFR2融合的胃癌细胞系对FGFR2抑制剂更敏感,FGFR2可能是PCGC的潜在治疗靶点[10],但FGFR2对ccRCC的具体作用仍尚未阐明。
为了研究ccRCC患者中FGFR2的表达与其预后价值,探索其潜在的生物学功能,本研究先在肿瘤基因图谱(The Cancer Genome Atlas,TCGA)数据库及基因表达综合(Gene Expression Omnibus,GEO)数据库中比较了FGFR2在ccRCC组织以及正常组织中的表达情况,并且对FGFR2的表达情况与患者临床病理特征及预后的关系进行分析,进一步在临床样本ccRCC组织及癌旁正常组织、ccRCC细胞系及正常肾上皮细胞系中比较FGFR2表达水平,并研究FGFR2的表达与免疫浸润的关系以及构建其蛋白互相作用网络,探讨其在ccRCC发生发展中的作用。
1 资料与方法
1.1 数据库中基因表达资料及临床信息的获取
TCGA (https://genome-cancer.ucsc.edu/)是一个具有里程碑意义的癌症基因组学项目,TCGA产生的基因组学、表观基因组学、转录组学和蛋白质组学数据可公开供研究人员使用。通过TCGA数据库可以获得具有RNA-Seq表达和与之匹配的ccRCC患者临床病理信息的数据,该数据库是公开开放的,因此无需获得伦理委员会的批准。
GEO数据库(https://www.ncbi.nlm.nih.gov/geo/)是美国国家生物技术信息中心(National Center for Biotechnology Information,NCBI)的功能基因组学数据库,可查询和下载基因表达谱信息。本研究从该数据库中下载了数据集GSE15641、GSE53757、GSE71963的基因表达信息以及临床预后资料。
1.2 患者和样本
收集104例在北京大学第一医院泌尿外科住院的ccRCC患者的肿瘤标本,这些患者接受了根治性或部分肾切除术治疗。回顾性审查了北京大学第一医院数据库中临床病理数据的医疗记录,包括年龄、性别、T期、N期、M期和Fuhrman等级等。所有癌症组织样本均已被病理诊断为ccRCC。
1.3 免疫组织化学染色(immunohistochemistry, IHC)
从石蜡包埋组织样品中制备组织切片。使用二步法检测试剂盒(Zsbio公司,中国)进行免疫组织化学染色。先烤片1 h,然后将切片在二甲苯中脱蜡,在梯度乙醇中再水化,用柠檬酸盐缓冲液(pH 6.0)高压修复。滴加3%(体积分数)过氧化氢反应30 min从而消耗内源性过氧化物酶,将切片在PBS缓冲液中洗涤,用10%(体积分数)山羊血清封闭(Zsbio公司,中国)进行封闭。将切片与兔抗FGFR2抗体(Proteintech,1 ∶2 000)一起孵育,4 ℃过夜。第二天将切片在磷酸盐缓冲液(phosphate buffer solution,PBS)中洗涤三次,并与反应增强剂试剂盒在室温下孵育20 min。随后在PBS缓冲液中洗涤,并与辣根过氧化物酶偶联的二抗一起室温孵育。用二氨基联苯胺溶液和20%(体积分数)苏木精复染,并脱水,最后用中性树脂封片。
由两名经验丰富的研究者对所有肿瘤样本切片进行观察,每张切片选取五个视野进行评估。细胞染色强度评分标准为:0(无染色),1(弱), 2(中), 3(强);阳性细胞率评分标准为:0 (0%~5%),1 (6%~25%), 2 (26%~50%), 3 (51%~75%), 4 (76%~100%);两个变量乘积作为最终分数。
1.4 细胞培养
细胞系293、786-O、769-P、Caki-1、ACHN、A498和OSCR-2购买自美国保藏中心(American Type Culture Collection,ATCC),在含10%(体积分数)胎牛血清的1640培养基 (Sigma公司,美国)或达尔伯克氏改良伊戈尔氏培养基(Dulbecco’s modified Eagle’s medium, DMEM, Corning公司, 美国)中进行培养。每2~3天换液一次,细胞密度达到90%时进行传代。
1.5 实时荧光定量聚合酶链反应 (quantify real-time polymerase chain reaction,qRT-PCR)
使用Trizol试剂(Invitrogen公司,USA)从每组细胞中提取总RNA,然后使用cDNA第一链合成SuperMix试剂盒(TransGen公司,中国)进行cDNA反转录。使用Top Green 荧光定量PCR 试剂盒(TransGen公司,中国)在AriaMx Real-Time PCR系统(Agilent Technologies公司,美国)上进行qRT-PCR,β-tubulin作为内参照。使用的引物对如下:FGFR2正向引物: 5′- CCAACTGCACCAACGA-ACTG-3′,FGFR2反向引物:5′-CCAGTTTCTCAATGAAGCCATAA-3′;β-tubulin正向引物:5′-GATTCCTTCAACACCTTCTTCAG-3′,β-tubulin反向引物:5′-GTGCGAACTTCATCAATGAC-3′,每次反应重复3次,采用2-ΔΔCT法计算相对基因表达值。
1.6 蛋白质相互作用(protein-protein interaction,PPI)网络的构建
生物相互作用数据集通用存储库(Biological General Repository for Interaction Datasets, BioGRID,www.thebiogrid.org)是一个开放的数据库,包含多个物种(如酵母、小鼠和人类等)的蛋白质的相互作用。所有BioGRID内容均来自生物医学文献中的主要实验证据,其中包括了重点低通量研究和大型高通量数据集。BioGRID还可捕获蛋白质翻译后修饰以及蛋白质或基因与生物活性小分子(包括许多已知药物)的相互作用,可以通过网络界面、标准化文件下载或通过模型生物数据库和合作伙伴数据库自由访问所有BioGRID数据[11]。
1.7 统计学分析
使用软件SPSS 26.0和R (3.6.3版本)进行统计分析, Wilcoxon秩和检验(rank sum test)用于分析GEO中基因的表达差异,t检验用于比较ccRCC和正常细胞系中FGFR2表达水平,使用Kaplan-Meier方法分析FGFR2表达对总生存期的影响。使用R (3.6.3版本) 的GSVA包进行FGFR2与免疫细胞浸润分析的可视化,多重假设检验(Dunn’s test)分析FGFR2与临床变量之间的关系,用ggplot2包进行可视化。使用Cox回归分析计算HR值,P<0.05为差异有统计学意义。
2 结果
2.1 公共数据库中FGFR2在 ccRCC 中表达下调
我们在TCGA数据库中分析了ccRCC 肿瘤样本及正常组织中的FGFR2mRNA表达水平,结果表明与正常组织相比,ccRCC肿瘤样本中的FGFR2的mRNA表达水平显著下调,差异具有统计学意义(P<0.001, 图1)。此外,在GEO数据库中,对数据集GSE15641、GSE53757、GSE71963进行比较分析,也能得到相一致的结果(图2), 这些结果表明与正常肾组织相比,ccRCC组织中FGFR2的mRNA表达水平下调。
2.2 FGFR2在ccRCC临床标本和细胞系中表达下调
对104例临床样本进行IHC染色,IHC评分结果显示,与癌旁正常组织相比,ccRCC组织中FGFR2的表达水平下调,代表性结果如图3。此外,采用qRT-PCR比较了正常细胞系和RCC细胞系中FGFR2的mRNA表达水平,结果表明RCC细胞系中FGFR2的mRNA表达水平下调(图4)。
2.3 FGFR2与 ccRCC患者的结局相关
为了探索FGFR2表达与ccRCC患者预后之间的关系,我们分析了TCGA的样本,ccRCC患者的基线信息如表1所示。Kaplan-Meier分析显示,FGFR2表达较低的ccRCC患者总生存率较低(图5)。我们分析了TCGA数据库中ccRCC患者FGFR2表达与肿瘤TNM分期、病理分级以及总生存率(overall survival, OS)的关系(图5)。总而言之,这些结果表明FGFR2高表达与较早期的、更低级别的ccRCC有关,FGFR2高表达与ccRCC患者较好的预后相关。
2.4 FGFR2与ccRCC患者免疫浸润的关系
为了解FGFR2与ccRCC患者免疫浸润的关系,我们分析了ccRCC患者中FGFR2表达与B细胞、T细胞、NK细胞及中性粒细胞浸润的关系(图6), 结果表明FGFR2表达与B细胞、T细胞、NK细胞及中性粒细胞浸润无明显相关关系。
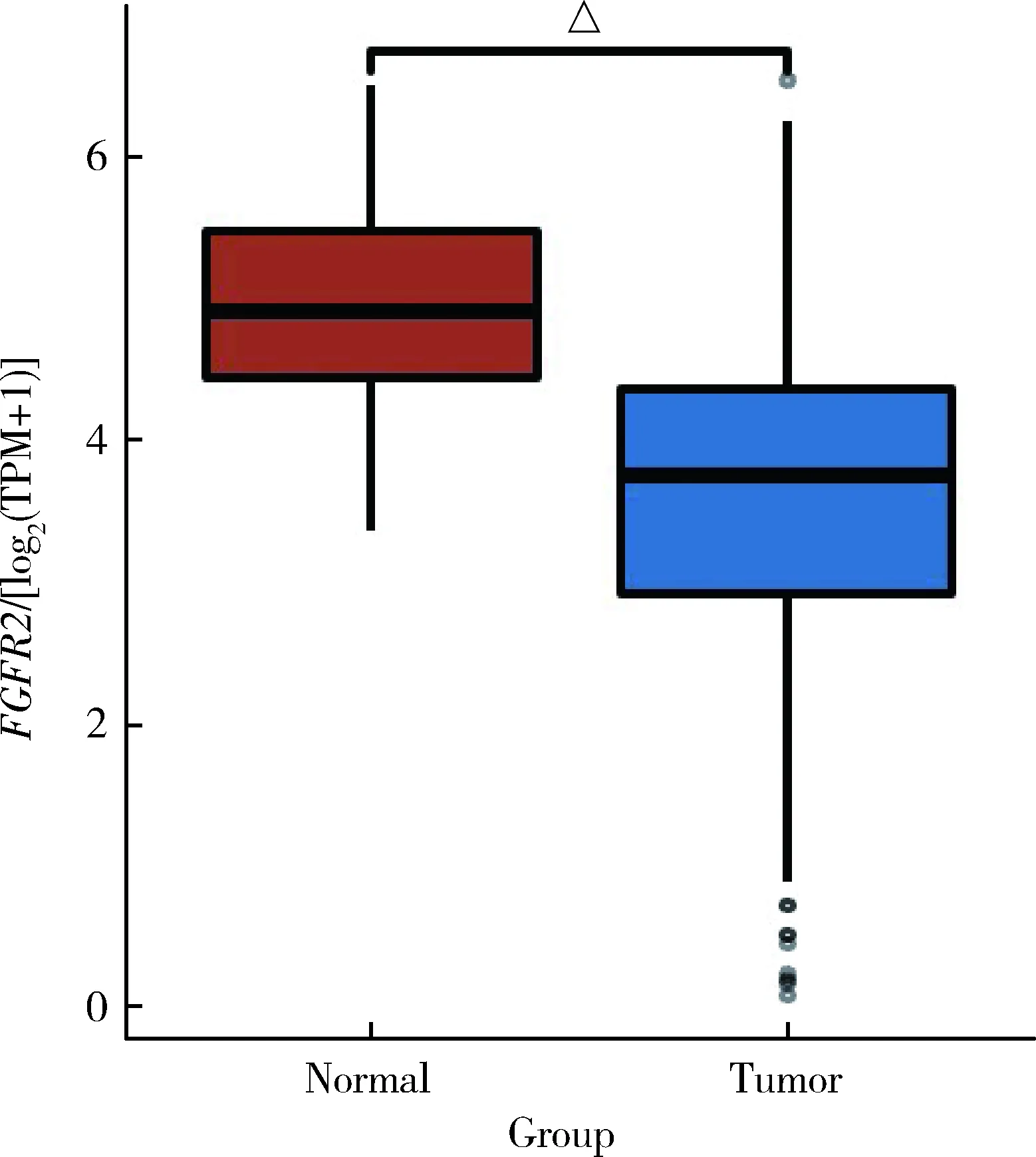
△P<0.001;TCGA, The Cancer Genome Atlas; ccRCC, clear cell renal cell carcinoma; FGFR2, fibroblast growth factor receptor 2; TPM, transcripts per kilobase of exonmodel per million mapped reads.图1 TCGA数据库中ccRCC 肿瘤样本及正常组织中的FGFR2 mRNA表达水平Figure 1 FGFR2 mRNA expression levels in ccRCC tumor samples and normal tissues in the TCGA database

# P<0.01; △ P<0.001; ccRCC, clear cell renal cell carcinoma; FGFR2, fibroblast growth factor receptor 2; GEO, Gene Expression Omnibus database.图2 GEO数据库中ccRCC 肿瘤样本及正常组织中的FGFR2 mRNA表达水平Figure 2 FGFR2 mRNA expression levels in ccRCC tumor samples and normal tissues in the GEO database
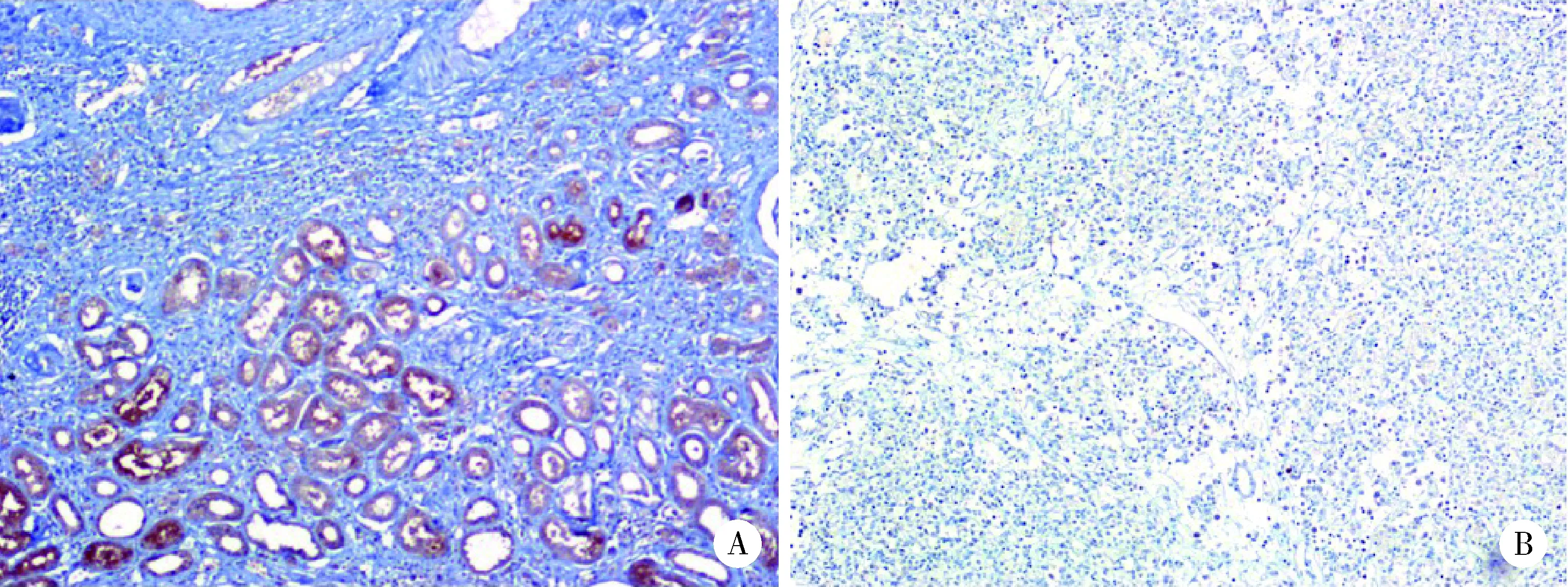
A, normal tissues; B, ccRCC tissues. ccRCC, clear cell renal cell carcinoma; FGFR2, fibroblast growth factor receptor 2; IHC, immunohistochemistry.图3 正常组织及ccRCC组织中FGFR2的免疫组织化学染色情况(IHC ×40)Figure 3 Immunohistochemical staining of FGFR2 in normal tissues and ccRCC tissues (IHC ×40)

*P<0.05;# P<0.01; △ P<0.001; RCC, renal cell carcinoma; FGFR2, fibroblast growth factor receptor 2.图4 正常细胞系(293)及RCC细胞系中FGFR2相对mRNA表达量Figure 4 Relative mRNA expression of FGFR2 in normal cell lines (293)and RCC cell line
2.5 FGFR2蛋白相互作用网络的构建
为了探究FGFR2的功能,我们在BioGRID数据库中寻找与FGFR2相互作用的分子,并构建了PPI网络(图7)。由图中的边缘和节点信息可得,FGFR2与FGFR1、SRC、SHC1、CBL等具有潜在的作用关系,并可能与肿瘤发生发展相关,而其在ccRCC中与各分子的具体关系有待进一步阐明。

表1 TCGA数据库中ccRCC患者的基线资料Table 1 Baseline data of patients with ccRCC in the TCGA database

*P<0.05;# P<0.01; △ P<0.001; ccRCC, clear cell renal cell carcinoma;FGFR2, fibroblast growth factor receptor 2; OS, overall survival; TPM, transcripts per kilobase of exonmodel per million mapped reads.图5 TCGA数据库中ccRCC患者FGFR2表达生存分析曲线及与肿瘤TNM分期、病理分级和OS的关系Figure 5 Relationship of FGFR2 expression in patients with ccRCC in the TCGA database with tumor TNM staging, pathological grading, and OS

A, T cells; B, neutrophils; C, B cells; D, NK cells. FGFR2, fibroblast growth factor receptor 2;TPM, transcripts per kilobase of exonmodel per million mapped reads; NK, natural killer; ccRCC, clear cell renal cell carcinoma.图6 ccRCC患者中FGFR2表达与B细胞、T细胞、NK细胞及中性粒细胞浸润情况Figure 6 FGFR2 expression and B cells, T cells, NK cells and neutrophils infiltration in patients with ccRCC
3 讨论
ccRCC是常见的恶性肿瘤类型之一[12],其对常规放、化疗抵抗,术后易复发,因此治疗仍然是一个巨大的挑战[7]。FGF/FGFR信号转导轴在正常器官、血管和骨骼发育中起重要作用,而 FGF / FGFR信号异常参与了肿瘤的发生和进展[8, 13]。既往研究中发现,FGFR2在多种肿瘤中起作用,如胃癌中显示出FGFR2过表达和基因扩增[14],且FGFR2通过PI3K-Akt-mTOR途径抑制血栓蛋白4的表达来促进胃癌进展[15];FGFR2还可促进PD-L1在结肠癌异种移植小鼠模型中的表达[9];此外,FGFR2可通过ERK-YY1轴抑制乳腺癌1号易感基因(breast cancer susceptibility gene,BRCA1)的表达并促进乳腺肿瘤进展[16],而三磷酸腺苷竞争性FGFR激酶抑制剂在具有FGFR2融合基因的肝内胆管癌(intrahepatic cholangiocarcinoma,ICC)患者中显示出抗肿瘤活性[17]。相反地,在前列腺癌中,FGFR2通过控制缺氧诱导因子-1α(hypoxia-inducible factor, HIF-1α)及HIF-2α介导的缺氧反应,可作为转移抑制因子[18],因此,FGFR2可以作为抗癌新分子疗法的一个有希望的靶点。然而,目前为止,对FGFR2在ccRCC中的作用研究较少,既往的研究尚未将其具体作用机制阐明。
以往研究中,有研究者通过IHC染色方法,分析了FGF及其受体家族在RCC中的表达,结果表明 FGF2及其受体在RCC原发肿瘤细胞和细胞质中均有表达,且与FGFR1相比,FGFR2表达的频率和强度更高。FGFR2过表达在单变量分析中显示出对癌症特异性生存的负面影响,然而,在多变量分析中失去了其预测价值,需要进一步研究[19],而且,研究者发现,在近90%的ccRCC中,FGFR2基因转录本从正常的Ⅲb亚型(“上皮”)切换到Ⅲc亚型(“间充质”)。临床上,FGFR2-Ⅲb型 ccRCC的体积更小,肿瘤等级较低,并且与更长的患者生存期相关[20]。
本研究中,根据TCGA及GEO数据以及我们的数据库,发现FGFR2mRNA和蛋白质水平的表达在ccRCC细胞系及组织中被下调,并且随着恶性肿瘤的进展有进一步下调趋势。FGFR2可能是ccRCC患者的潜在预后标志物,可能作为ccRCC患者的潜在治疗靶点。
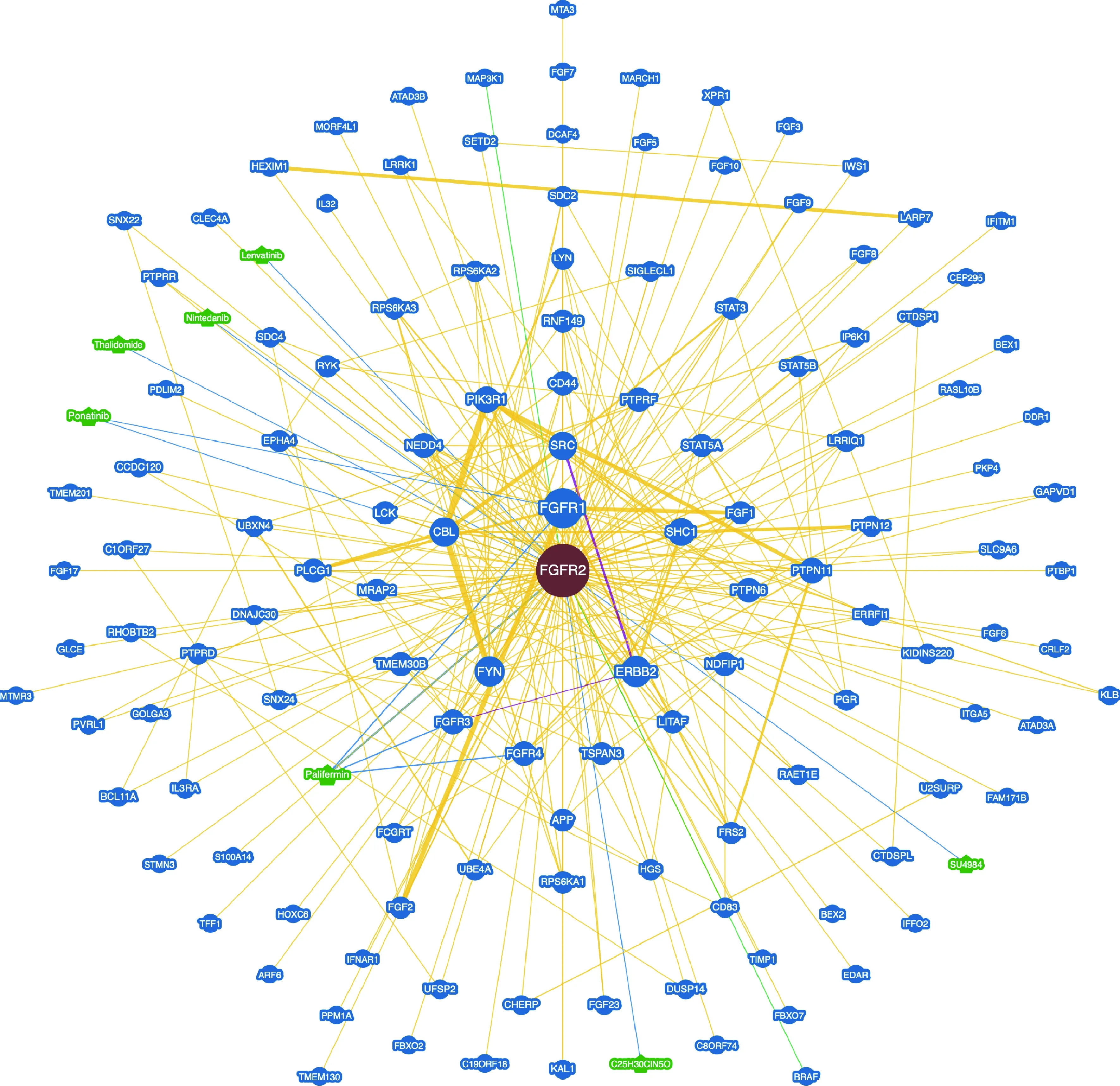
FGFR1, fibroblast growth factor receptor 1; FGFR2, fibroblast growth factor receptor 2.图7 FGFR2的蛋白相互作用网络Figure 7 Protein interaction network of FGFR2
上皮间质转化(epithelial mesenchymal transition,EMT)是一种细胞生物学程序,自然发生在广泛的组织类型和发育阶段中,是发育、伤口愈合和干细胞行为中不可或缺的一部分,并在病理学上促进纤维化和癌症进展。顾名思义,EMT过程是将上皮细胞转换为间质细胞。根据组织内细胞接收的信号,该过程先生成一系列中间表型状态的细胞,当被驱使到极端时,将完全上皮细胞转化为完全间质细胞。上皮细胞表现出上皮细胞间连接和顶端-基底极性,而间质细胞表现出运动性和侵袭性增强,形态呈现纺锤形,缺乏顶端-基底极性。在肿瘤中,目前主流观点认为EMT 过程可能参与转移级联的初始步骤,包括肿瘤侵袭、血管内浸润和微转移形成,这得到了多种体外和体内功能数据以及人体样本相关数据的支持。肿瘤细胞中EMT样变化已被广泛研究,并且意味着侵袭性增加、DNA损伤增加和对化疗诱导的细胞凋亡的抵抗力增加,同时免疫受到抑制以及获得干细胞样特征。既往研究表明FGFR2与EMT之间存在相关关系,因此,我们推测FGFR2可能通过影响EMT通路,从而影响癌症的恶性行为[21]。
总而言之,本研究表明FGFR2表达与ccRCC发生发展及患者预后相关,这些结果有助于为ccRCC提供新的治疗靶点和预后标志物。

