益生菌复合制剂对头孢曲松钠作用小鼠的抗氧化指标、细胞因子及肠道菌群的影响
郭子晨,刘 倩,王韵婷,王 涵,赵江燕,赵雅欣,孙雅煊,戴雪伶,
(1.北京联合大学生物化学工程学院,北京 101500;2.北京联合大学应用文理学院保健食品检测中心,北京 100191)
肠道是人体吸收营养、排出代谢废物的器官,对人体营养、代谢、免疫起着重要作用[1]。在人类肠道中生活着约500 种细菌,数量多达100 亿。这些细菌构成了一个庞大复杂的微生态系统,与宿主共同维持着肠道微生态的稳定,保护着人体健康[2−3]。正常情况下肠道菌群处于平衡状态,然而在服用抗生素等不利条件影响下,肠道微生态平衡被打破,有害菌大量繁殖,引发炎症性肠病[4−6]。
益生菌是一类主要寄生于肠道中的有益活性微生物,通过改善宿主肠道微生态平衡来发挥作用,如调节肠道pH、促进有益菌繁殖、促进肠道营养物质吸收等作用[7]。长双歧杆菌BB536(Bifidobacterium longumsubsp.longumBB536)属于革兰氏阳性菌,由日本科学家从健康婴儿的肠道中分离得到,可以通过调节肠道菌群、改善肠道微环境、提高机体免疫,来促进人体健康[8−10]。乳双歧杆菌HN019(Bifidobacterium animalissubsp.lactisHN019)是一种从酸奶中分离得到的革兰氏阳性菌,具有促进肠道蠕动、排便、调节免疫等功效,已被广泛应用于婴幼儿食品中[11−14]。不同菌株效果各异,目前市场上的益生菌保健食品主要以多种益生菌组成的益生菌复合制剂为主[15−16]。
抗生素主要用于治疗各种感染类疾病,若长期服用则会导致肠道菌群失调,导致功能紊乱,甚至还会对肝脏等器官造成损害。在医学领域,通过使用益生菌来减轻抗生素带来的副作用已受到广泛关注,临床上常用的益生菌主要以各类双歧杆菌和乳杆菌为主,但如何根据不同症状选择合适的益生菌以及剂量问题还有待进一步研究[17−18]。头孢曲松钠属于第三代头孢类抗生素,对革兰氏阳性菌以及革兰氏阴性菌均有一定的抑制作用。长双歧杆菌BB536 与乳双歧杆菌HN019 是两种对机体有益的菌株,适用于改善肠道健康,目前已被广泛使用,但关于该菌株在改善由抗生素造成的损害方面尚未报道,因此本研究通过灌胃小鼠头孢曲松钠建立肠道菌群失调模型小鼠,探究由长双歧杆菌BB536 和乳双歧杆菌HN019 组成的益生菌复合制剂对其的改善效果,以期为益生菌复合制剂在保健食品中的开发应用提供更多数据支持。
1 材料与方法
1.1 材料与仪器
头孢曲松钠 上海阿拉丁生化科技股份有限公司;益生菌混合粉(主要原料为长双歧杆菌BB536 2.5×109CFU/g、乳双歧杆菌HN019 2.5×109CFU/g)汤臣倍健有限公司;EMB 琼脂培养基、肠球菌琼脂培养基、LBS 琼脂培养基、BBL 琼脂培养基 北京陆桥技术股份有限公司;IL-2、IL-6、IL-1β、TNFα试剂盒 武汉华美生物工程有限公司;MDA、T-SOD、GSH、GSH-PX 试剂盒 南京建成生物科技有限公司;Qiagen Gel Extraction Kit 试剂盒 德国Qiagen公司;Gene JETTM Gel Extraction Kit 试剂盒 赛默飞世尔科技有限公司;TruSeq®DNA PCR-Free 试剂盒 美国Illumina 公司;60 只4 周龄SPF 级BALB/c小鼠,体重(20±2)g 购自北京华阜康生物科技股份有限公司,许可证号:SCXK(京)2019-0008,小鼠饲养环境温度(22±2)℃,湿度50%~60%,每日光照和黑暗各12 h。
GI54DW 高压灭菌锅 美国Zealway 公司;5425R台式离心机 德国艾本德公司;DHG-9003 鼓风干燥箱 上海一恒科技有限公司;Large Direct-Pure EDI纯水系统 上海乐枫生物科技有限公司;NU-9483E超低温冰箱 美国Nuaire 公司;MS3 漩涡混合器德国IKA 公司;V-1600 可见分光光度计 上海美普达仪器有限公司;HHW21.420D 恒温水箱 天津泰斯特仪器有限公司;Infinite M200 Pro 多功能酶标仪上海安景科技有限公司;ZDP-9082 恒温培养箱上海喆图科学仪器有限公司;Qubit@2.0 荧光仪 赛默飞世尔科技有限公司。
1.2 实验方法
1.2.1 动物分组与给药 60 只雄性BALB/c 小鼠,适应性饲养7 d 后,随机选取48 只小鼠,构造肠道菌群失调模型小鼠,参照李贞贞等[19]、蒋丰岭等[20]和于海宁等[21]的实验方法并加以改进:连续灌胃5 d 头孢曲松钠(2 mg/g),之后随机分为模型组、低剂量组、中剂量组和高剂量组,每组12 只。益生菌复合制剂灌胃剂量依据临床人体用量进行计算,成人益生菌粉的推荐剂量为1 g/d,参考《保健食品功能评价方法》,以人体推荐剂量的5、10、30 倍作为本实验的低、中、高剂量,根据益生菌混合粉的活菌数计算出灌胃小鼠的低、中、高剂量分别为2×105CFU/g、4×105CFU/g、1.2×106CFU/g,各剂量组中的BB536 和HN019 活菌数比值为1:1。另设正常鼠为对照组,对照组和模型组灌胃生理盐水,各剂量组灌胃对应剂量的益生菌复合制剂30 d,每只0.2 mL/d。每天测量小鼠体重和摄食情况并记录,实验结束后所有小鼠摘眼球取血后脱颈处死,解剖并取出心、肝、脾、肺、肾、胸腺,计算脏器系数并保留空肠和肝脏。本实验方案由北京联合大学应用文理学院保健食品功能检测中心实验动物伦理委员会批准(伦理委员会意见书编号:2021-04)。

1.2.2 益生菌复合制剂对小鼠细胞因子的影响 小鼠血液置于1.5 mL 离心管中,4000 r/min 离心10 min,保留血清待测。血清中白介素2(IL-2)、白介素6(IL-6)、白介素1β(IL-1β)、肿瘤坏死因子α(TNFα)均采用ELISA 进行测定,详细步骤严格按照ELISA试剂盒说明书进行。
1.2.3 益生菌复合制剂对小鼠抗氧化活性物质的影响 用匀浆器12000 r/min 上下研磨制成组织匀浆,肝脏和空肠中的超氧化物歧化酶(T-SOD)测定采用1%浓度进行测定,丙二醛(MDA)、谷胱甘肽(GSH)、谷胱甘肽过氧化物酶(GSH-PX)采用10%浓度进行测定,后续步骤严格按照试剂盒说明书进行。
1.2.4 肠道菌群计数 在灌胃5 d 头孢曲松钠后以及灌胃30 d 益生菌复合制剂后,无菌收集所有小鼠粪便数粒后,加入稀释液充分振荡混匀,依10 倍系列稀释至10−8,肠杆菌选择EMB 琼脂培养基,37 ℃培养24 h;肠球菌和乳杆菌分别选择肠球菌琼脂培养基和LBS 琼脂培养基,37 ℃培养48 h;双歧杆菌选择BBL 琼脂培养基,37 ℃厌氧培养48 h,培养结束后计算出每克湿便中的菌落数(lg CFU/g)。
1.2.5 肠道菌群结构测序 灌胃30 d 后,每组选取6 只,无菌收集小鼠粪便进行DNA 提取,通过PCR技术对16S rDNA V3-V4 区域扩增,区域引物为:5’-3’CCTAYGGGRBGCASCAG,3’-5’GGACTACNNG GGTATCTAAT,构建文库,通过Illumina NovaSeq测序平台对该文库进行双末端测序,对所得数据进行拼接、过滤后进行OTUs 聚类和物种分类分析。
1.3 数据处理
试验数据通过Excel 预处理后,应用SPSS 19.0统计软件进行显著性分析,摄食和体重采用单因素ANOVA 分析,肠道菌群计数采用独立样本t检验分析,所有数据用均值±标准差(±s)表示,P<0.05 表示有显著差异,P<0.01 表示有极显著差异,P>0.05 表示无显著差异。
2 结果与分析
2.1 益生菌复合制剂对小鼠体重和摄食的影响
由图1 可知,灌胃头孢曲松钠后,小鼠体重和摄食量呈下降趋势,表明头孢曲松钠对小鼠的体重和摄食有较大影响。模型组与其余四组相比,在整个实验过程中摄食和体重都处于较低水平,在灌胃不同剂量益生菌复合制剂后小鼠摄食和体重情况均有一定改善,并逐渐恢复至正常水平,其中高剂量组恢复效果较为明显,说明益生菌复合制剂改善了小鼠肠道紊乱状态,促进肠道健康。

图1 益生菌制剂对小鼠摄食(A)和体重(B)的影响Fig.1 Effect of probiotic preparation on food intake (A) and body weight (B) of mice
2.2 益生菌复合制剂对小鼠脏器系数的影响
由表1 可以,模型组以及各剂量组与对照组相比,全部脏器系数均无显著差异(P>0.05),表明灌胃头孢曲松钠以及益生菌复合制剂对各脏器无影响。
表1 小鼠各器官脏器系数(mg/g,±s,n=12)Table 1 Coefficients of various organs in mice (mg/g,± s,n=12)
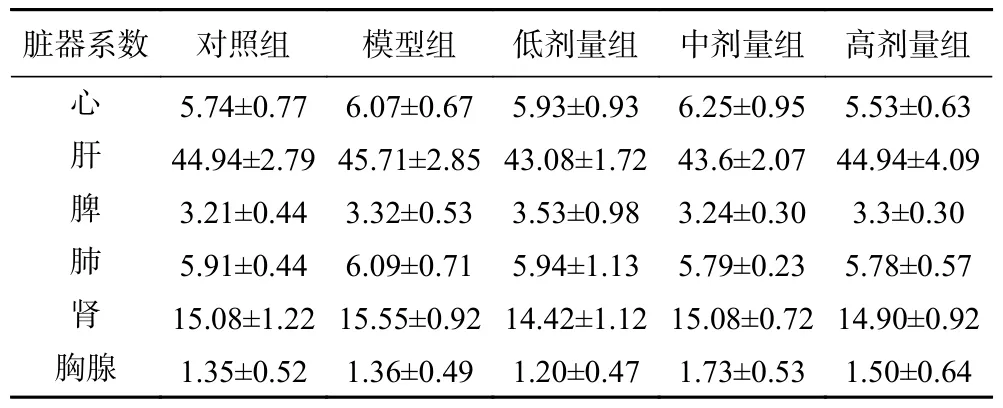
表1 小鼠各器官脏器系数(mg/g,±s,n=12)Table 1 Coefficients of various organs in mice (mg/g,± s,n=12)
2.3 益生菌复合制剂对小鼠血清中细胞因子的影响
大量研究表明,部分益生菌除了可以调节肠道菌群平衡,促进肠道健康外,还有一定的抗炎能力[22−23]。IL-2、IL-6、IL-1β、TNF-α是与肠道疾病关系密切的促炎细胞因子,是机体炎症反应中的重要炎症介质[24−25]。由表2 可知,模型组与对照组相比IL-2 水平极显著提高(P<0.01),IL-6 和TNF-α水平显著提高(P<0.05)。灌胃益生菌复合制剂后,低剂量组与模型组相比,IL-2 水平显著降低(P<0.05);中剂量组与模型组相比,IL-2、TNF-α、IL-6 水平显著降低(P<0.05);高剂量组与模型组相比,IL-6 和IL-1β水平显著降低(P<0.05),IL-2 水平和TNF-α水平极显著降低(P<0.01)。上述结果表明,灌胃头孢曲松钠使IL-2、TNF-α、IL-1β、IL-6 水平提高,但在益生菌复合制剂的帮助下有所改善,说明益生菌复合制剂减轻了由抗生素引起的炎症,对缓解炎症有着重要帮助。
表2 小鼠血清中各细胞因子的含量(±s,n=12)Table 2 The content of each cytokine in mouse serum (± s,n=12)

表2 小鼠血清中各细胞因子的含量(±s,n=12)Table 2 The content of each cytokine in mouse serum (± s,n=12)
注:*:与模型组相比P<0.05;**:与模型组相比P<0.01;#:与对照组相比P<0.05;##:与对照组比P<0.01;表3同。
2.4 益生菌复合制剂对小鼠肝脏抗氧化活性物质的影响
肠道和肝脏作为机体重要的代谢器官,除了参与各类化合物的分解和代谢外,在维持机体氧化还原平衡中起到重要作用[26−27]。正常情况下,机体的氧化与还原能力处于稳态,当机体在受到外界刺激后,引发氧化应激,导致氧化损伤。空肠是机体消化物质和吸收营养的重要部位,其代谢水平与健康密切相关。MDA 是膜脂过氧化所形成的产物,具有一定的细胞毒性,会改变细胞膜的通透性。SOD 是一种广泛存在于生物体中的活性物质,在清除机体内的氧自由基方面具有重要作用。GSH 是一种由谷氨酸、半胱氨酸和甘氨酸组成的三肽化合物,是机体中最重要的抗氧化剂[28]。GSH-Px 是机体抗氧化能力的指标之一,可以减轻过氧化物对机体的损伤,维持细胞膜的正常功能。
结果由表3 可知,在空肠中,模型组与对照组相比,MDA 水平显著提高(P<0.05),T-SOD 水平显著降低(P<0.05);低剂量组与模型组相比,MDA 水平极显著降低(P<0.01),GSH-PX 水平显著提高(P<0.05);中剂量组和高剂量组与模型组相比,MDA 水平极显著降低(P<0.01),GSH 水平显著提高(P<0.05),GSH-PX 水平极显著提高(P<0.01),并且高剂量组T-SOD 水平与模型组相比也显著提高(P<0.05)。在肝脏中,中剂量组和高剂量组与模型组相比,T-SOD 水平显著提高(P<0.05),GSH-PX 水平显著提高(P<0.05),并且高剂量组MDA 水平与模型组相比还显著降低(P<0.05)。此次实验表明,在头孢曲松钠的作用下,激发了机体氧化应激,使空肠和肝脏的抗氧化功能受到损害,在灌胃益生菌复合制剂后可以显著促进抗氧化物质的产生,并且呈现出一定的剂量依赖效应。此外,肝脏具有解毒作用,机体产生的毒素都是通过肝脏来进行清除,各剂量组与模型组相比,肝脏中的MDA 水平呈下降趋势,说明益生菌复合制剂对肝脏具有一定的保护作用。

表3 小鼠空肠和肝脏中抗氧化指标Table 3 Antioxidant indexes in the jejunum and liver of mice
2.5 益生菌复合制剂对肠道菌群影响
肠道菌群计数结果显示(表4),第0 d(头孢曲松钠造模后,益生菌复合制剂灌胃前),模型组以及各剂量组与对照组相比,肠杆菌、肠球菌、乳杆菌和双歧杆菌数量均极显著降低(P<0.01),表明通过灌胃头孢曲松钠成功构造小鼠肠道菌群失调模型。模型组第30 d 与第0 d 数据相比,肠杆菌和肠球菌数量极显著提高(P<0.01),且高于同时期的对照组,乳杆菌和双歧杆菌数量极显著提高(P<0.01),但仍低于同时期的对照组,说明小鼠自身具有一定的恢复能力,但在缺少益生菌复合制剂的帮助下无法恢复至正常水平。灌胃30 d 益生菌复合制剂后,低剂量组与模型组相比,肠杆菌数量极显著降低(P<0.01),肠球菌数量显著降低(P<0.05);中剂量组与模型组相比,肠杆菌数量显著降低(P<0.05);高剂量组与模型组相比,肠杆菌数量显著降低(P<0.05),乳杆菌数量极显著提高(P<0.01),双歧杆菌数量显著提高(P<0.05)。此外,在各剂量组中,与灌胃前益生菌复合制剂自身相比,灌胃益生菌复合制剂后肠杆菌、肠球菌、乳杆菌和双歧杆菌数量均极显著提高(P<0.01)。
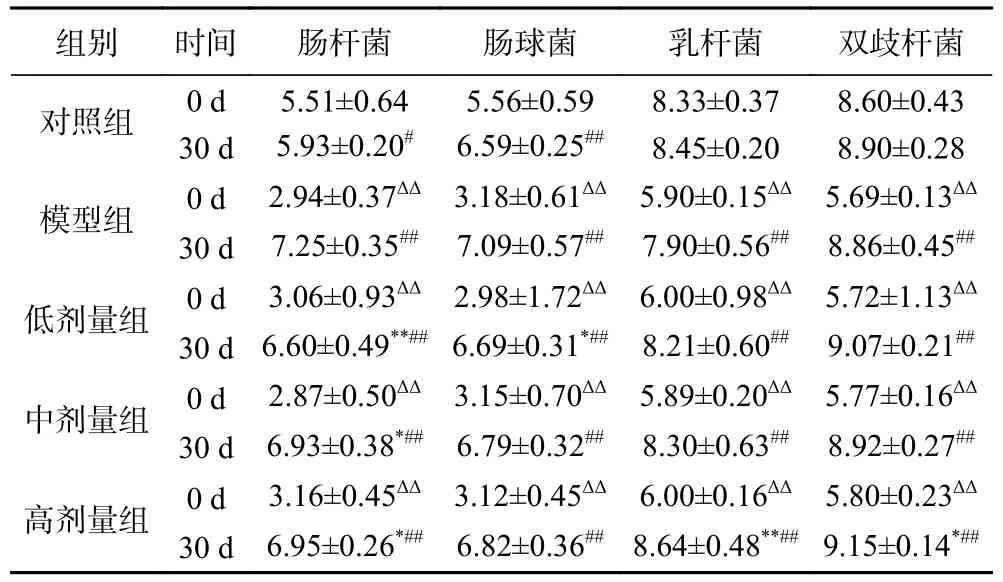
表4 第0 d 和30 d 粪便肠道菌群计数(lg CFU/g)Table 4 Count of fecal intestinal flora at 0 d and 30 d (lg CFU/g)
肠道菌群计数结果显示,在灌胃30 d 益生菌复合制剂后,各剂量组与模型组相比,肠杆菌和肠球菌数量均有不同程度降低,但仍高于对照组,乳杆菌和双歧杆菌数量均呈上升趋势,且与对照组相当,表明益生菌复合制剂对小鼠肠道菌群失调具有显著调节作用。肠球菌和肠杆菌广泛存在于机体肠道中,正常情况下与机体互利共生,不会对机体造成影响,然而当机体免疫力等条件下时,则会引起腹泻、肠炎等疾病[29−30]。双歧杆菌和乳杆菌是人肠道菌群中重要成员,具有良好的抗炎和抗氧化活性,可以通过抑制有害菌的生长来改善肠道菌群以及调节代谢[31−33]。上述结果显示,灌胃益生菌复合制剂后,抑制了肠杆菌和肠球菌的生长,同时促进了乳杆菌和双歧杆菌的繁殖,说明益生菌复合制剂的抗炎和抗氧化功效可能与乳杆菌和双歧杆菌有关。
各组稀释曲线(图2)结果显示,稀释曲线快速升高后逐渐趋于平坦,说明样本的测序数据量充足,可以准确反映样本的菌群特征。对各组微生物进行了研究,结果表明在门水平(图3)各实验组主要优势菌包括拟杆菌门(Bacteroidota)和厚壁菌门(Firmicutes),与对照组相比,在抗生素造损的各组中疣微菌门(Verrucomicrobiota)丰度有所上升、unidentified_Bacteria 丰度有所下降。各剂量组与模型组相比疣微菌门(Verrucomicrobiota)丰度有所恢复。

图2 稀释曲线Fig.2 Dilution curve

图3 肠道菌群门水平丰富度Fig.3 Abundance of intestinal flora at portal level
在属水平(图4),各实验组主要优势群包括艾克曼菌属(Akkermansia)、葡萄球菌属(Staphylococcus)、乳酸杆菌属(Lactobacillus)、普雷沃氏菌属(Prevotellaceae_UCG_001)、毛螺旋菌(Lachnospiraceae_NK4A136_group)。对组间差异物种(图5)进行分析,结果表明模型组与对照组相比,Aerococcus、Candidatus_Saccharimonas、理研菌属(Rikenella)显著降低(P<0.05),艾克曼菌属(Akkermansia)显著升高(P<0.05),毛螺旋菌(Lchnospiraceae_NK4A136_group)极显著降低(P<0.01)。低剂量组与模型组相比,副杆菌属(Parabacteroides)极显著提高(P<0.01)。中剂量组与模型组相比,乳球菌属(Lactococcus)极显著提高(P<0.01),双歧杆菌(Bifidobacterium)和鼠尾草菌(Muribaculum)显著提高(P<0.05)。高剂量组与模型组相比,拟普雷沃菌属(Alloprevotella)显著提高(P<0.05),副杆菌属(Parabacteroides)、普雷沃氏菌属(Prevotellaceae_UCG_001)极显著提高(P<0.01),单球菌(Monoglobus)显著降低(P<0.05)。

图4 肠道菌群属水平丰富度Fig.4 Abundance of intestinal flora at genus level

图5 肠道菌群属水平组间样本分析Fig.5 Analysis of samples between groups of intestinal flora at genus level
Akkermansia是对人体健康有益的益生菌,上述细胞因子测定结果已经证明头孢曲松钠引起了小鼠炎症反应,可能是炎症刺激了机体免疫应答,通过促进Akkermansia的大量繁殖来起到消炎和调节机疫的作用,由于益生菌复合制剂的作用,小鼠的炎症逐渐消失,Akkermansia的数量也随之下降,但这一结论还有待进一步验证。Parabacteroides是寄生在人体肠道的革兰氏阴性厌氧菌,是新型抗代谢综合症益生菌,已有研究表明Parabacteroides可以通过降低小鼠血清中IL-6 水平并通过降低结肠中促炎基因Il1b、Il6、Tnfa、Cxcl2的表达来减轻机体炎症[34]。FABERSANI 等[35]研究发现,在给予小鼠乳球菌后,小鼠血液中葡萄糖、胆固醇、甘油三脂、TNF-α和IL-6 水平降低,IL-10 水平提高,说明乳球菌在改善肥胖和抑制炎症方面有一定作用。此外,TIAN 等[36]研究发现,在膳食纤维的作用下,人体肠道中Parabacteroides和Alloprevotella的数量明显提高,表明Alloprevotella是一种潜在的益生菌,但其作用机理还有待进一步研究。分析结果显示,与对照组相比,灌胃益生菌复合制剂后,肠道中的Parabacteroides、Lactococcus和Alloprevotella的数量较多,与已有认知相符,猜测益生菌复合制剂可能是通过促进小鼠肠道中的Parabacteroides、Lactococcus和Alloprevotella的繁殖来起到减轻炎症的作用。Bifidobacterium是一株具有抗氧化功效的优良菌株,可以增加胸腺和脾脏中T-SOD 和GSH-PX 水平以及清除MDA[37],从属水平组间差异物种分析可以看出,中剂量组的Bifidobacterium要高于对照组和模型组,这与肠道菌群计数结果一致,此外Bifidobacterium还具有清热解毒作用,前文抗氧化实验已经证实益生菌复合制剂可以提高肝脏的T-SOD、GSH、GSH-PX 水平并清除MDA,显示出一定的抗氧化能力,结合上述实验结论可知,长期服用益生菌复合制剂可以提高小鼠肠道中Bifidobacterium的数量,进而起到抗氧化和清除有害物质的作用。
Shannon 和Simpson 指数是肠道菌群丰富度的重要指标,由图6 可知,模型组与对照组相比,Shannon 和Simpson 指数显著降低(P<0.05),各剂量组与模型组相比,Shannon 和Simpson 指数升高,但无显著差异(P>0.05),说明灌胃头孢曲松钠引起了小鼠肠道菌群紊乱、肠道微生态平衡被打破降低了小鼠肠道菌群的丰富度,而益生菌复合制剂均可在一定程度上提高肠道菌群的丰富度。
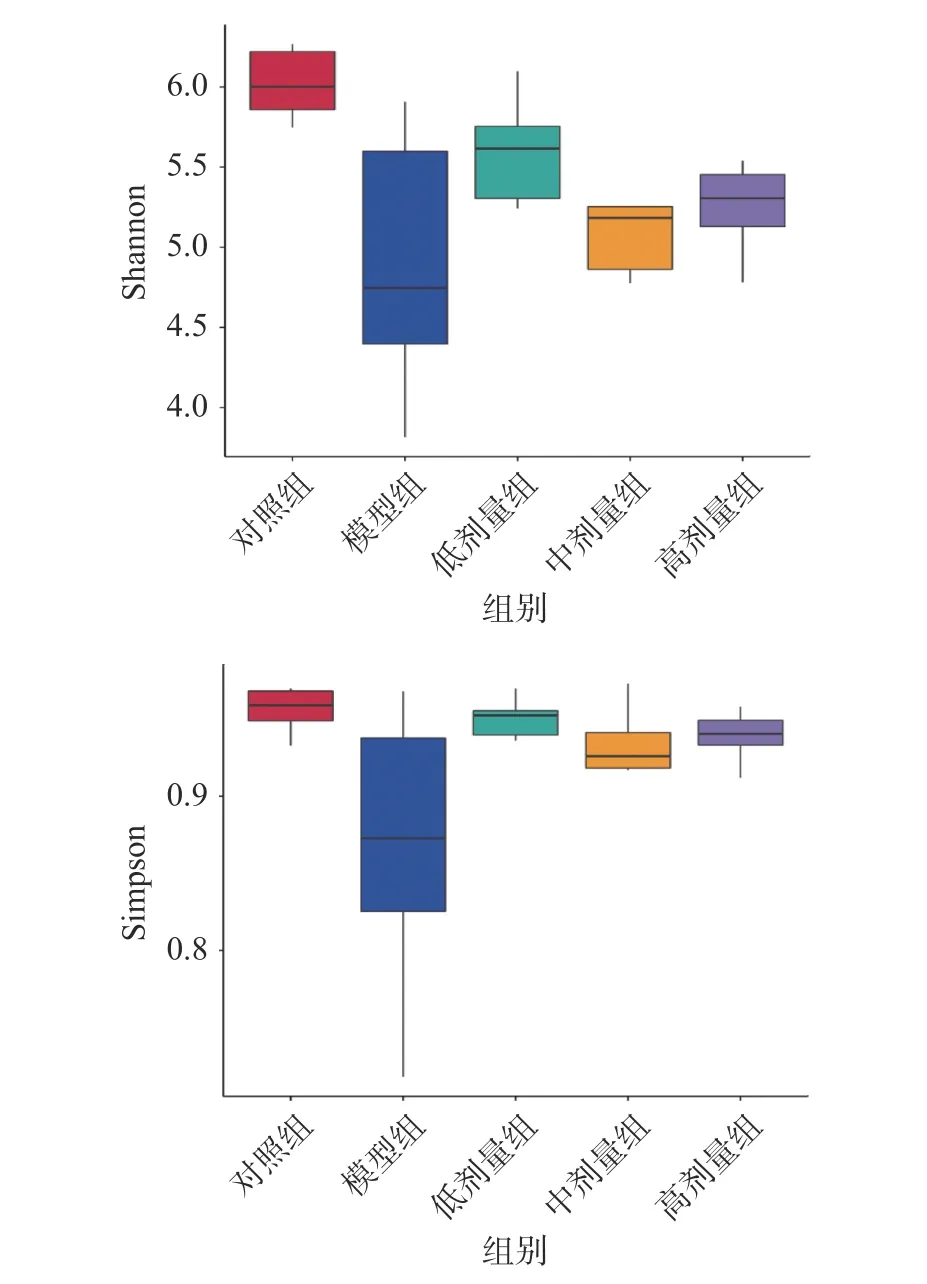
图6 肠道菌群Shannon 指数和Simpson 指数Fig.6 Shannon index and Simpson index of intestinal flora
在level2 水平上,如图7 所示,共获得35 个功能丰度。模型组与低剂量组功能类似,其它次级生代谢物的生物合成(Biosynthesis_of_other_secondary_metabolites)、代谢(Metabolism)、辅助因子和维生素代谢(Metabolism_of_cofactors_and_vitamins)、细胞运动(Cell motility)、免疫系统(Immune_system)、能量代谢(Energy_metabolism)、脂质代谢(Lipid_metabolism)基因丰度较低,癌症(Caners)、神经系统(Nervous_system)、老化(Aging)基因丰度较高。对照组与中、高剂量组功能类似,主要有:能量代谢(Energy_metabolism)、膜转运(Membrane_transport)、酶(Enzyme_families)、细胞生长和凋亡(Cell_growth_and_death)、转录(Transcription)、细胞分子和相互作用(Signaling_molecules_and_interaction)、内分泌系统(Endocrine_system)、复制和修复(Replication_and_repair)、核苷酸代谢(Nucleotide_metabolism)。益生菌除了可以改善肠道微生态环境,对提高机体免疫和促进内分泌也有一定的帮助。由功能预测结果可知,中高剂量组在免疫、能量代谢和内分泌方面的基因丰度较高,说明益生菌复合制剂对小鼠肠道微生物的功能具有一定调节作用,对机体代谢和免疫具有潜在功效。

图7 功能预测分析热图Fig.7 Heat map of function prediction analysis
3 结论
近些年,随着头孢等药物在临床上的应用越发广泛,抗生素滥用问题引起人们担忧,如何减轻抗生素带来的副作用已成为当下需要解决的问题。益生菌是临床上常用的微生态活菌制剂,大量研究证实可以有效缓解由抗生素引发的不良反应。本研究首先利用头孢曲松钠构建了肠道菌群紊乱模型小鼠,在连续给药5 d 后,小鼠除了肠道中有害菌大量增加导致肠道菌群失调外,IL-2、IL-6、IL-1β和TNF-α水平上升,表明机体出现了炎症,同时抗氧化能力也受到一定损害。然后,将由长双歧杆菌BB536 和乳双歧杆菌HN019 组成的益生菌复合制剂对小鼠进行30 d的灌胃,IL-2、IL-6、IL-1β和TNF-α均呈下降趋势,并呈现出一定的剂量依赖性。在高剂量的益生菌复合制剂的帮助下,抗氧化能力有所恢复,空肠和肝脏中MDA 水平大幅降低,T-SOD、GSH、GSH-PX 水平均有不同程度提高,其中GSH-PX 最为明显,显示出一定的护肝作用。肠道微生物方面,灌胃益生菌复合制剂在一定程度上提高了肠道菌群的丰富度,主要体现在对肠杆菌和肠球菌的抑制和促进乳杆菌、双歧杆菌、Parabacteroides、Lactococcus以及Alloprevotella的繁殖,并推测这些有益菌可能与机体抗炎和抗氧化作用有关。关于BB536 和HN019 在调节肠道菌群、抗炎和抗氧化方面已经有大量研究,其结果与本次实验结果大致相同,但这两种益生菌在减轻抗生素副作用方面少有报道,通过本实验结果可知,由BB536 和HN019 组成的益生菌复合制剂改善了小鼠由于头孢曲松钠引起的肠道菌群失调状态,并在一定程度上恢复了抗炎和抗氧化能力,说明BB536 和HN019 组成的益生菌复合制剂可以有效缓解抗生素带来的副作用,此外16S rDNA 高通量测序的功能预测结果显示,这两种益生菌在提高免疫、促进代谢以及促进细胞生长方面可能会有一定的有益效果,这一发现为后续的实验研究提供了思路。

