米糠蛋白-亚麻籽油乳液体系构建及其稳定性研究
赵福权,王 铖,周嘉玲,王珍珍,余 瞻,吴致鑫,沙如意,,毛建卫,2,
(1.浙江省农产品化学与生物加工技术重点实验室,浙江省农业生物资源生化制造协同创新中心,浙江科技学院生物与化学工程学院,浙江杭州 310023;2.浙江工业职业技术学院,浙江绍兴 312000)
水包油型乳液是由水相与油相组成的分散体系,其中,油相以液滴的形式分散于水相中。但水包油型乳液是热力学不稳定体系,油-水界面存在很高的界面自由能[1],因此需要借助乳化剂降低界面自由能来维持乳液稳定。目前在制备乳液时,常使用一些小分子表面活性剂(司班、吐温)作为乳化剂,但这些乳化剂对人体有一定的安全隐患[2]。现有大量天然物质如磷脂、皂苷、多糖、蛋白质等[3−5]被证实同样具有稳定乳液的能力。当今社会随着人们对食品安全意识的提升,采用具有稳定乳液能力的食品级材料代替传统乳化剂的研究逐渐成为新的研究热点。
米糠(Rice bran)是稻米加工副产物,价廉、营养丰富,现阶段大部分被用作动物饲料,造成资源的严重浪费,因此,急需开发米糠精深加工产品。米糠蛋白是一种优质的植物蛋白[6],其氨基酸种类齐全,特别是赖氨酸、蛋氨酸含量很高,具有生物效价高、低过敏性、消化率高、营养价值丰富等特点,还具有调节身体节律[7]、提高人体免疫力等[8]作用。王可心等[9]研究表明以米糠蛋白为乳化剂稳定的大豆油乳液具有良好稳定性,添加0.4%的米糠蛋白,乳液的平均粒径为5.15 μm。已有研究表明[10−11],蛋白质稳定乳液的机理是因为蛋白质具有两亲性,在乳液中能够快速扩散并吸附在油-水界面,在界面上进一步聚合形成粘弹性保护层,降低界面自由能并避免液滴之间发生聚结和絮凝,从而使乳液达到稳定状态。但米糠蛋白在乳液中的应用还较少,其稳定性还有待进一步研究。
亚麻籽(Flaxseed)已存在数千年,分布于世界各地,目前我国亚麻籽分布地主要有黑龙江、内蒙古、陕西秦岭、山西、宁夏等,亚麻籽主要作为油料用于食品的生产加工中。亚麻籽油(Flaxseed oil)的主要成分为亚油酸和α-亚麻酸[12],其中,α-亚麻酸是人体不能自身合成的不饱和脂肪酸,可以转化为二十碳五烯酸(EPA)和二十二碳六烯酸(DHA)[13],具有促进脑部发育、增强视觉视力,调节免疫力等[14]功效。然而亚麻籽油稳定性较差,为解决这一问题,郭鑫等[15]以乳清蛋白为乳化剂稳定亚麻籽油乳液,制备的乳液平均粒径为275 nm,乳液稳定,有利于其在食品领域中的应用。为了解决亚麻籽油稳定性差及稻米资源浪费的问题,本论文以米糠蛋白为乳化剂,通过单因素考察,响应面优化米糠蛋白-亚麻籽油乳液的制备工艺,并对乳液进行相关特性研究,为亚麻籽油产品领域研究提供一定参考。
1 材料与方法
1.1 材料与仪器
米糠蛋白(纯度≥97%) 陕西帕尼尔生物科技有限公司;亚麻籽油(不饱和脂肪酸90.8 g/100 g)锡林郭勒盟红井源油脂有限责任公司一级压榨;十二烷基硫酸钠(化学纯)、氢氧化钠(化学纯)、盐酸(化学纯)、异丙醇(分析纯)、甲醇(分析纯)、正丁醇(分析纯)、七水合硫酸亚铁(分析纯) 国药集团化学试剂有限公司;三氯乙酸(化学纯)、硫酸氢氨(化学纯)、1,1,3,3-四乙氧基丙烷(化学纯)、2-硫代巴比妥酸(化学纯)、异辛烷(分析纯) 上海阿拉丁试剂有限公司;氯化钠(分析纯) 广州市金华大化学试剂有限公司;氯化钡(分析纯) 上海松江泗联化工厂。
FE2 实验室pH计梅特勒-托利多仪器(上海)有限公司;T-18DS25 高速剪切仪 德国IKA 有限公司;BCD-287F 冰箱 海尔电器中国有限公司;UV5500PC 紫外分光光度计 上海远析仪器有限公司;ZEN3600 马尔文激光纳米粒径电位分析仪 上海百吉仪器系统有限公司;NDJ-8S 粘度计 上海衡平仪器仪表厂;FS-750T 超声破碎仪 上海生析超生有限公司;GZX-9140MBE 电热鼓风干燥箱 上海博迅实业有限公司;BX53F 奥林巴斯倒置显微镜上海通灏光电科技有限公司。
1.2 实验方法
1.2.1 单因素实验 在预实验确定亚麻籽油乳液油水比1:7 的条件下,采用单因素筛选法考察乳化剂米糠蛋白添加量、剪切转速、超声功率对乳液粒径大小的影响。
米糠蛋白添加量对亚麻籽油乳液粒径大小的影响:在室温条件下,用去离子水配制质量分数分别为0.25%、0.5%、0.75%、1%、1.25%的米糠蛋白溶液,此为乳液的连续相。向连续相中加入亚麻籽油,在剪切转速为8000 r/min 条件下剪切2 min,然后在超声功率为300 W 条件下超声6 min 制得亚麻籽油乳液。
剪切转速对亚麻籽油乳液粒径大小的影响:在室温条件下,以米糠蛋白为乳化剂,将其均匀分散于适量去离子水中,制成0.5%的米糠蛋白水溶液,此为乳液的连续相。向连续相中加入亚麻籽油,分别在6000、8000、10000、12000、14000 r/min 的条件下剪切2 min,然后在超声功率为300 W 条件下超声6 min 制得亚麻籽油乳液。
超声功率对亚麻籽油乳液粒径大小的影响:在室温条件下,以米糠蛋白为乳化剂,将其均匀分散于适量去离子水中,制成0.5%的米糠蛋白水溶液,此为乳液的连续相。向连续相中加入亚麻籽油,在剪切转速为8000 r/min 条件下剪切2 min,然后分别在200、250、300、350、400 W 的超声功率条件下超声6 min 制得亚麻籽油乳液。
1.2.2 响应面法优化试验 在单因素实验基础上,选取米糠蛋白添加量、剪切转速以及超声功率为考察因素,以亚麻籽油乳液的平均粒径(Y)为响应值,利用Design expert 8.05b 软件进行3 因素3 水平响应面试验设计,见表1。

表1 响应面试验因素与水平设计Table 1 Test factors and level design of response surface methodology
1.2.3 亚麻籽油乳液特性研究 在响应面试验的基础上,采用最优条件制备亚麻籽油乳液,考察pH、离子强度、温度对亚麻籽油乳液稳定性的影响;并通过乳化活性、乳化稳定性、初级氧化产物、次级氧化产物、乳液流变特性和乳液微观结构的测定,进一步对制备的乳液进行理化特性分析。
1.2.3.1 pH 稳定性 参照冯鑫等[16]的方法,取亚麻籽油乳液10 mL,分别调整pH 为3、5、7、9、11,考察乳液的粒径及电位在不同pH 条件下随贮藏时间变化的情况,分析pH 对乳液影响。
1.2.3.2 离子稳定性 参照冯鑫等[16]的方法并稍加修改,取亚麻籽油乳液10 mL,调整pH 为9,向其中加入NaCl,使得乳液中的钠离子强度分别为0、100、200、300、400、500 mmol/L,考察乳液的粒径及电位在不同钠离子强度条件下随贮藏时间变化的情况,分析钠离子对乳液影响。
1.2.3.3 储藏稳定性 参照冯鑫等[16]的方法并稍加修改,取亚麻籽油乳液各10 mL,调整pH 为9,加入NaCl 使其浓度为100 mmol/L,分别置于4、25 ℃下保存,考察乳液的粒径及电位在此条件下随贮藏时间变化的情况,并观察亚麻籽油乳液的分层情况。
1.2.3.4 乳化活性(EAI)及乳化稳定性(ESI) 参照Sui 等[17]的方法,利用0.1%十二烷基硫酸钠将乳液样品稀释至0.05 mg/mL,在500 nm 波长处测定初始状态的吸光度(A0)和放置30 min 后的吸光度(A30),根据下式计算乳化活性和乳化稳定性:

式中:N 为样品稀释倍数;C 为米糠蛋白质量浓度(g/mL);φ 为油水比。
1.2.3.5 初级氧化产物(POV)含量的测定 参照Kargar 等[18]的方法,以氢过氧化物含量表示亚麻籽油乳液和亚麻籽油的初级氧化产物含量。取200 μL样品加入3 mL 异辛烷-异丙醇混合液(体积比3:1),充分振荡均匀后在5000 r/min 条件下离心,取上层溶液并加入甲醇-正丁醇混合液(体积比2:1)至3 mL,最后加入0.3 g/mL 硫氰酸铵15 μL、0.264 mol/L 氯化钡和0.288 mol/L 硫酸亚铁混合液(体积比1:1)15 μL,室温静置20 min,在500 nm 波长处测定吸光值。
1.2.3.6 次级氧化产物(TBARS)含量的测定 参照Zhao 等[19]的方法,取2 mL 亚麻籽油乳液,加入5%三氯乙酸和0.02 mol/L 硫代巴比妥酸的混合液(体积比1:1)4 mL,充分混匀,95 ℃恒温水浴15 min,快速冷却至室温,12000 r/min 离心20 min 后取上清液,静置20 min,在波长532 nm 处测其吸光度。
1.2.3.7 乳液流变特性的测定 参照Dokic 等[20]的方法,在温度25 ℃,平衡时间30 s,剪切速率1~100 s−1,测定时间60 s 的条件下,通过NDJ-8S 型旋转黏度计测定亚麻籽油乳液的流变行为,以表观黏度为测定指标。
1.2.3.8 乳液微观结构测定 参照张会等[21]的方法,吸取20 μL 亚麻籽油乳液样品于干净载玻片上,轻盖盖玻片,防止液滴破裂,并确保内部无气泡,用BX53F型倒置光学显微镜在10 倍目镜、40 倍物镜条件下观察乳液液滴形状。利用仪器自带软件获得乳液显微结构图像。
1.3 数据处理
采用Excel 2019、SPSS 22、Design-Expert v8 对数据进行统计及处理,用Origin 2017 绘制图,图表中误差均为标准误差,所有试验均进行3 次重复。
2 结果与分析
2.1 单因素实验结果
2.1.1 米糠蛋白添加量对乳液粒径的影响 已有研究表明,粒径越小的乳液稳定性越好[22]。米糠蛋白添加量对粒径影响结果见图1,随着米糠蛋白添加量的增加,乳液粒径先降低后增加;当其添加量为0.5%时,乳液粒径最小,为291.6 nm。这可能是随着乳化剂用量的增加,表面张力逐渐下降[23],亚麻籽油乳液的乳化的程度不断增大,乳化效果好,制得的乳液粒径小,而随着米糠蛋白用量的进一步增加,乳液液滴的表面电荷不足以克服蛋白质分子间的相互作用,进而导致乳液絮凝现象发生[24],导致粒径增大。因此,选用0.5%米糠蛋白添加量进行下一步的试验。
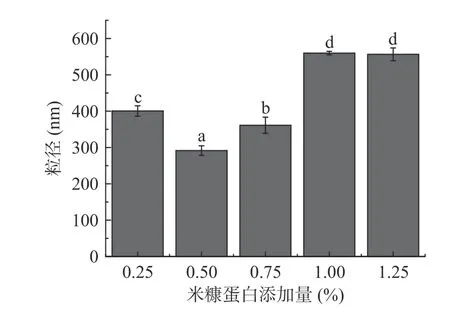
图1 米糠蛋白添加量对亚麻籽油乳液粒径的影响Fig.1 Effect of rice bran protein addition on particle size of flaxseed oil emulsion
2.1.2 剪切转速对乳液粒径的影响 剪切转速对乳液粒径影响结果如图2 所示,随着剪切转速的增大,粒径先减小后增大,在剪切转速为8000 r/min 时,粒径最小,达到310.4 nm。造成粒径变化的原因可能是较低的搅拌速度不能使油相完全分散在水相中,而搅拌转度过快,会使乳液剪切力过大,将机械能转换成热能传递给乳液,造成乳液温度上升,进而破坏分子间的作用力和界面膜的稳定性,还会使得油滴运动加快,造成碰撞凝聚结成大颗粒导致粒径增大[25]。为了保证亚麻籽油能够得到充分乳化又不消耗过多的机械能,故选择剪切转速为8000 r/min 进行下一步的试验。
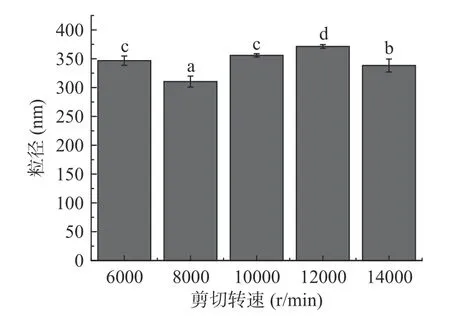
图2 剪切转速对亚麻籽油乳液粒径的影响Fig.2 Effect of rotational speed on particle size of flaxseed oil emulsion
2.1.3 超声功率对乳液粒径的影响 超声功率对乳液粒径影响结果见图3,随着超声功率的增加,乳液粒径先减小后增大,在不同的超声功率下粒径大小差别明显。在300 W 的条件下得到粒径最小,为345.9 nm。造成这一现象的原因可能是超声功率过小不能将高速剪切过后制备的粗乳液进一步乳化为细乳液,而功率太大,导致体系温度上升,进而破坏分子间的作用力和界面稳定性[26],造成粒径升高。因此,选用超声功率300 W 进行下一步的试验。

图3 超声功率对亚麻籽油乳液粒径的影响Fig.3 Effect of ultrasonic power on particle size of flaxseed oil emulsion
2.2 响应面试验结果
2.2.1 回归模型的建立及显著性检验 建立米糠蛋白添加量、剪切转速、超声功率对粒径影响的响应面试验设计,结果见表2,采用Design-expert 软件对实验数据进行回归拟合,得到如下回归方程为:

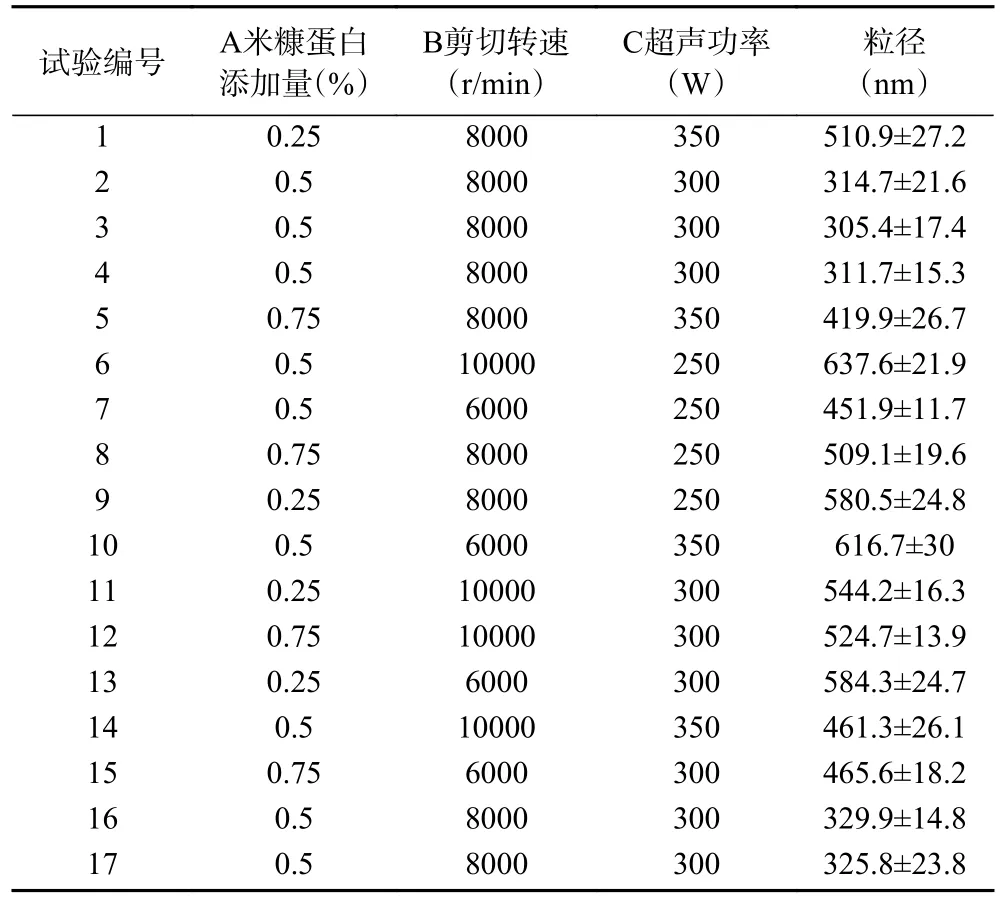
表2 Box-Behnken 试验设计结果Table 2 Design and result of Box-Behnken experience
对响应面实验结果进行方差分析,结果见表3,此模型极其显著(P<0.0001),失拟项F值为2.34,P值为0.2145,不显著(P>0.05),说明回归方程对实际情况来说吻合较好,误差极小,故可用回归方程对响应面试验结果进行分析和预测。模型决定系数R2为0.9095,决定系数为R2Adj为0.9063,说明该回归方程的拟合度及稳定性较好。因此,用此模型对乳液稳定进行优化是合适的。模型回归系数显著性分析显示,一次项A、C 高度显著(P<0.01),交互项BC 和二次项A2、B2、C2极其显著(P<0.0001)。模型中各因素的F值反映了各因素对响应值Y 的影响程度。F值越大,说明此因素对响应面的影响越大。由表3 可知,FA=26.50,FB=6.54,FC=21.43,即三种因素对乳液粒径、稳定性影响程度大小顺序为:A(米糠蛋白添加量)>C(超声功率)>B(剪切转速)。

表3 方差分析结果Table 3 Analysis of variance results
2.2.2 各因素交互作用分析 由图4a 可知,过高或过低的米糠蛋白添加量都不可形成较小粒径的乳液。超声功率保持不变,随着米糠蛋白添加量的增大,乳液粒径先减小后增大,米糠蛋白添加量在0.45%~0.6%范围内时,乳液粒径出现最小值。由图4b 可知,乳液粒径随着剪切转速的增大呈现先减小后增大的趋势,剪切转速的大小直接影响了乳液的乳化程度,适宜的剪切转速大小为7600~8400 r/min。由图4c可知,当米糠蛋白添加量恒定时,随着超声功率的增大,乳液粒径同样呈现出先减小后增大的趋势,且趋势的变化较慢。在超声功率300~350 W 范围内,有利于乳液粒径的减小。此研究结果与单因素结果具有一致性,证明模型是可信的。

图4 各因素交互作用对乳液粒径影响的响应面图Fig.4 Response surface diagram of the interaction of various factors on the particle size of emulsion
2.2.3 优化结果的验证 经Design Expert 软件分析得出亚麻籽油乳液最优的制备条件为:米糠蛋白的添加量为0.56%,超声功率为306.76 W,剪切转速为7929.97 r/min,预测乳液的平均粒径为306.76 nm。结合实际操作可能性,调整工艺参数为:米糠蛋白的添加量为0.56%,超声功率为300 W,剪切转速为7900 r/min,在此条件下验证此模型的可靠性,经3 次平行实验测定乳液的平均粒径为315.14 nm,与软件预测值相对标准偏差为1.9%,表明该响应面能准确预测出该工艺中三个因素对乳液粒径的影响。
2.3 亚麻籽油乳液理化特性
2.3.1 pH 稳定性 有研究表明,不同pH 对蛋白质为乳化剂制备的乳液所带电荷量影响程度不同[27]。本文对优化条件下制备得到的乳液进行理化性质的表征,不同pH 条件下,乳液的粒径、Zeta 电位随时间的变化见图5。从图5 中可以看出随着pH 的增加,乳液的粒径呈先增大后减小的趋势,pH 为7 时乳液粒径最大;当pH 继续增大时,乳液粒径减小,这是由于乳液中液滴表面静电荷量增大,液滴之间的静电斥力增大,促使液滴之间保持平衡而不发生聚集。在pH 为9 时乳液的粒径最小,电位波动幅度最小,证明其稳定性好;在第7 d 时,pH 为5 的乳液电位绝对值最小,这可能是因为蛋白溶液的带电变化情况与蛋白中氨基和羧基之间的电离平衡有关,溶液整体带电性影响乳液的稳定性,在强酸性条件下蛋白质与液滴之间相互排斥作用小,易发生聚集,使Zeta 电位电势下降,进而造成乳液不稳定[28],这一结果与方振兴等[29]研究的pH 对橄榄油Pickering 乳液稳定性影响的趋势一致。除pH 为3 外,乳液的电位绝对值随着pH 增大而增大,可能是米糠蛋白等电点位于pH4.1,随着pH 上升,乳液中蛋白质所带电荷量增大,提供了相对较强的电荷排斥作用,使得液滴不易聚集,乳液较为稳定。

图5 不同pH(3~11)对亚麻籽油乳液稳定性(粒径和乳液电位)的影响Fig.5 Influence of pH (3~11) on the stability of flaxseed oil emulsion (particle size and emulsion potential)
2.3.2 离子稳定性 本文中Na+对乳液的影响情况如图6 所示。低浓度的Na+可以降低蛋白溶解度但不会聚集,这有助于提高乳液的稳定性。随着Na+浓度增大,乳液粒径增大,这可能是因为离子通过静电作用屏蔽了蛋白质的表面电荷,促进了乳液液滴的聚集,不利于蛋白质在油滴表面的吸附及重排,从而导致乳液粒径增加[30]。在前期实验中,作者已测得米糠蛋白等电点为4.1。从图6 中可以看出随着离子浓度越大,Zeta 电位的绝对值随着时间延长波动越大,这种现象可能是因为在pH 为9 条件下制备的亚麻籽油乳液中含有带正电Na+会与带负电荷蛋白结合,使油滴表面负电荷减少;另一种原因可能是随着离子浓度增大,被中和电荷增多,减小了静电作用,导致电荷数下降,最终造成乳液的稳定性下降[31]。本文在100 mmol Na+条件下制备的乳液粒径变化最小,电位波动较小。在此条件下的乳液与张小影等[32]研究盐离子对大豆-乳清混合蛋白乳液相比,粒径降低了13.83%,证明米糠蛋白制备的乳液稳定性更加优异。
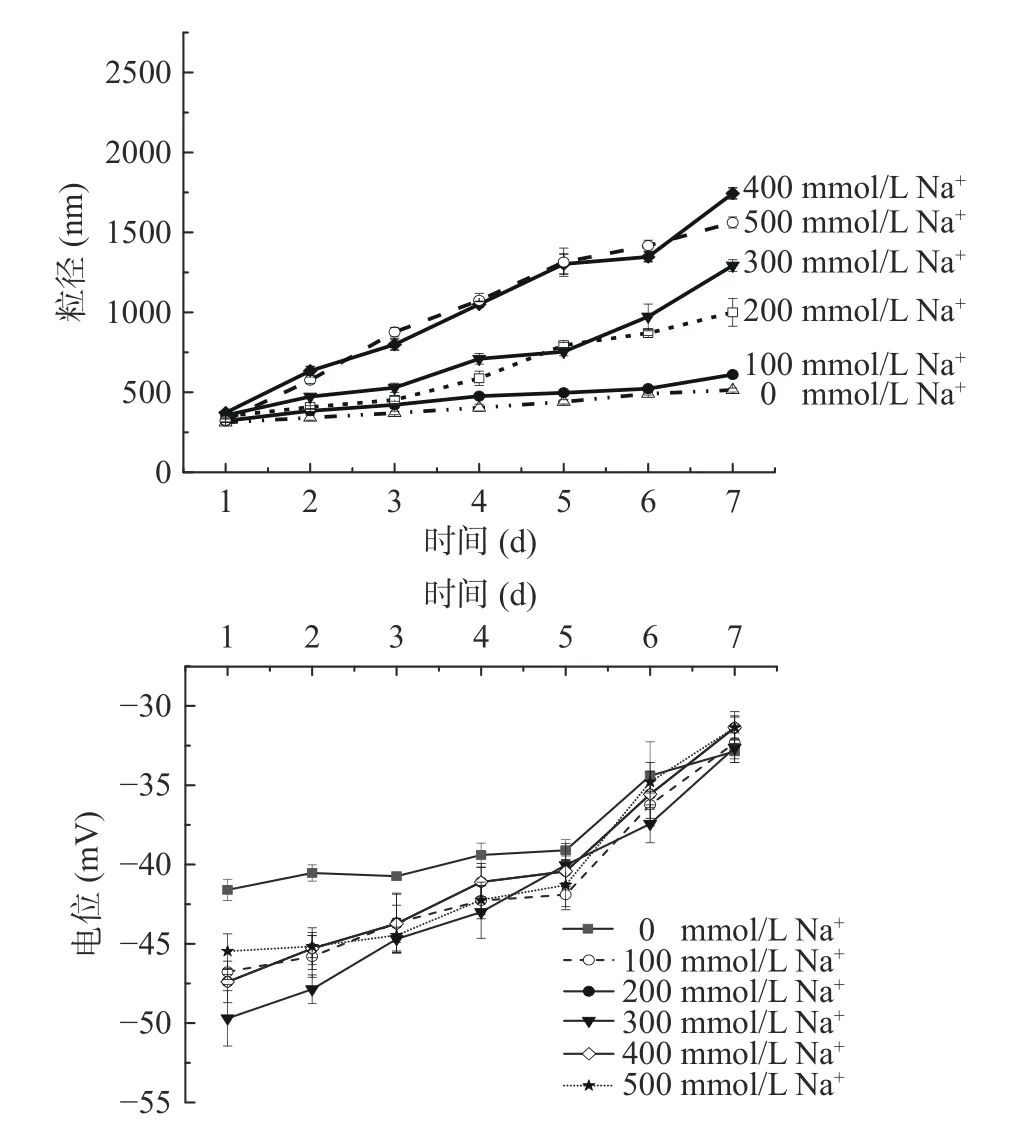
图6 不同Na+浓度(0~500 mmol/L)对亚麻籽油乳液稳定性(粒径和乳液电位)的影响Fig.6 Influence of different Na+ concentrations (0~500 mmol/L)on the stability of flaxseed oil emulsion (particle size and emulsion potential)
2.3.3 冷藏稳定性 通过观察乳液分层情况判断乳液储藏稳定性,如果乳液不分层,不出现乳析现象,则证明稳定性良好,若伴有溢油现象,则乳液稳定性不佳[33]。由图7 可知,在4 ℃冷藏条件下,随着储藏时间的延长,乳液粒径逐渐增大;图8 可以看出乳液在55 d 内具有良好的稳定性,从第60 d 开始乳液开始有分层的趋势,并伴有溢油现象的发生,出现这种现象的原因可能在于随着储藏时间的延长,蛋白质分子不足以维持油水界面平衡,由于重力作用开始有溢油现象的发生,重力分离是食品乳液中常见的不稳定形式之一,油滴在重力因素影响下,移动更快而更易发生相互碰撞,导致乳液粒径增大[34],进而使其产生了分层现象。静电斥力的降低以及聚并作用力增强,使得油滴间相互吸引而发生聚集,乳液Zeta 电位电势下降,促使乳液的稳定性降低[35]。
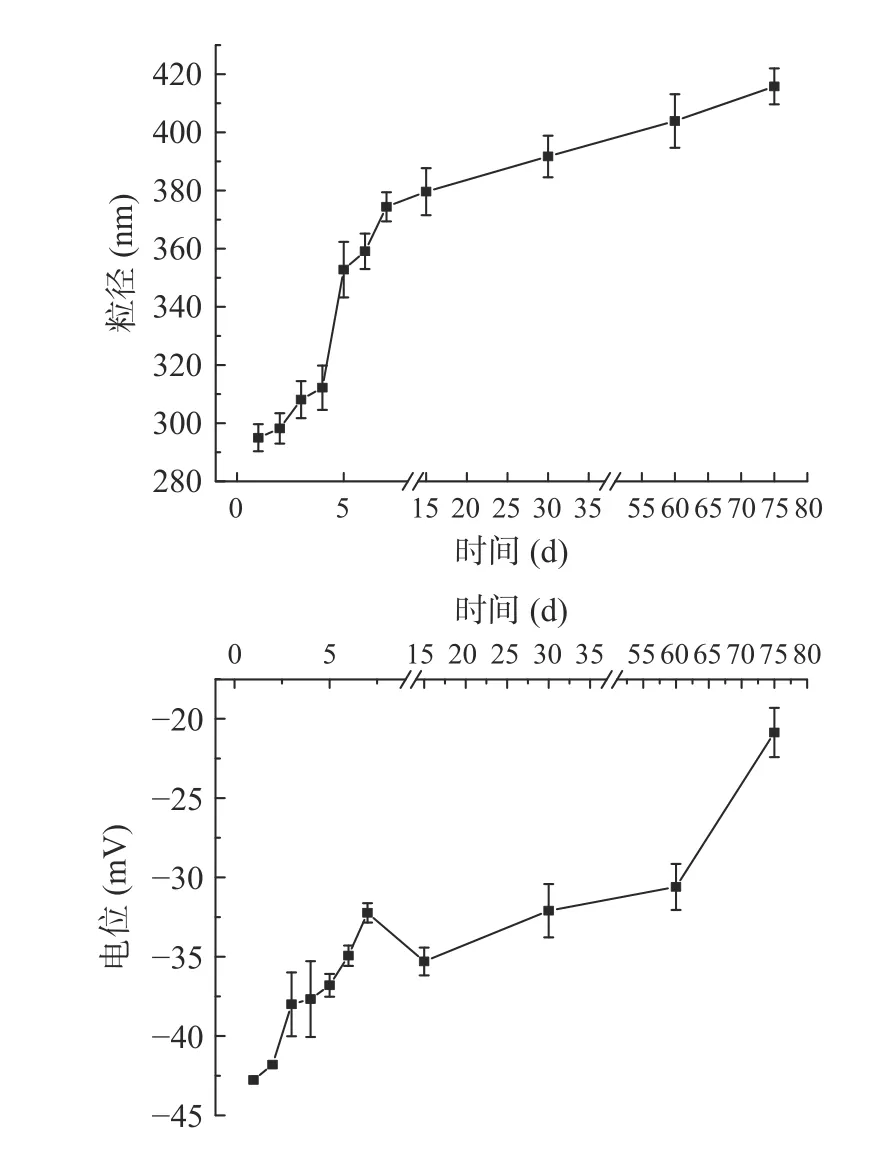
图7 4 ℃条件下亚麻籽油乳液的稳定性Fig.7 Stability of flaxseed oil emulsion at 4 ℃

图8 4 ℃条件亚麻籽油乳液分层情况Fig.8 Stratification of flaxseed oil emulsion at 4 ℃
2.3.4 室温贮藏稳定性 将新制备的亚麻籽油乳液置于室温下储存,其粒径和电位的变化见图9,从图中可以看出随着储存时间的延长,粒径呈先缓慢增加后快速增加的趋势,前期粒径增长缓慢的原因可能是亚麻籽油被包裹在液滴内,大大降低了分子运动性[36]。从图10 可以看出,在10 d 内,乳液具有良好的稳定性,第15 d 时,乳液出现分层的现象,第20 d 时乳液的水层高度增加并变清晰,分层明显。造成此现象的原因可能是随着时间的延长,蛋白质不足以维持油水的界面能,降低了界面的静电作用力;另一种原因可能是重力作用和粒子的布朗运动也导致了乳液的聚结,从而导致乳液的水层厚度与乳液总高度的比值均升高[37]。随着存储时间的延长,油水界面不再平衡,静电作用减小,Zeta 电位绝对值逐渐降低,进而发生了乳析现象。

图9 25 ℃条件下亚麻籽油乳液的稳定性Fig.9 Stability of flaxseed oil emulsion at 25 ℃

图10 25 ℃条件亚麻籽油乳液分层情况Fig.10 Stratification of flaxseed oil emulsion at 25 ℃
2.3.5 乳化活性(EAI)和乳化稳定性(ESI)分析 乳液的乳化活性和乳化稳定性是反映乳液特性的重要指标。乳化活性越高,表明蛋白质越能够抑制油滴的聚集,从而形成稳定的乳液[38]。乳化稳定性则表明乳液保持稳定的性能,数值越大,性能越好。如图11所示,在最优条件下制备的亚麻籽油乳液具有良好的乳化活性和乳化稳定性。常慧敏等[39]研究米糠蛋白-大豆油O/W 型纳米乳液,测定的乳化活性为19.97 m2/g,乳化稳定性168 min,均低于本文亚麻籽油乳液的乳化特性。本文乳液乳化活性更加优越的原因可能是适量的米糠蛋白在形成乳液过程中,蛋白质结构部分折叠从而暴露出更多疏水基团包裹在油滴周围防止其聚集,乳液形成了稳定的油-水界面膜[40],使得乳液具有良好的乳化活性;有研究表明[41],当蛋白质的pH 偏离等电点时溶解性会增大,所带电荷增加,蛋白分子柔性和分散性更好,使得乳液的乳化稳定性得以提高。此外Perazzo 等[42]已证实乳化活性与乳化稳定性是密切相关的,乳化活性越高,意味着乳化剂能形成更大的乳化界面,有助于减小油脂析出现象的发生,增加了乳化稳定性[43]。这可能是亚麻籽油乳液乳化稳定性更加优越的原因。

图11 亚麻籽油乳液乳化活性和乳化稳定性Fig.11 Emulsifying activity and stability of flaxseed oil emulsion
2.3.6 初级氧化产物(POV)含量的测定 乳液中油脂的酸败是影响乳液品质的重要因素,如图12 所示,随着氧化时间的延长,POV 的含量也随之增大。在亚麻籽油氧化初期,氢过氧化物逐渐形成,过氧化值逐渐升高,这是致使乳液品质下降的重要因素。与亚麻籽油相比,亚麻籽油乳液在储存过程中的POV值较低,在第7 d 时,POV 值降低了0.026 mmoL/L,表明米糠蛋白对乳液中油脂氢过氧化物的形成有很好的抑制作用,这与易建华等[44]研究大豆分离蛋白对乳液初级氧化产物影响效果一致。可见,米糠蛋白稳定的亚麻籽油乳液在初级氧化过程中更加稳定。
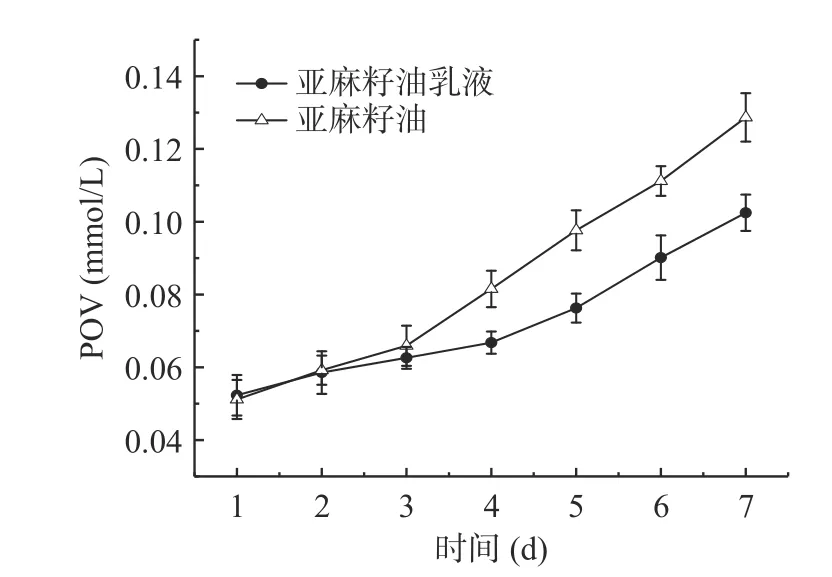
图12 亚麻籽油乳液初级氧化产物Fig.12 Primary oxidation products of flaxseed oil emulsion
2.3.7 次级氧化产物(TBARS)含量的测定 次级氧化是初级氧化产物进一步分解为醛、酸、醇等小分子产物的过程。由图13 可知,乳液次级氧化产物含量随着时间延长,呈先快速上升后缓慢上升趋势。在第2 d时亚麻籽油次级氧化产物数值增大速率明显,相比之下亚麻籽油乳液数值变化较小,这可能是乳液中亚麻籽油被均匀分散在水相中,能有效阻隔亚麻籽油与空气中氧气直接接触,所以乳液氧化速度降低[45]。从第2 d 开始,乳液TBARS 数值均低于亚麻籽油,同初级氧化产物有相同变化趋势,在第7 d 时其数值降低了0.031 mg/kg,这可能是因为乳液中的蛋白质吸附在油滴表面后形成一层黏弹性蛋白膜,蛋白膜可以有效阻止脂质氧化的引发剂扩散到油滴内部,从而起到抑制油脂氧化的作用[46]。Ries 等[47]的研究也表明,蛋白稳定的乳液在贮藏过程中能抑制脂质过氧化物和挥发性脂质氧化产物的生成,与本文的试验结果一致。

图13 亚麻籽油乳液次级氧化产物Fig.13 Secondary oxidation products of flaxseed oil emulsion
2.3.8 乳液流变特性的测定 如图14 所示,亚麻籽油乳液的黏度随着剪切速率增大而降低,表现出典型的剪切稀释现象,符合非牛顿流体特性[48]。造成黏度变化的原因可能是随着剪切速率的增加,乳液的内部结构被破坏,油水界面的相互作用力和范德华力减弱,使蛋白亚基之间的二硫键发生断裂,蛋白质的三级结构部分展开,改变了蛋白质紧密的三维结构,增大了流体的流动性,进而使得表观黏度降低[49]。

图14 亚麻籽油乳液流变特性Fig.14 Rheological properties of flaxseed oil emulsion
2.3.9 乳液微观结构的测定 如图15 所示,亚麻籽油乳液在光学显微镜放大400 倍条件下可观察到存在球形油滴分布的情况,大小分布略不统一,尺寸在几百纳米到1 μm 之间。出现大部分油滴尺寸较小的原因可能是大部分蛋白分子的疏水部分可以更多的探入到油滴内部,在剪切乳化过程中,只需要少量的蛋白分子即可稳定乳液,因此形成的油滴尺寸会更小[50−51];少部分蛋白分子与油滴接触时接触面积较小,只能达到瞬时稳定的效果,一段时间后,油滴与油滴之间发生絮凝进而导致尺寸变大[52]。

图15 亚麻籽油乳液光学显微镜图像Fig.15 Optical microscope image of flaxseed oil emulsion
3 结论
以亚麻籽油为油相,米糠蛋白为乳化剂,采用高速剪切法制备(O/W 型)乳液。通过单因素实验、响应面试验对制备工艺进行优化,随后对制备的乳液进行稳定性及理化特性测定,结果表明最佳制备工艺:米糠蛋白添加量0.56%、剪切转速7900 r/min、超声功率300 W,在此条件下制得的亚麻籽油乳液的平均粒径为315.14 nm。对其稳定性评价表明:乳液在4 ℃冷藏储存55 d 内和25 ℃室温储存10 d 内均呈现出良好的稳定特性,乳化活性及稳定性的测定也证实了乳液具有抑制油滴聚集、保持稳定的特性,氧化产物的测定证明其具有一定的抑制氧化能力。本文以米糠蛋白为乳化剂制备亚麻籽油乳液的研究提高了米糠蛋白的利用价值,减少了资源的浪费,为稻米加工副产物的应用提供新思路;为亚麻籽油产品在食品领域的推广提供一定的理论参考;为新型功能性饮品的开发提供了科学支撑。

