佩兰黄酮的纯化及其抗氧化与抗运动疲劳作用
胡 华
(成都文理学院体育与医护学院,四川成都 610401)
社会发展节奏的加快,使得人们尝试各种运动以舒缓身心,但过度的运动量易使身体出现运动性疲劳,影响正常的生活与工作。有研究显示,运动性疲劳的产生与体内自由基的增多有关[1−2],若机体补充抗氧化剂,使其与内源性自由基相互作用,能有效减轻氧化损伤,预防运动性疲劳[3−4]。近年来,部分抗氧化性较好的天然物质,如:多糖、黄酮、多酚、生物碱、肽类、氨基酸等,已被发现具有良好的抗运动疲劳效果[5−7],而目前关于佩兰的抗运动效果的相关研究还较少。
佩兰(Eupatorium fortuneiTurcz.)是菊科植物佩兰的干燥地上部分,具有醒脾开胃、发表解暑等功效,分布于南方各省,已被卫健委认定为保健食品的添加成分,属于药食两用植物,生物安全性较好,其化学成分主要为挥发油、黄酮、多糖、生物碱及其它酚酸类化合物等[8−9],目前,对其挥发油的活性研究较多,而对其黄酮类化合物的研究较少。许冰[10]研究发现,佩兰黄酮化合物的结构类型主要以黄酮类为主,如:芦丁、槲皮素等,存在较多的酚羟基,而该类化合物通常具有较好的抗氧化作用,但因其提取物的杂质较多,可能影响相关活性作用。因此,本研究利用大孔树脂具有机械筛分与分离纯化的特性,探讨其纯化佩兰黄酮提取物的最佳条件,比较纯化前、后产物的抗氧化能力,同时通过动物实验考察其抗运动疲劳活性,以期为佩兰黄酮的深入开发与利用提供参考。
1 材料与方法
1.1 材料与仪器
佩兰 成都市天泰药房,经鉴定为菊科植物佩兰的茎;芦丁标准品 中国食品药品检定研究院(批号:100080-201811);西洋参颗粒 汤臣倍健股份有限公司;D101 型大孔树脂 天津波鸿树脂科技有限公司;抗坏血酸、邻苯三酚、三羟基氨基甲烷(Tris)、硫酸亚铁等 均为分析纯,国药集团化学试剂有限公司;乳酸(lactic acid,LA)、血清尿素氮(blood urea nitrogen,BUN)、丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶试剂盒(glutathione peroxidase,GSH-Px) 南京建城科技有限公司;试验用水为纯化水。实验动物:SPF 级健康雄性小鼠80 只,体质量19~26 g 成都药康生物科技有限公司[动物使用许可证号:SYXK(川)2020-230]。
KJ-14B06 型破壁机 深圳市康佳电器有限公司;ME203 型电子天平 梅特勒-托利多有限公司;L5 型紫外-可见分光光度计 上海精密科学仪器有限公司;RE-3000A 型旋转蒸发仪 上海越众仪器设备有限公司;DHZ-C 型恒温振荡器 苏州培英实验设备有限公司;SJIA-12N-50B 型立式冷冻干燥机宁波双嘉仪器有限公司;H3-18KR 型离心机 湖南可成仪器设备有限公司;JA-500 型超声波清洗器济宁奥超电子设备有限公司。
1.2 实验方法
1.2.1 佩兰黄酮提取 佩兰经完全干燥后粉碎,过80 目筛,准确称取2.0 g 粉碎后样品置于60 mL 体积分数为70%乙醇溶液中,在50 kHz 超声功率下提取30 min,重复提取4 次后,合并提取液离心,上清液经减压蒸发溶剂浓缩后,冷冻干燥即得佩兰黄酮粗提物[11]。
1.2.2 动态吸附与洗脱
1.2.2.1 吸附条件考察 根据预实验结果,固定上样液pH4.0、上样流速1.0 mL/min,分别考察60 mL 不同质量浓度的上样液(1.0、2.0、3.0、4.0、5.0 mg/mL)在装有预处理后树脂的玻璃层析柱(2.6 cm×25 cm)的吸附率;固定上样液浓度3.0 mg/mL,上样流速1.0 mL/min,以盐酸或氢氧化钠调节溶液pH,分别考察60 mL 不同pH 上样液(2.0、3.0、4.0、5.0、6.0)的吸附率;不同体积的3.0 mg/mL 上样液(pH4.0)分别于0.5、1.0、2.0 mL/min 流速上样后,测定泄漏液中黄酮含量,绘制泄露曲线,确定最佳上样液体积与流速。

式中:m0为上样液中的黄酮质量,mg;me为吸附后流出液中的黄酮质量,mg;η 为吸附率,%。
1.2.2.2 洗脱条件考察 根据预实验结果,上样完成后,经50 mL 水洗后,采用100 mL 不同体积分数(50%、60%、70%、80%、90%)乙醇溶液于2.0 mL/min 流速对最佳吸附条件上样后的树脂柱进行洗脱,收集洗脱液,测定其黄酮含量,计算不同体积分数乙醇的洗脱率,考察洗脱液乙醇的最佳体积分数;采用体积分数为70%乙醇溶液分别于1.0、2.0、3.0 mL/min 流速洗脱饱和吸附后的树脂柱,测定不同体积下洗脱液中黄酮含量,绘制洗脱曲线,确定最佳洗脱液体积与流速。

式中:m0为上样液中的黄酮质量,mg;me为饱和吸附后溶液中的黄酮质量,mg;cd为洗脱液中黄酮浓度,mg/mL;V2为洗脱液体积,mL;Dd为洗脱率,%。
1.2.3 黄酮纯度测定 以芦丁作为对照品,采用亚硝酸钠-硝酸铝-氢氧化钠法测定样品的黄酮含量[12],横坐标为不同质量浓度的芦丁溶液,纵坐标为相应溶液的吸光度值,得到标准曲线方程为:y=15.22x+0.014(R2=0.9998),可知在0.005~0.05 mg/L 的浓度范围内线性关系良好。将样品溶液稀释后,采用上述分析方法测定其黄酮浓度后,根据下式计算样品的黄酮纯度(以芦丁计)。

式中:c 为样品中的黄酮浓度,mg/mL;V 为样品体积,mL;D 为稀释倍数;m 为样品的质量,mg;W 为样品中黄酮纯度,%。
1.2.4 抗氧化试验
1.2.4.1 羟基自由基(∙OH)清除能力的测定 两支试管内均加入10 mmol/L 硫酸亚铁溶液1 mL 和10 mmol/L水杨酸-乙醇溶液1 mL,分别继续加入1 mL 黄酮纯化物溶液和VC溶液(阳性对照)后,各加入8.8 mmol/L双氧水1 mL,置于37 ℃水浴中30 min 后,于510 nm测定吸光度(As),另以纯化水作空白对照(A0),按式(4)计算黄酮纯化产物对羟基自由基的清除率,提取物溶液考察同上操作[13]。

1.2.4.2 超氧阴离子自由基(O2−∙)清除能力的测定两支试管内均加入50 mmol/L Tris-HCl 溶液(pH8.2)5 mL 和5 mL 纯化水,置于25 ℃水浴25 min,各加入1 mL 黄酮纯化物溶液和VC溶液(阳性对照),分别加入25 mmol/L 领苯三酚0.5 mL,混匀后继续置于25 ℃水浴5 min 后,各添加8 mmol/L HCl 溶液1 mL 于510 nm 测定吸光度(As),另以纯化水作空白对照(A0),按式(4)计算黄酮纯化产物对超氧阴离子自由基的清除率,提取物溶液考察同上操作[14]。
1.2.5 动物实验
1.2.5.1 实验准备 80 只小鼠经适应性喂养5 d 后,随机平均分为空白对照组、阳性对照组、提取组和纯化组。按照《保健食品功能评价要求》并结合相关文献研究方法[15−16],动物设置剂量应不超过人体推荐量30 倍,根据预实验结果,各组给药剂量采用最低有效量的30 倍,其中,阳性对照组给予0.3 mg/g(以体重计,下同)的西洋参颗粒;而提取物组和纯化物组分别给予0.3 mg/g 佩兰黄酮提取物与纯化物,所有灌胃溶液体积2 mL,空白对照组则灌胃等体积生理盐水。所有给药通过灌胃方式,每天1 次,连续30 d。
1.2.5.2 爬杆实验 末次灌胃结束后,各组随机选取10 只小鼠置于玻璃棒上,记录其肌肉紧张抱紧爬杆至跌落的时间,反复实验3 次后,将其累计时间记为爬杆时间[17]。
1.2.5.3 LA、BUN、MDA 浓度与SOD、GSH-Px 活力测定 各组其它小鼠置于水中游泳30 min 取出,休息10 min 后,采血离心,通过试剂盒检测血清中LA 与BUN 浓度,另切取肝脏,按照相关试剂盒使用说明检测MDA 浓度与SOD、GSH-Px 活力。
1.3 数据处理
所有试验平行测定5 次,结果表示采用平均值±标准差,通过SPSS 19.0 软件进行单因素方差(ANOVA)分析,比较组间差异,P<0.05 认为具有显著性差异,P<0.01 认为具有极显著性差异。
2 结果与分析
2.1 动态吸附纯化条件
2.1.1 上样液浓度选择 不同上样液浓度对D101大孔树脂吸附佩兰黄酮的影响,如图1 所示,随着上样液浓度的增大,树脂对黄酮化合物的吸附率不断减小,其中,当上样液质量浓度大于3.0 mg/L 时,吸附率开始急剧下降。上样液浓度过高,样品溶液中其它杂质可能与目标物竞争吸附,可使树脂提前饱和吸附,从而造成部分佩兰黄酮化合物的泄漏,降低吸附效率[18],因此确定最佳上样液浓度为3.0 mg/L。

图1 上样液浓度对佩兰黄酮的吸附率影响Fig.1 Effect of different loading solution concentration on adsorption rate of Eupatorium fortunei Turcz.flavonoids
2.1.2 上样液pH 选择 不同上样液pH 对D101 大孔树脂吸附佩兰黄酮的影响,如图2 所示。从图2可知,树脂对黄酮化合物的吸附随上样液pH 增大而先增大再减小,当溶液pH 为4.0 时,吸附率达到最大。由于佩兰黄酮化合物结构的基本母核为2-苯基色原酮,存在较多的酚羟基与羰基,因而在弱酸性环境下,易呈分子形态与树脂中吸附位点相互作用,致使吸附率升高[19],因此确定最佳上样液pH 为4.0。

图2 上样液pH 对佩兰黄酮的吸附率影响Fig.2 Effect of different pH value of loading solution on adsorption rate of Eupatorium fortunei Turcz.flavonoids
2.1.3 泄漏曲线 当吸附一段时间后,流出液中黄酮化合物的含量约为上样液浓度10%时,认为黄酮开始泄漏,绘制不同流速下D101 大孔树脂的泄露曲线,结果见图3。从图3 可知,当上样流速逐渐增大,泄漏点对应的上样液体积从约80 mL 减小至40 mL。可能由于大孔树脂对黄酮化合物的吸附存在膜扩散与粒扩散过程,若流速过快,佩兰黄酮尚未与树脂充分相互作用,但上样流速过慢,使得纯化时间较长,不利于推广应用,综合考虑吸附效率与纯化效果,选择最佳上样流速为1.0 mL/min,上样液体积为60 mL。

图3 不同流速下大孔树脂的吸附泄漏曲线Fig.3 Adsorption leakage curve of the macroporous resin in different flow rate
2.2 动态洗脱纯化条件
2.2.1 洗脱液体积分数选择 采用一定体积分数的乙醇溶液作为洗脱液,考察不同体积分数的乙醇溶液对佩兰黄酮化合物的洗脱率影响,结果见图4。从图4 可知,随着乙醇体积分数的增大,黄酮化合物的洗脱率逐渐上升,当增大至70%后,开始出现下降。这是由于乙醇的体积分数越高,其对弱极性的黄酮化合物洗脱能力越强,但体积分数过高,吸附在树脂中醇溶性杂质也可能被洗脱,造成“竞争解吸”[20],导致洗脱率下降,因此选择乙醇溶液体积分数为70%。
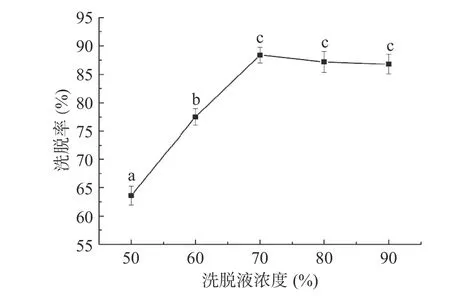
图4 不同体积分数的乙醇溶液对洗脱率的影响Fig.4 Effect of different ethyl alcohol concentration on elution rate
2.2.2 洗脱曲线 在不同流速下,采用体积分数70%乙醇溶液洗脱饱和吸附后的D101 大孔树脂,收集洗脱液,测定黄酮化合物含量,绘制洗脱曲线,如图5 所示。随着洗脱流速的增大,峰形逐渐变宽,且完全洗脱黄酮化合物的乙醇用量增多,而洗脱流速偏低洗脱曲线峰形尖锐且对称,因此选择最佳洗脱流速为1.0mL/min,洗脱液体积100 mL。
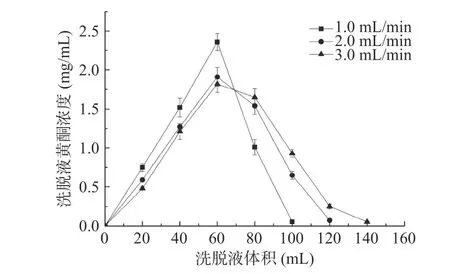
图5 不同流速下大孔树脂的洗脱曲线Fig.5 Elution curve of the macroporous resin at different flow rate
2.3 最佳纯化工艺验证
综合上述结果,确定D101 大孔树脂纯化佩兰黄酮化合物的最佳条件:上样浓度与流速分别为3.0 mg/L和1.0 mL/min,上样液pH 与体积分别为4.0 与60 mL,洗脱液体积分数与体积分别为70%与100 mL,洗脱流速为1.0 mL/min。在该最佳纯化条件下,佩兰黄酮化合物在产物中纯度由24.2%增大至69.4%,约提高了2.87 倍,韩秋菊等[21]曾采用D101 大孔树脂纯化藁本黄酮,纯度约为纯化前2.05 倍;李倩[22]则采用D101 大孔树脂纯化新疆圆柏黄酮,纯度约为纯化前2.79 倍,表明采用D101 大孔树脂纯化佩兰黄酮工艺可行。
2.4 纯化前后产物的抗氧化作用
2.4.1 ∙OH 清除率的比较 ∙OH 化学性质活泼,可与体内多数细胞相互作用,致使发生脂质过氧化、核酸断裂、蛋白质与多糖解聚等不良反应[23]。以VC作阳性对照,考察不同浓度的佩兰黄酮提取物与纯化物对∙OH 清除率的影响,结果见图6。从图6 可见,佩兰黄酮的提取物与纯化物对∙OH 的清除能力均随浓度的提高而增大,佩兰黄酮纯化物的半抑制质量浓度(IC50)为0.47 mg/mL 低于提取物(0.61 mg/mL),表明纯化工艺有利于提高其清除∙OH 能力,但在相同浓度下其清除∙OH 的作用低于VC。

图6 不同物质对∙OH 的清除能力Fig.6 Scavenging ability of different substances on hydroxyl radical
2.4.2 O2−∙清除率的比较 O2−∙与体内细胞化合物中羟基结合后的产物会破坏细胞的DNA,影响其正常功能。以VC作阳性对照,考察不同浓度的佩兰黄酮提取物与纯化物对O2−∙清除率的影响,结果见图7。从图7 可见,两种物质对O2−∙的清除能力均随浓度的提高而增大,但纯化物的IC50值(0.42 mg/mL)低于提取物0.52 mg/mL,表明纯化后的佩兰黄酮对O2−∙的清除能力更强,但二者的清除作用均低于等浓度VC。

图7 不同物质对O2−∙的清除能力Fig.7 Scavenging ability of different substances on superoxide anion radical
2.5 抗运动性疲劳作用
2.5.1 爬杆时间 小鼠爬杆是全身能量消耗性运动,因此可通过观察不同组别小鼠的爬杆时间,衡量其运动耐力,结果见表1。从表1 可见,与空白对照组相比,提取组与纯化组小鼠的爬杆时间分别平均延长1.2min 和2.4 min,具有显著差异(P<0.05,P<0.01),表明佩兰黄酮有助于缓解机体运动疲劳,延长运动时间,而纯化组小鼠的爬杆时间较提取组延长,具有极显著差异(P<0.01),表明树脂纯化工艺有利于提高佩兰黄酮产物的活性,但二者爬杆时间均低于阳性对照组。

表1 不同组小鼠的爬杆时间 (n=10)Table 1 The climbing time in mice of different groups (n=10)
2.5.2 体内LA 与BUN 浓度 LA 是在机体剧烈运动后,肌肉耗氧加剧体内供氧不足的条件下,血糖经糖酵解生成的产物。体内乳酸含量越高,生理环境pH 下降越快,从而影响骨骼肌的收缩强度,产生疲劳感[24]。从表2 结果可见,与空白对照组相比,提取组与纯化组小鼠的血清中LA 平均浓度分别降低1.17、2.43 mmol/L,具有显著差异(P<0.05,P<0.01),且纯化组小鼠的LA 平均浓度较提取组下降约1.26 mmol/L,具有显著性差异(P<0.05),表明纯化后的佩兰黄酮更有利于延缓体内LA 的生成或加速其代谢,但其LA 浓度仍高于阳性对照组。
BUN 作为剧烈运动后,蛋白质的分解代谢产物,可用于评价机体的疲劳状态。从表2 结果可知,与空白对照组相较,提取组与纯化组小鼠的血清中BUN 平均浓度分别降低0.61、1.34 mmol/L,差异显著(P<0.05,P<0.01),同时纯化组小鼠的BUN 平均浓度较提取组下降约0.73 mmol/L,差异具有统计学意义(P<0.05),表明纯化后的佩兰黄酮更有利于减少体内BUN 的积累,但其BUN 浓度仍高于阳性对照组。

表2 不同组小鼠的LA 与BUN 浓度(n=10)Table 2 The contents of LA and BUN in mice of different groups (n=10)
2.5.3 MDA 浓度与SOD、GSH-Px 活性 运动性疲劳的产生主要源于剧烈运动下,体内产生大量的超氧阴离子自由基,同时血浆脂质过氧化物浓度上升,从而诱导体内蛋白质氧化,生成MDA。MDA 浓度过高导致组织和细胞的氧化损伤,使得体内氧化与抗氧化系统失衡[25]。从表3 可见,与空白对照组相较,提取组与纯化组小鼠的血清中MDA 平均浓度分别降低0.31、0.74 mmol/L,具有显著性差异(P<0.05,P<0.01),而纯化组小鼠MDA 平均浓度较提取组下降约0.43 mmol/L,表明纯化后的佩兰黄酮有助于减小体内氧化程度,避免MDA 的生成,但与阳性对照组相较,仍明显偏高。
SOD 与GSH-Px 是重要的抗氧化酶,其中SOD可与超氧阴离子自由基发生歧化反应生成过氧化氢和氧气,而GSH-Px 可将过氧化氢或其它有机过氧化物还原成水和醇,从而减缓体内脂质过氧化反应,实现阻断自由基的的氧化破坏过程[26]。从表3 可知,与空白对照组相较,提取组小鼠的SOD 与GSHPx 平均活力分别提高22.27、24.64 U/mL,具有显著性差异(P<0.05);而纯化组小鼠的SOD 与GSHPx 平均活力分别提高42.21、54.45 U/mL,具有极显著性差异(P<0.01),表明纯化后的佩兰黄酮更有利于增强体内SOD 与GSH-Px 活性,但上述结果均低于阳性对照组。

表3 不同组小鼠的MDA 浓度和SOD、GSH-Px活性(n=10)Table 3 MDA content and SOD,GSH-Px activity in mice of different groups (n=10)
3 结论
本研究考察D101 大孔树脂纯化佩兰黄酮的最佳条件,并比较了不同产物的抗氧化与抗运动疲劳活性。试验结果表明,当上样浓度与流速分别为3.0 mg/L和1.0 mL/min,上样液pH 与体积分别为4.0 与60 mL,洗脱液体积分数与体积分别为70%与100 mL,洗脱流速为1.0 mL/min 时,佩兰黄酮化合物在产物中纯度由24.2%增大至69.4%,约为纯化前2.87 倍。佩兰黄酮纯化物对∙OH 与O2−∙的IC50值分别为0.47、0.42 mg/mL 均高于提取物,表明采取大孔树脂纯化工艺有利于提高佩兰黄酮产物的抗氧化能力。纯化后的佩兰黄酮能够延长小鼠的运动时间,减少其体内LA 与BUN 的生成,并有助于增强体内SOD 与GSH-Px 的活力,进而降低MDA 的生成,从而有利于提高动物的运动耐力。但纯化后佩兰黄酮化合物的种类仍有待进一步分离鉴定,以明确其具体抗运动疲劳机制。

