米根霉脂肪酶的改造及其在废弃油脂转化中的应用
罗思曼,胡博洋,胡国帅,赵丽君,柳庆月,杨江科
(武汉轻工大学 生命科学与技术学院,湖北武汉 430023)
随着全球化和工业化的进一步发展,人们对能源的需求日益增加。有限的化石能源储量越来越难以满足日益增长的能源需求,而且传统的化石能源在使用后会带来严重的环境污染问题。为解决能源危机,各国都在积极寻找可再生的替代能源。生物柴油就是以动植物油脂、食用废油等为原料制备而成的可再生的清洁能源物质。与传统的化石能源相比,生物柴油具有原料可再生、生物降解、对环境友好等诸多优点[1-2]。我国自21世纪初大力发展生物柴油以来,已经形成了约200万t/a的产能规模,生产技术达到世界先进水平,是主要的生物柴油出口国[3]。
我国是食用油脂消费大国,年均油脂消耗量居世界首位,且每年都会产生大量的食用废油。食用废油成分复杂,除含有大量的烃类及其衍生物外,还含有重金属、过量的饱合脂肪酸和有毒致癌物等,因此一旦食用废油流向餐桌,将会给广大消费者的健康带来极大的危害。但食用废油也是优质的能源,以食用废油为原料,将其转化为清洁能源特别是生物柴油不仅可以减少柴油燃烧带来的污染,实现健康、环保的生活模式,而且还能因地制宜地解决废油所带来的危害[4]。
目前,应用最为广泛的生物柴油制备方法包括化学法和生物合成法(脂肪酶催化法)。与化学方法相比,脂肪酶替代化学催化剂,具有无污染、低能耗、转化率高等优点,是一种绿色催化剂[5-6]。在脂肪酶催化法中,酶的活性、稳定性及转化条件等对实验转化效率的影响较大[7],特别是直接以液体脂肪酶为催化剂,需要酶具有产量高、抗逆性强、稳定的特点。米根霉脂肪酶(Rhizopus oryzaelipase,ROL)在催化转化上有一定的优势,但要实现工业化应用不仅需要脂肪酶的高效表达,还需要脂肪酶对催化反应环境具有良好的耐受性[8]。
本研究将利用基因工程手段对ROL进行改造,并在毕赤酵母X-33中高效表达,高效地将废弃油脂转化为生物柴油,充分发挥ROL的优势,改善工艺条件。
1 材料与方法
1.1 材料和仪器
载体pPICZα-A、大肠杆菌感受态DH5α、毕赤酵母X-33,均由本实验室保藏;ROL基因,GenBank登录号AF229435;蛋白胨和酵母提取物,英国OXOID公司;DNA胶回收盒、质粒抽提试剂盒(离心柱型),美国0mega公司;DNA Marker、限制性内切酶BamHⅠ和BglⅡ、Protein Marker、博来霉素(Zeocin)及PCR相关试剂,美国Invitrogen公司。
5427 R高速冷冻离心机,德国Eppendorf公司;PRO-96型PCR仪,德国Biometra公司;DYCP-31CN琼脂糖水平电泳仪、DYCZ-24DN双垂直蛋白电泳仪,北京六一生物科技有限公司;YJ-1340型洁净工作台,苏州市苏信净化设备厂;GeneGenius自动凝胶成像系统,英国Syngene公司;7890A气相色谱仪,美国Agilent公司;FM 100制冰机,北京长流科学仪器有限公司。
1.2 实验方法
1.2.1 ROL的分子改造
在ROL原始氨基酸序列上(GenBank登录号:1LGY),通过理性设计改变其中2个位点的氨基酸。将61位上的丝氨酸突变成苏氨酸(S61T),将150位点上的谷氨酸胺突变为亮氨酸(G150L)。采用Aliview软件比较设计前后氨基酸序列的不同,并用作图软件Pymol将突变位点改变前后的状态表示出来。
1.2.2 ROL基因的构建与表达
将改造前后的脂肪酶基因序列克隆到pPICZα-A中,构建重组质粒pPICZα-A -proROL。并用BamHⅠ和BglⅡ两个酶将重组质粒进行双酶切,通过琼脂糖凝胶电泳显示目的基因片段大小,验证是否成功构建重组质粒pPICZα-A-mROL。
将重组质粒pPICZα-A-proROL通过BamHⅠ内切酶单酶切线性化后,电转(1 200 mV,56 ms)入毕赤酵母X-33中,放入28 ℃培养箱孵育2 h后涂布于Zeocin抗性YPD平板上,获得含pro-ROL基因的毕赤酵母重组菌株[9]。含改造后的m-ROL基因的毕赤酵母重组菌株的构建方法同pro-ROL。
1.2.3 摇瓶发酵与诱导表达
挑选原始脂肪酶基因和优化后的重组菌株接种于含Zeocin(70 μL /100 mL)抗性的4 mL YPD培养基中,在28 ℃摇床中培养16 h后,取3 mL到25 mL的BMGY培养基中,从放入28 ℃,180 r/min的摇床开始计算,每1 d加入500 μL 2%的甲醇进行诱导表达,3 d后停止发酵。取离心后的发酵液上清液20 μL,并加入蛋白loading buffer,混合均匀后在100 ℃水浴锅中煮5 min后,进行15%聚丙烯酰胺凝胶电泳分析。实验重复6次,观察结果重现性。
1.2.4 酶学性质测定
在一定条件下,脂肪酶可以水解油脂类,生成脂肪酸、甘油二酯、甘油单酯等物质,可以通过氢氧化钠标椎溶液来滴定生成的脂肪酸,以此来测定生成的脂肪酸的量。基于该反应原理,本文选取碱式滴定法来测定酶活。
取橄榄油乳化液4 mL,pH值7.0的Tris-HCl缓冲液5 mL放入100 mL锥形瓶,先将混合液置于40 ℃水浴锅中预热2 min,再加入离心后的发酵液上清液1 mL,反应过程中通过摇晃锥形瓶来增加溶液之间的接触,以此来提高反应速率。反应10 min后,加入15 mL 95%的酒精终止反应,空白对照组加入终止液后再加入酶液。加入60 μL的酚酞后,用0.4%的氢氧化钠溶液进行滴定,滴至溶液偏红且红色不褪色,停止滴定并记录消耗的氢氧化钠的体积,空白组同样进行滴定。酶活计算公式:
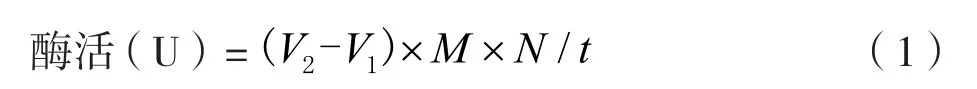
式中:酶活为在40 ℃,pH=7.5的条件下,脂肪酶水解脂肪每分钟产生1 μmoL脂肪酸的酶量;V2为实验组消耗氢氧化钠的体积,mL;V1为空白组消耗氢氧化钠的体积,mL;M为氢氧化钠的浓度,mol/L;N为稀释倍数;t为反应时间,min。
在不改变酶学体系的条件下,改变反应温度(从20 ℃到70 ℃),以此来测定温度对ROL酶活的影响;反应温度40 ℃不变的条件下,改变缓冲液pH值(从5到10),以此来测定pH对ROL酶活的影响。
1.2.5 生物柴油制备
酶促转脂化制备生物柴油,在50 mL具塞锥形瓶中,加入适量的废弃油脂和叔丁醇、甲醇的混合物,放于摇床中,加热至35 ℃后,加入12%的脂肪酶开始反应,每隔2 h取出反应液,用于甲酯含量分析。将所取的100 μL反应液离心分层,取上层液样5 μL,用295 μL正己烷溶解,加入300 μL内标物(十七碳酸甲酯正己烷溶液),混匀,取1 μL样品进样。
生物柴油是脂肪酸甲酯的混合产物,包括硬脂酸甲酯、油酸甲酯、亚油酸甲酯、亚麻酸甲酯等,所以为了确定生物柴油当中各成分的含量以及生物柴油的转换率,采用气相检测器进行物质分离以及定量测定。
1.3 气相检测仪器的参数
气相色谱柱:安捷伦7890A,毛细管柱;载气:氮气;检测器:FID;进样方式:分流;升温程序:初始柱温:200 ℃,10 min后维持每3 min上升2 ℃;进样口温度240 ℃;检测器温度:300 ℃。
2 结果与分析
2.1 ROL的分子设计
由图1A ROL的空间结构知,本研究主要对ROL第61位上的丝氨酸和第150位点上的谷氨酸进行了突变。由图1B(1)和图1B(2)知,当第61位上的丝氨酸(Ser)突变成苏氨酸(Thr)后,丝氨酸与63位上的苏氨酸之间的氢键断裂,与苏氨酸间重新形成更短的氢键。氢键在维持蛋白质空间结构中起着重要的作用,键长变短,键能减小,脂肪酶ROL的空间结构更稳定。由图1B(3)和图1B(4)知,将150位点上的谷氨酸(Glu)突变为亮氨酸(Leu),空间距离变大,作为蛋白质折叠驱动力的疏水作用增强,也增加了其空间结构的稳定性[10]。
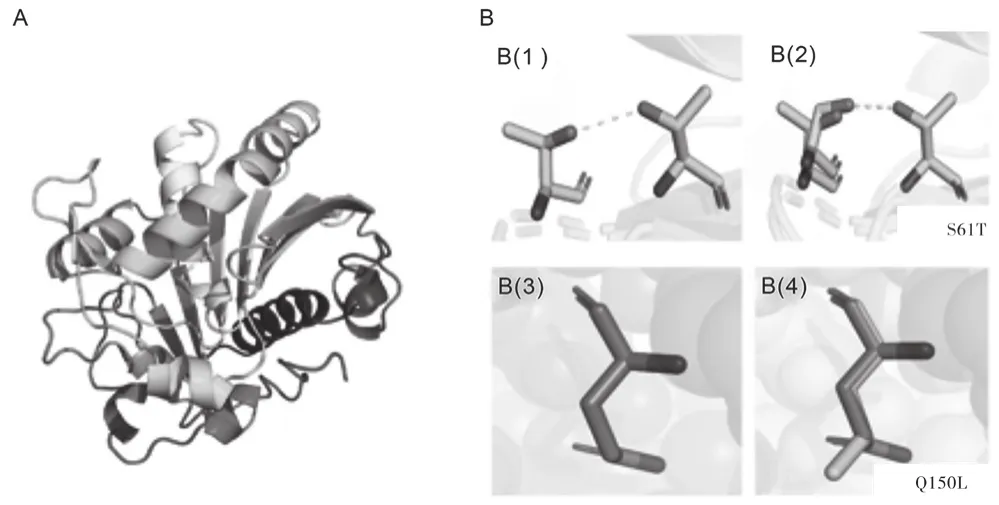
图1 ROL蛋白质展示图及两个突变位点
2.2 ROL重组表达载体的构建
脂肪酶重组表达载体的构建如图2所示。图2A为原始脂肪酶pro-ROL和改造后脂肪酶m-ROL片段大小;图2B为用BamHⅠ和BglⅡ2个限制性内切酶对重组质粒和空载体进行双酶切,以及用BamHⅠ对重组质粒进行单酶切,与目的片段大小进行对比,结果显示两者大小相同。结果表明,本研究成功地获得了重组质粒pPICZα-A–proROL和pPICZα-A-mROL。
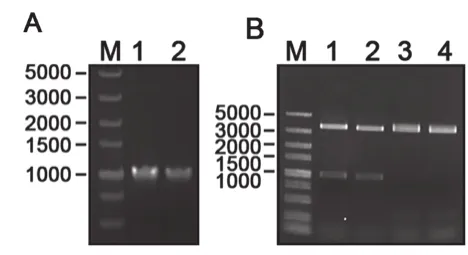
图2 米根霉脂肪酶重组载体的构建
2.3 脂肪酶重组子在摇瓶条件下的蛋白表达量及酶活分析
在摇瓶条件下进行pro-ROL和m-ROL重组子的发酵工艺研究,结果如图3所示。对发酵完成后的上清液进行聚丙烯酰胺凝胶电泳,显示优化后的ROL表达量明显优于原始脂肪酶,优化前的脂肪酶含量为0.18 mg/mL,优化后的含量为0.59 mg/mL。当培养时间为72 h时,优化前的酶活含量约280 U,优化后的酶活平均为1 430 U/mL,比优化前酶活大幅度提高5.1倍,远高于现有研究结果[11]。
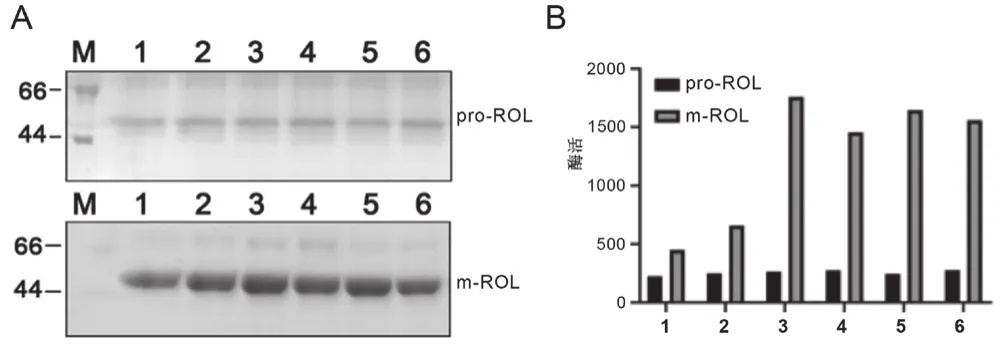
图3 pro-ROL和m-ROL表达产物的分析
2.4 ROL优化前后酶学性质分析
2.4.1 最适反应温度测定
将酶液样品在20 ℃到70 ℃温度下,按前述体系以及实验操作测定酶活,以温度为横坐标,以相对酶活(以40 ℃下m-ROL的酶活基准)为纵坐标,作曲线图,见图4A。结果发现,米根霉脂肪酶的最适温度在40 ℃,酶活随着温度的升高先增加再减小,当温度达到40 ℃时,ROL酶活达到最高。
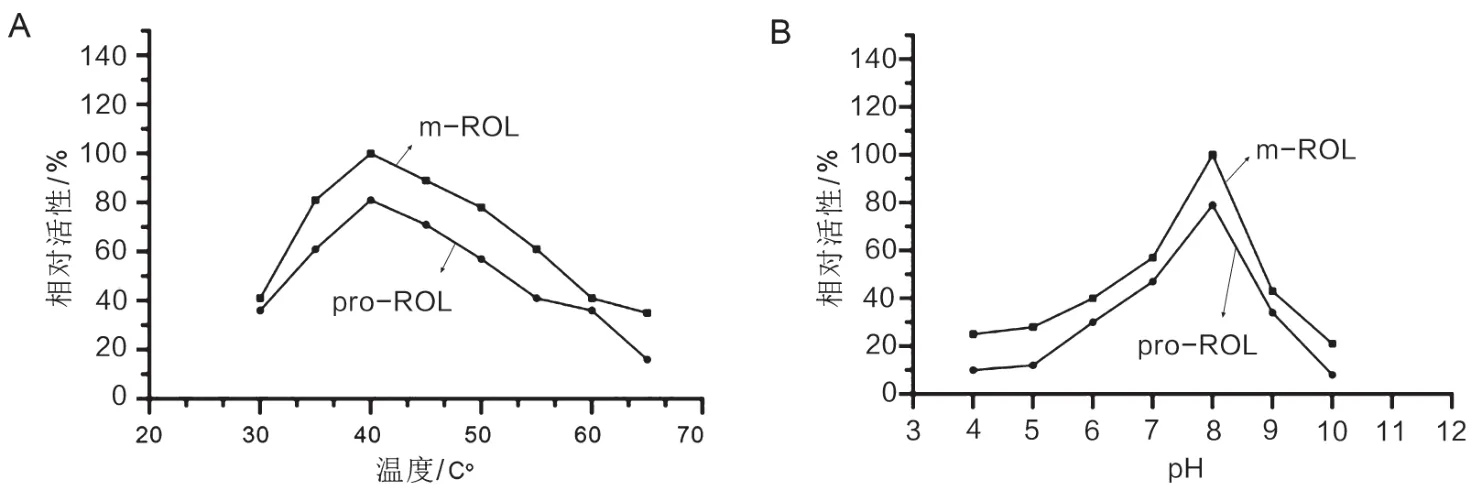
图4 温度和pH对酶活的影响
2.4.2 最适pH测定
将酶液样品置于pH=4~10的不同缓冲液中,按上述体系以及实验操作测定酶活,以pH为横坐标,以相对酶活(以pH=8时m-ROL的酶活为基准)为纵坐标,坐曲线图。由图4B知,在最适温度40 ℃下,ROL的最适pH在8.0。本实验中测得的最适温度与pH与已有研究结果一致[11]。
2.5 ROL生物柴油转化效率数据分析
国内外现有许多研究也是用叔丁醇作为有机溶剂介质进行实验反应,这是由于叔丁醇本身是相对亲水的,而且甲醇和反应产物也可以溶解在其中,使得反应体系是均相的[12]。
本研究考察了反应体系中脂肪酶的添加量对转化效率的影响。由图5A知,当脂肪酶的添加量为反应体系的10%时生物柴油脂肪酸甲酯的产率最高。当酶量进一步升高时,生物柴油的产率反而降低。在最适酶量的情况下,本研究在甲醇和废弃油脂的摩尔比例达到4∶1,叔丁醇占油脂相对质量分数80%的时候,比较分析了原始脂肪酶与优化后脂肪酶的转酯效率。当反应时间在18 h时,m-ROL的脂肪酸甲酯的产率可以达到80.4%,而pro-ROL脂肪酸甲酯的产率仅为45.3%(见图5B)。
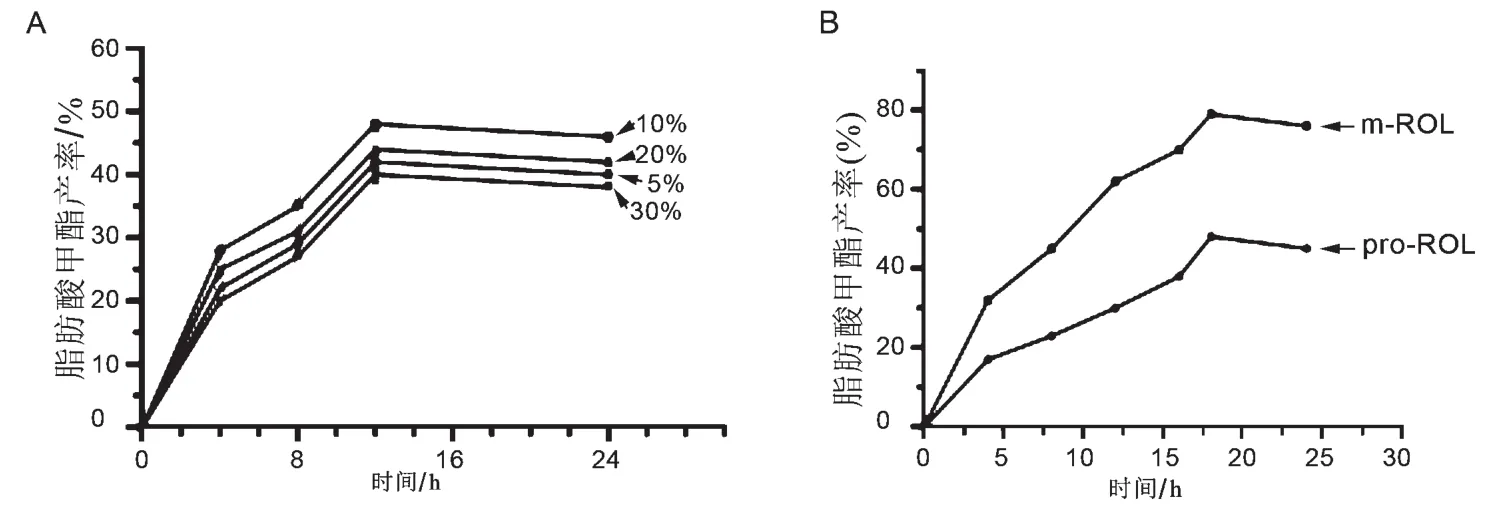
图5 生物柴油脂肪酸甲酯产率分析
3 结论
脂肪酶在催化方面有其独特的优势,但是脂肪酶受环境影响很大,从而导致催化效率不高。将分子改造运用于脂肪酶的改造中,在原始基因上通过理性设计改变某一部分或替换某一个氨基酸以此获得突变菌株,可提高酶活和蛋白表达量。
ROL在催化生成脂肪酸酯的过程中具有良好的催化优势。但是产量和稳定性有待提高[13]。因此本文以提高其表达量为目的,对其进行分子改造。
本文对ROL基因进行了分子改造。酶活蛋白量测量表明改造后的ROL在毕赤酵母X-33中得到了高效表达。本实验中测得的ROL的最适温度与pH值分别为40 ℃和8.0,在摇瓶发酵条件下酶活为1 430 U/mL。据估算,在发酵罐等高效的生物反应器条件下,通过高密度发酵酶活可再提高约10倍。

