猪支气管败血波氏杆菌主要毒力基因的检测
张瑞华 , 于永乐 , 张 鸿 , 李焕发 , 高善颂 , 陈 超 , 张丹萍 , 窦心怡 , 韩先杰
(青岛农业大学动物医学院 , 山东 青岛 266109)
支气管败血波氏杆菌(Bordetellabronchiseptica,Bb) 是一种革兰阴性小杆菌或球杆菌[1],在血平板上37 ℃培养48 h的菌落直径为0.5~1 mm,眼观菌落呈圆形,边缘整齐[2]。支气管败血波氏杆菌是一种潜在的人兽共患病病原体,主要引起人类和多种动物的呼吸道疾病[3],能在某些哺乳动物中定居,并能引起动物机体呼吸道发生隐性感染或急、慢性炎症,且能够引起人类的感染导致免疫功能低下的患者罹患复发性菌血症和肺炎[4-5]。
支气管败血波氏杆菌有多个毒力因子,如菌毛(Fimbriae)、皮肤坏死毒素(Demronecrotic toxin,DNT)、腺苷酸环化酶溶血素(Adenylate cyclase-hemolisin,AC-Hly)、百日咳杆菌黏附素(Pertactin,Prn)、内膜感受器组氨酸激酶(bvgs)、外源铁载体受体(brfZ)、气管细胞毒素(Tracheal cytotoein)和菌毛血凝素(Filmanetous hemagglutinin,FHA)。本试验从山东省胶东地区分离出8株疑似猪支气管败血波氏杆菌,为了研究猪支气管败血波氏杆菌的毒力基因,通过PCR方法对DNT、brfZ、AC-Hly、bvgs、FHA基因和Prn基因进行检测,为该菌的致病性研究提供理论基础。
1 材料与方法
1.1 菌株来源 于2018—2020年分离自山东省胶东地区某些发生呼吸道综合征猪场的病死猪肺脏。8株分离菌的具体信息见表1。

表1 菌株来源Table 1 Strain source
1.2 主要试剂 50×TAE电泳缓冲液、PCR试剂(2×PCR Buffer、dNTPs、ExTaq酶)、DL2 000 DNA Marker、琼脂糖、核酸染料,均购自生工生物工程(上海)股份有限公司;博检氏革兰阴性菌鉴定系统、革兰染色试剂、绵羊血平板,均购自青岛高科园海搏生物技术有限公司。
1.3 细菌的分离培养与纯化 无菌条件下取病死猪的肺脏划线接种到血琼脂平板上,于37 ℃恒温箱培养24~36 h;挑取大小、形态及颜色基本一致的菌落再次接种至血琼脂平板,然后在血平板上进行划线分离培养并将其放在37 ℃恒温箱中培养24~48 h后取出,仔细观察细菌的培养状况。挑取单菌落进行革兰染色鉴定。挑取单菌落至脑心浸液肉汤中增殖培养。
1.4 生化试验 将菌液离心后使用生理盐水洗涤2次,将菌体重悬后接种到精氨酸、赖氨酸、鸟氨酸、枸橼酸盐、脲酶、硫化氢、氧化酶、乳糖、邻硝基酚β-D-半乳糖吡喃苷(Ortho-nitrophenyl-β-galactoside,ONPG)、3-羟基丁酮(Voges-proskauer,V-P)、吲哚、葡萄糖、甘露醇、蔗糖、阿拉伯糖、鼠李糖、蜜二糖、苦杏仁甙、明胶和肌醇中,放入37 ℃恒温箱中培养24 h,结束后进行结果判定。
1.5 PCR鉴定 采用煮沸法提取DNA,根据Stępniewska等[6]的方法合成针对鞭毛(Flagella,FLA)基因的特异性引物(表2),通过PCR方法对猪支气管败血波氏杆菌进行检测。
1.6 毒力基因的检测 采用 PCR方法对该细菌的主要毒力基因进行检测。这些毒力基因均通过GenBank进行序列分析比对,使用Primier 5.0软件设计相关引物(表2),引物均由生工生物工程(上海)股份有限公司合成。

表2 PCR引物信息Table 2 PCR primer details
PCR反应体系(25 μL):2×Master Mix 12.5 μL,上游引物(F)1.0 μL,下游引物(R)1.0 μL,DNA模板1.5 μL,无菌水9.0 μL。其中,根据碱基(G+C)和(A+T)的含量以及预期扩增片段大小得到各毒力基因的反应条件。bfrZ、FHA基因和AC-Hly基因的反应条件:95 ℃预变性3 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,循环30次;72 ℃终延伸7 min。反应结束后,将PCR产物置4 ℃保存。FLA、bvgs基因和DNT基因的退火温度改为56 ℃,Prn基因的延伸时间为60 s,其他反应条件不变。PCR产物经120V电泳20 min后使用凝胶成像仪观察结果并拍照留存。
2 结果
2.1 细菌的培养特性与形态特征 分离菌在血平板上生长缓慢,24 h长出的菌落似针尖大小,48 h长出的菌落似针头大小,灰黄色、圆形、微隆起(图1)。革兰染色结果为革兰阴性短小杆菌,呈单个存在(图2)。

图1 分离菌的菌落形态Fig.1 Colonial morphology of isolated strains
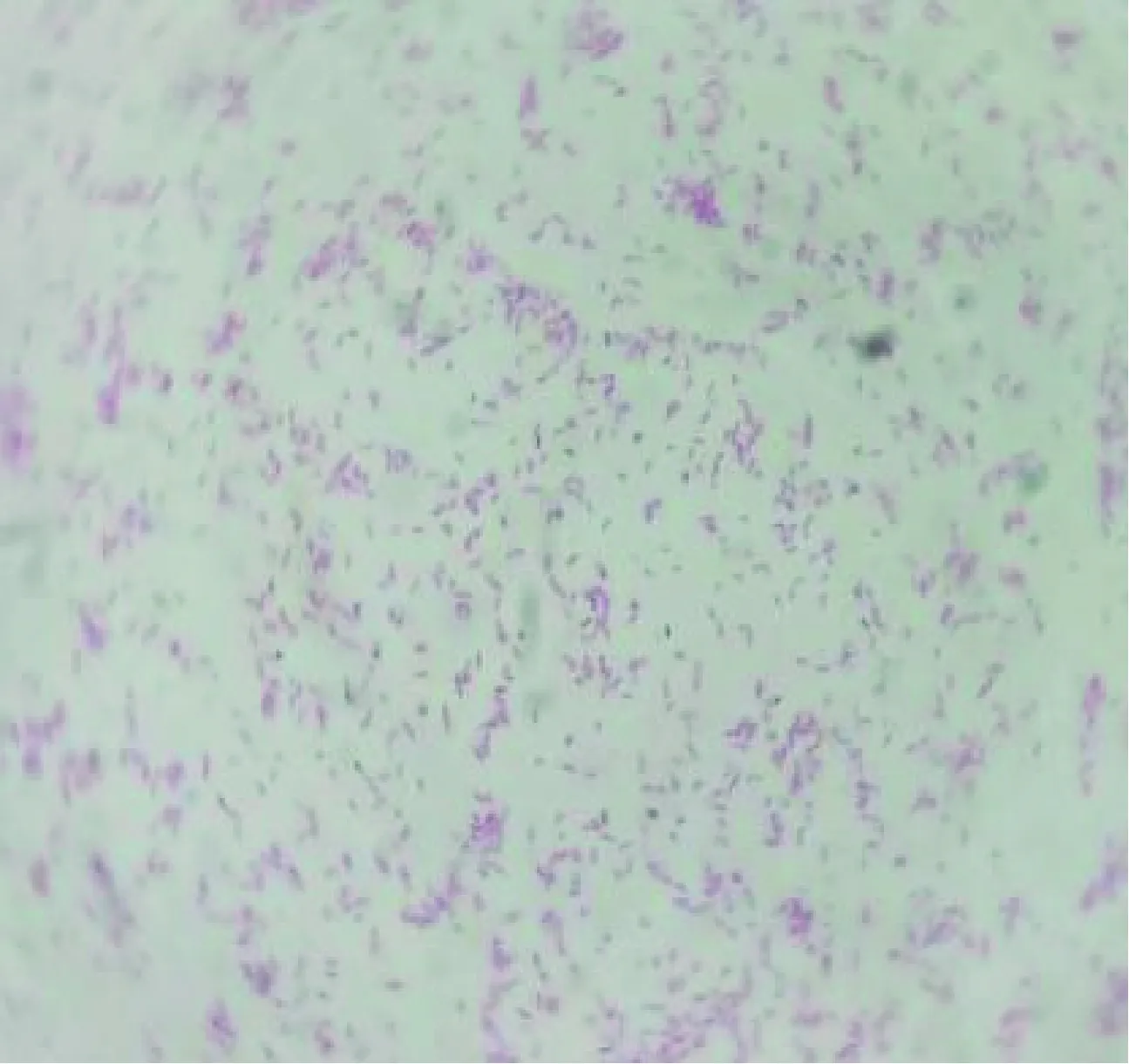
图2 分离菌革兰染色 (1 000×) Fig.2 Gram staining of isolated strains (1 000×)
2.2 生化试验 如表3所示,分离菌能分解精氨酸、赖氨酸、鸟氨酸、枸橼酸盐和脲酶,氧化酶试验呈阳性,不产生硫化氢,不分解乳糖、蔗糖等多种糖类,ONPG、V-P和吲哚试验均为阴性,试验结果符合支气管败血波氏杆菌的生化特点。
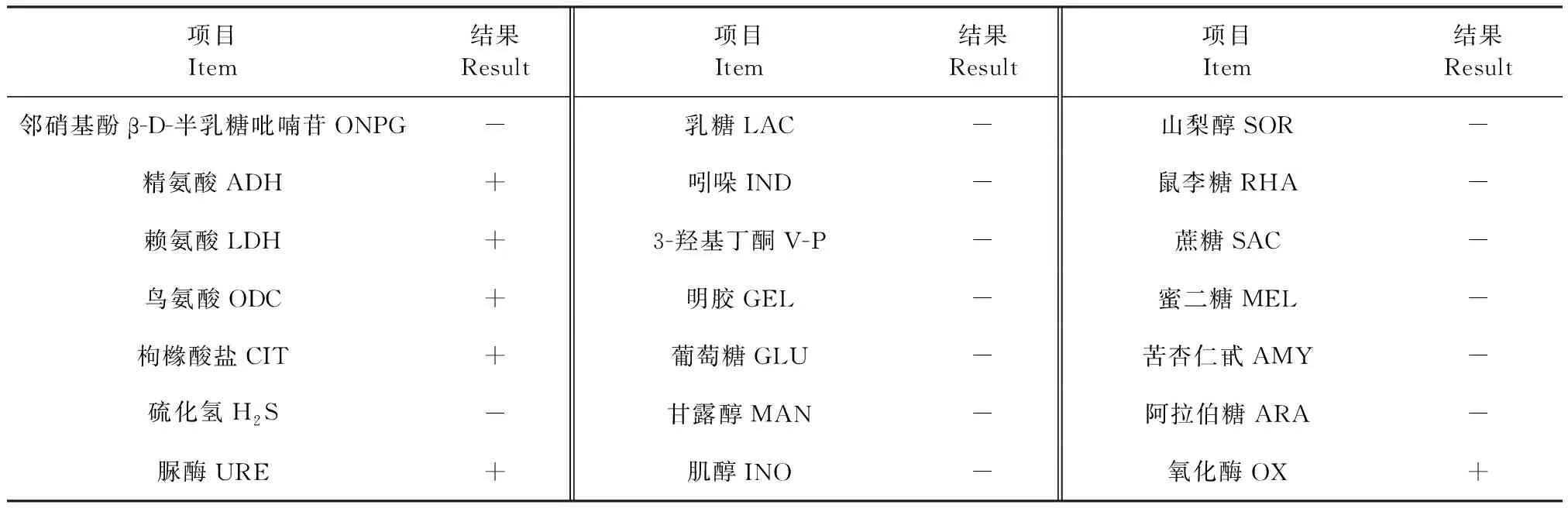
表3 生化试验结果Table 3 Results of biochemical test
2.3 PCR鉴定 对8株分离菌进行FLA基因PCR扩增并通过1%琼脂糖凝胶电泳鉴定,扩增片段大小约为237 bp(图3),分别将其命名为Bb-1、Bb-2、Bb-3、Bb-4、Bb-5、Bb-6、Bb-7和Bb-8。

图3 FLA基因的PCR扩增Fig.3 PCR amplification of FLA geneM:DNA分子质量标准DL2 000; 1~8:Bb-1~Bb-8M:DL2 000 DNA Marker; 1-8:Bb-1-Bb-8
2.4 毒力基因的检测 毒力基因的PCR扩增检测结果如表4和图4~9所示。结果显示,毒力基因DNT的检出率为87.5%,毒力基因bvgs的检出率为100%,毒力基因AC-Hly的检出率为100%,毒力基因FHA的检出率为87.5%,毒力基因bfrZ的检出率为100%,毒力基因Prn的检出率为100%。

表4 猪支气管败血波氏杆菌主要毒力基因的分布情况Table 4 Distribution of main virulence genes in Bordetella bronchiseptica strains from swine

图4 DNT基因的PCR扩增Fig.4 PCR amplification of virulence gene DNTM:DNA分子质量标准DL2 000; 1~8:Bb-1~Bb-8M:DL2 000 DNA Marker; 1-8:Bb-1-Bb-8

图5 bvgs基因的PCR扩增Fig.5 PCR amplification of virulence gene bvgsM:DNA分子质量标准DL2 000; 1~8:Bb-1~Bb-8M: DL2 000 DNA Marker; 1-8:Bb-1-Bb-8
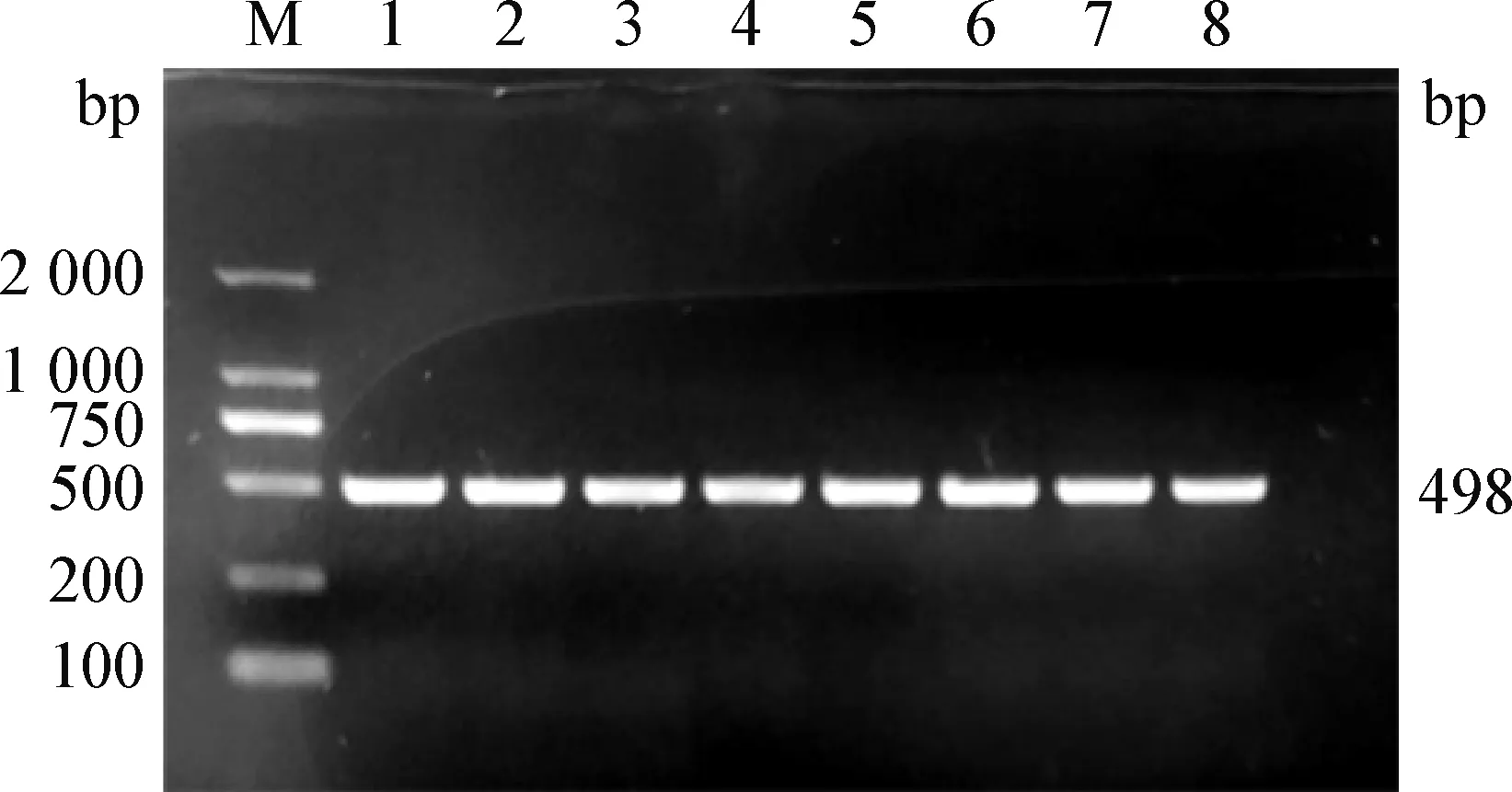
图6 AC-Hly基因的PCR扩增Fig.6 PCR amplification of virulence gene AC-HlyM:DNA分子质量标准DL2 000; 1~8:Bb-1~Bb-8M: DL2 000 DNA Marker; 1-8:Bb-1-Bb-8
3 讨论
本试验分离菌的菌落在血平板上呈灰黄色、圆形、微隆起,这一菌落特点与张栋良等[7]的研究结果一致,但在该菌培养的过程中发现,多数菌株在24 h左右并未出现明显的菌落聚集,在24~36 h时,多数菌株出现较为典型的菌落形态,但是有个别菌株的菌落并不典型,并且有些已出现典型菌落的平板再置于37 ℃恒温箱中培养约4 h后,其菌落出现了不同程度的变化。通过细菌生化和PCR鉴定后,确定了这8株分离菌均为Bb,以此判断该菌可能出现了菌相变异,在以后对该菌进行研究时,应注意这一特性变化。

图7 FHA基因的PCR扩增Fig.7 PCR amplification of virulence gene FHAM:DNA分子质量标准DL2 000; 1~8:Bb-1~Bb-8M: DL2 000 DNA Marker; 1-8:Bb-1-Bb-8

图8 bfrZ基因的PCR扩增Fig.8 PCR amplification of virulence gene bfrZM:DNA分子质量标准DL2 000;1~8:Bb-1~Bb-8M: DL2 000 DNA Marker; 1-8: Bb-1-Bb-8
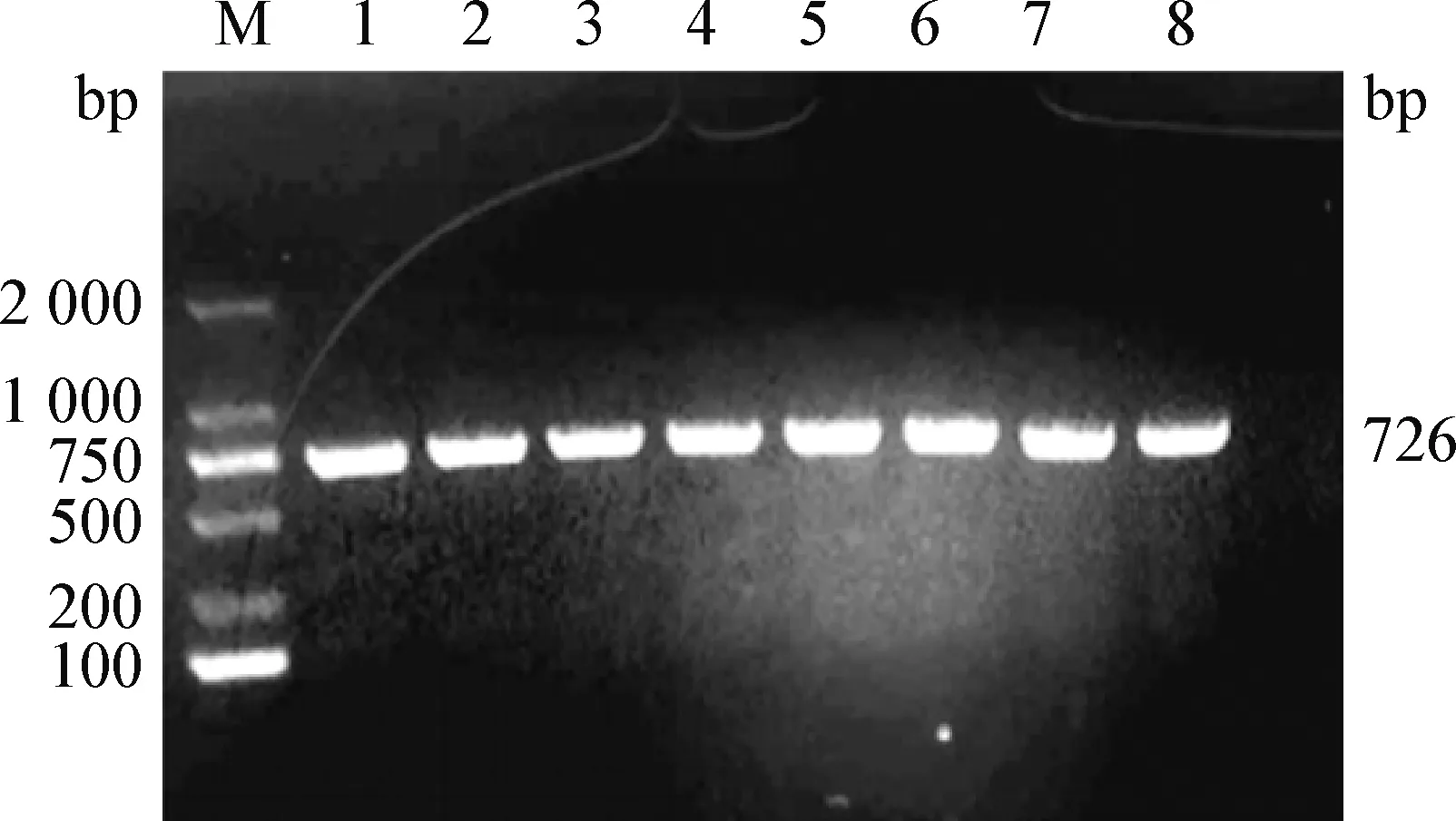
图9 Prn基因的PCR扩增Fig.9 PCR amplification of virulence gene PrnM:DNA分子质量标准DL2 000;1~8:Bb-1~Bb-8M: DL2 000 DNA Marker; 1-8: Bb-1-Bb-8
支气管败血波氏杆菌的毒力基因有许多,本试验检测到的主要毒力基因中bvgs基因可根据环境条件的变化而发生改变,这一特性是通过调节多种毒力因子的表达来实现的。FHA基因具有良好的抗原保护性[8],它和DNT基因都有利于猪支气管败血波氏杆菌的黏附作用,并且从肖璐等[9]的研究中可知,DNT基因对机体的皮肤还有明显的毒性作用。AC-Hly基因可以裂解红细胞,并能使巨噬细胞和免疫效应细胞的吞噬作用受到破坏从而发挥毒性作用[10],而Prn基因对巨噬细胞也具有一定的毒素作用,从而有利于细菌在宿主体内生存。前人研究发现,该细菌毒力基因的分布并不一致,与本试验结果相吻合,毒力基因DNT和FHA的检出率均为87.5%,毒力基因bvgs、AC-Hly、bfrZ和Prn的检出率均为100%。

