复发性流产中活性维生素D3与维生素D3受体的表达及其对滋养细胞增殖与侵袭的调控和机制研究*
周立花,胡 英,邹 晖
(海南医学院第二附属医院生殖科,海口 570311)
滋养细胞增殖与侵袭功能障碍是多种妊娠并发症,如子痫前期、胎儿生长受限及复发性流产(recurrent spontaneous abortion,RSA)的重要发病机制[1]。RSA是指与同一配偶在妊娠28周前连续发生2次或2次以上原因不明的胎儿丢失,影响约1%~3%的育龄女性[2]。RSA不仅给家庭与社会造成沉重的经济负担,还严重影响患者的心理健康。因此,持续深入研究其相关发病机制,以充分了解致病因素并探究相关治疗策略具有重要意义。维生素D(Vitamin D,VD)是一种脂溶性维生素,其主要通过皮肤在270~300nm的紫外线照射下合成,极少能通过食物中获取[3]。光照时间、暴露的身体面积不足,环境污染及生活方式的改变,可导致皮肤来源的VD显著降低。机体内活性形式的1,25二羟维生素D3[1,25(OH)2D3]与组织细胞中广泛存在的维生素D受体(Vitamin D receptor,VDR)相互作用后,可通过胞内的25-羟基维生素D3-1α-羟化酶(25-hydroxyvitamin D3-1α-hydroxylase,CYP27B1)进行代谢,以发挥维持骨骼代谢与矿物质平衡的作用[4]。近年大量数据表明,VD除了具有上述作用外,还能通过调节自噬影响细胞的增殖与迁移等生物学功能[5-6]。自噬在卵母细胞分裂、胚胎形成与植入等多个事件中发挥重要功能[7]。最新研究表明,RSA患者的胎盘绒毛组织中VD、VDR表达与自噬水平均较正常妊娠妇女明显降低,而自噬水平缺陷的滋养细胞与胎盘功能异常密切相关[8-10]。有研究证实,补充VD可减轻育龄女性罹患RSA的风险,这可能与其能降低母胎间的免疫排斥相关[9,11-12]。但VD能否通过调控滋养细胞的自噬水平改善其功能,鲜有研究报道。本研究通过实验进一步探究VD改善RSA的相关作用与机制,以期为VD的作用机理提供更为全面与充分的依据。
1 材料与方法
1.1 研究对象 选取2019年1月至2020年5月于海南医学院第二附属医院就诊且在妊娠前3个月连续发生两次或两次以上自然流产的20例患者(RSA组)和自愿行人工流产的20例早期妊娠妇女(对照组)。两组的一般临床资料,见表1。纳入标准:(1)RSA诊断参考2020年版关于RAS的专家共识相关诊断标准[2],且排除伴有自身免疫、解剖、感染、遗传异常或内分泌紊乱的患者;(2)对照组妇女至少有一次成功妊娠史,且既往无流产史;(3)月经规律,且在本次妊娠7~9周时经超声诊断为活胎;(4)妊娠前3个月内均未服用维生素D或其他维生素补充剂。术前3h内采肘静脉血,离心,酶联免疫法检测血清中总25OHD(包括25OHD2与25OHD3)水平;负压吸引法在人工流产术中收集绒毛组织,无菌生理盐水充分洗涤,用液氮运输至实验室,-80℃保存备用。本研究经医院伦理委员会批准,患者均签署书面知情同意书。
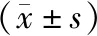
表1 两组患者的一般临床资料
1.2 细胞系与主要试剂 人胎盘滋养细胞系HTR-8/SVneo(美国ATCC);RPMI 1640(美国Hyclone公司);胎牛血清(fetal bovine serum,FBS)(美国Gibco公司);靶向沉默VDR表达的siRNA(si-VDR)与阴性对照siRNA(si-NC)由广州吉玛生物制药有限公司设计与合成;TRIzol试剂(美国Invitrogen公司);cDNA反转录试剂盒、SYBR green PCR mix(日本Takara公司);SYBR green PCR mix(美国Appiled Biosystems公司);25OHD的酶联免疫试剂盒(美国BD公司);大鼠抗CYP27B1、VDR多克隆抗体、抗AMPK、p-AMPK单克隆抗体,DAB显色试剂盒(美国Abcam公司);兔抗LC3B、p62、GAPDH单克隆抗体(美国Santa Cruz公司);兔抗p-mTOR、mTOR多克隆抗体(美国Pierce公司);HRP标记的山羊抗兔或大鼠IgG二抗(武汉博士德);MTT细胞增殖检测试剂盒,自噬抑制剂3-甲基腺嘌呤(3-methyladenine,3-MA)(美国Sigam公司);EdU试剂盒(广州锐博);RT-PCR引物由上海生物工程有限公司合成。
1.3 实验方法
1.3.1 实时荧光定量PCR(RT-PCR)检测VDR与CYP27B1表达水平 使用TRIzol试剂提取绒毛组织与待测细胞中总RNA含量,cDNA反转录试剂盒取约1μg RNA进行逆转录合成cDNA,使用SYBR green PCR mix进行对上述cDNA进行RT-PCR。反应条件:95℃预热35s,40个循环的95℃变性5s,60℃退火30s,72℃延伸60s。RT-PCR引物:VDR-F:5'-AAGGGGCACTGAGGTTTGAG-3',VDR-R:5'-AAGGTTACACACCCTCCACTC-3';CYP27B1-F:5'-TCTGGACGCCTGGAAGAGTA-3',CYP27B1-R:5'-TTTACAGCTTAGCCCCTGCC-3';GAPDH-F:5'-TCACCATCTTCCAGGAGCGA-3',GAPDH-R,5'-TGGACTCCACGACGTACTCA-3'。以GAPDH为内参,按2-ΔΔCt法计算样品中CYP27B1与VDR表达水平。实验单独重复3次。
1.3.2 免疫组化法检测绒毛组织中VDR与CYP27B1表达[13]取前述收集的胎盘绒毛组织,10%福尔马林固定,石蜡包埋,5μm切片,在梯度酒精与二甲苯中脱蜡水化,置于柠檬酸钠缓冲液中加压处理进行抗原提取。3%过氧化氢猝灭内源性过氧化物酶活性,3%山羊血清进行抗体封闭,加稀释后一抗,VDR(1∶50),CYP27B1(1∶100),4℃孵育过夜。加HRP标记的二抗室温孵育1h,DAB试剂盒显色,使用苏木精染色复染,显微镜下拍照观察,Image-pro Plus软件进行分析。以累计吸光度值(IA)比较绒毛组织中VDR与CYP27B1表达水平。实验单独重复3次。
1.3.3 细胞的培养与处理、分组 HTR-8/SVneo细胞培养于含10%FBS的RPMI 1640中,置于37℃、5%CO2恒温培养箱培养。细胞生长融合至80%~90%时,应用含EDTA的0.25%胰酶进行消化传代。取处于对数生长期的滋养细胞,消化并计数,按5×105细胞/孔接种至6孔板,待细胞生长融合至60%~70%时,按Lipofectamine 2000转染试剂盒说明书方法将si-VDR与si-NC分别转染入滋养细胞。48h后收集转染后细胞,RT-PCR与Western blot法检测VDR表达。按实验目的将细胞分为4组:si-NC组,100nmol/L VD处理转染24h后si-NC或si-VDR的si-NC+VD组与si-VDR+VD组[14],100nmol/L的VD与2nmol/L的3-MA联合处理转染24h后si-NC的si-NC+VD+3-MA组。如无特殊说明,上述各组细胞置于37℃、5%CO2恒温培养箱培养24h,用于后续相关实验。
1.3.4 MTT与EdU法检测滋养细胞增殖能力 (1)MTT法:将滋养细胞接种至96孔板,按1.3.3分组处理滋养细胞,用含10%FBS的RPMI 1640新鲜培养基更换原培养液,置37℃、5%CO2恒温培养箱分别培养12、24、36、48h,每孔加20μL MTT试剂,继续孵育4h,每孔加100μL二甲基亚砜,震荡10min,使用酶标仪在490nm处检测每孔吸光度值。每组每个时间点设置6个复孔;(2)EdU法:按1.3.3分组处理滋养细胞,培养48h,参考文献[5]使用1mL终浓度为50μmol/L的EdU试剂处理各组细胞2h,室温下4%多聚甲醛固定细胞,Triton X-100进行透化,使用200μL的1×Hochest33342室温避光染核10min,加防荧光猝灭剂,封片后荧光显微镜下观察拍照。上述实验均单独重复3次。
1.3.5 侵袭实验 预先使用40μL的Matrigel基质胶包被Transwell小室,37℃培养箱孵育2h待基质胶固化后使用。按1.3.3处理细胞24h,按2×104细胞/孔接种于上室,并予以200μL含3%FBS的RPMI1640培养基,下室加800μL含10%FBS的RPMI 1640培养基进行诱导,37℃、5%CO2恒温培养箱培养24h。取出上室,4%多聚甲醛室温固定25min,0.4%结晶紫溶液进行染色,显微镜×200倍下观察拍照,分析各组穿出细胞数。
1.3.6 透射电镜观察滋养细胞中的自噬囊泡 取1.3.3中的各组细胞,更换培养无血清的RPMI 1640培养基饥饿细胞3h,参考文献[9]收集细胞,预冷的2.5%戊二醛室温固定2h,1%四氧化锇中固定1h,梯度酒精脱水,环氧树脂包埋,制成超薄切片(60nm),使用醋酸轴与柠檬酸钠双染,透射电镜观察拍照。
1.3.7 免疫荧光检测LC3B表达 取1.3.3中的各组滋养细胞,4%多聚甲醛室温固定20min,0.1% Triton X-100在PBS中预孵育30min,充分洗涤,3%山羊血清进行抗体封闭,加稀释后的兔抗LC3B(1∶200)抗体,4℃孵育过夜,次日加FITC荧光标记的山羊抗兔二抗,室温下继续孵育2h。细胞核使用DAPI试剂在避光下反应5min,最后使用荧光显微镜观察LC3B的分布及表达,Image J软件在各组滋养细胞玻片中选择3个不重叠的区域进行图片分析。
1.3.8 Western blot实验 取1.3.3中的各组待测滋养细胞,预冷PBS洗涤,应用RIPA裂解液裂解细胞,4℃、22000r/min离心15min,取底层蛋白沉淀,使用BCA试剂盒进行蛋白定量,加热变性,取40μg蛋白样品进行SDS-PAGE凝胶分离,转至PVDF膜。5%脱脂奶粉进行抗体封闭,加一抗:LC3B(1∶500),p62(1∶800)、VDR(1∶800)、CYP27B1(1∶1000)、p-AMPK(1∶800)、AMPK(1∶800)、p-mTOR(1∶1000)、mTOR(1∶1000)、GAPDH(1∶2000),4℃下孵育过夜,加相应的二抗(1∶3000)室温2h,加化学发光试剂在凝胶成像系统中进行条带可视化检测。实验单独重复3次。

2 结 果
2.1 CYP27B1与VDR在胎盘绒毛组织中的表达 IHC染色结果显示,CYP27B1主要表达于滋养细胞胞浆与胞核,而VDR主要表达于滋养细胞胞浆。与对照组相比,RSA组胎盘绒毛组织中CYP27B1与VDR表达均显著降低(P<0.01)。见图1、2。RT-PCR结果显示,与对照组相比,RSA组胎盘绒毛组织中CYP27B1与VDR mRNA表达显著降低(P<0.01),见图2。

图1 IHC检测CYP27B1与VDR在胎盘绒毛组织中的表达(×400)A、B:分别为CYP27B1在对照组和RSA组胎盘绒毛组织中的表达;C、D:分别为VDR在对照组和RSA组胎盘绒毛组织中的表达
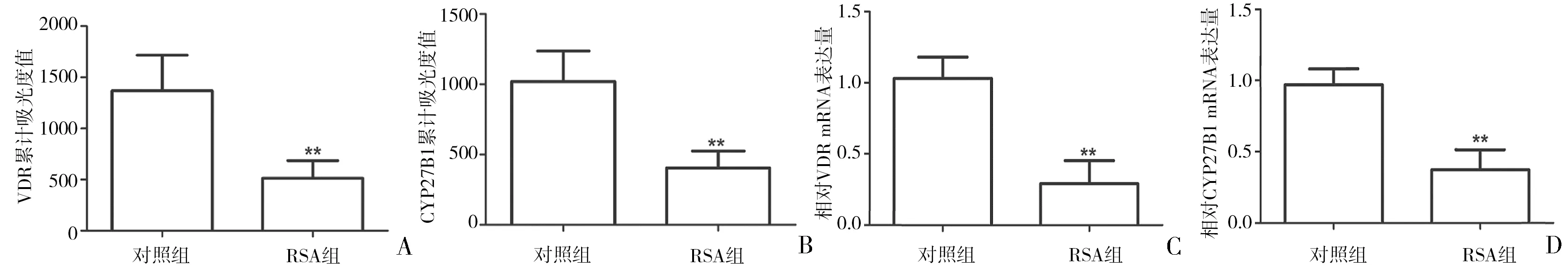
图2 对照组和RSA组胎盘绒毛组织中VDR与CYP27B1的累积吸光度值及mRNA表达水平A、B:对照组和RSA组胎盘绒毛组织中VDR与CYP27B1的累积吸光度值;C、D:RT-PCR检测胎盘绒毛组织中CYP27B1与VDR的mRNA表达水平;**P<0.01 vs 对照组
2.2 胎盘绒毛组织中自噬水平检测 Western blot检测结果显示,与对照组相比,RSA组胎盘绒毛组织中LC3-Ⅱ/LC3-Ⅰ比值显著降低,p62蛋白表达明显升高,差异均有统计学意义(P<0.05),见图3。
2.3 转染siRNA后滋养细胞细胞中VDR表达显著降低 RT-PCR与Western blot检测结果示,与转染si-NC组相比,转染si-VDR组滋养细胞中VDR mRNA与蛋白表达均显著降低(均P<0.01),见图4。

图3 Western blot法检测胎盘绒毛组织中自噬相关蛋白LC3-Ⅱ、LC3-Ⅰ与p62蛋白表达*P<0.05 vs 对照组

图4 RT-PCR与Western blot检测转染siRNA后滋养细胞细胞中VDR表达A:RT-PCR检测;B:Western blot检测。**P<0.01 vs 转染si-NC的滋养细胞
2.4 VD通过VDR介导滋养细胞的增殖 MTT与EdU检测结果表明,与si-NC组相比,si-NC+VD组的细胞增殖能力显著增加(P<0.05),si-VDR+VD无明显改变(P>0.05),si-NC+VD+3-MA组明显降低(P<0.05);与si-NC+VD组相比,si-VDR+VD与si-NC+VD+3-MA组的增殖能力均明显降低(P<0.05),见图5A、B。
2.5 VD通过VDR介导滋养细胞的侵袭 Transwell侵袭实验结果显示,与si-NC组相比,si-NC+VD组的细胞侵袭功能显著增加(P<0.05),si-VDR+VD无明显改变(P>0.05),si-NC+VD+3-MA组的细胞侵袭功能明显降低(P<0.05);与si-NC+VD组相比,si-VDR+VD与si-NC+VD+3-MA组的细胞侵袭功能均明显降低(P<0.05),见图5C。

图5 MTT与EdU法检测各组滋养细胞增殖能力改变及Transwell侵袭实验A:MTT法检测;B:EdU法检测;C:Transwell实验检测;1:si-NC组;2:si-NC+VD组;3:si-VDR+VD组;4:si-NC+VD+3-MA组
2.6 VD通过VDR介导滋养细胞的自噬 TEM观察各组滋养细胞中自噬囊泡的形成结果显示,自噬囊泡呈双层膜包裹胞质成分的液泡状结构;与si-NC组相比,si-NC+VD组的细胞中自噬囊泡数明显增加(P<0.05),si-VDR+VD组无明显改变(P>0.05),而si-NC+VD+3-MA组显著减少(P<0.05);但与si-NC+VD组相比,si-VDR+VD组与si-NC+VD+3-MA组细胞中自噬囊泡数均明显减少(P<0.05)。免疫荧光显微镜观察结果显示,与si-NC组相比,si-NC+VD组细胞LC3B的荧光斑点数显著增加(P<0.05),si-VDR+VD组无显著差异(P>0.05),而si-NC+VD+3-MA组LC3B的荧光斑点数明显减少(P<0.05),且si-NC+VD组较si-VDR+VD组与si-NC+VD+3-MA组明显增加(P<0.05)。Western blot检测结果显示,与si-NC组相比,si-NC+VD组中LC3-Ⅱ/LC3-Ⅰ比值显著升高(P<0.05),p62蛋白明显降低(P<0.05),si-VDR+VD组的上述自噬相关蛋白均无明显变化(P>0.05),si-NC+VD+3-MA组中LC3-Ⅱ/LC3-Ⅰ比值明显降低(P<0.05),p62蛋白明显降低(P<0.05);与si-NC+VD组相比,si-VDR+VD组与si-NC+VD+3-MA组的LC3-Ⅱ/LC3-Ⅰ比值与p62蛋白变化趋势均明显增加(P<0.05),见图6。

图6 各组滋养细胞中自噬水平的检测A:TEM观察各组组滋养细胞中自噬囊泡(红色箭头指示自噬囊泡,bar=500nm);B:免疫荧光显微镜观察各组滋养细胞中LC3B在细胞中的荧光斑点量(×200);C:Western blot检测LC3-Ⅱ/LC3-Ⅰ比值与p63蛋白表达水平;1:si-NC;2:si-NC+VD;3:si-VDR+VD;4:si-NC+VD+3-MA;*P<0.05 vs si-NC组;#P<0.05 vs si-NC+VD组
2.7 VD通过VDR对滋养细胞AMPK/mTOR信号通路表达的影响 Western blot检测结果显示,与si-NC组相比,si-NC+VD组细胞中CYP27B1蛋白表达,p-AMPK/AMPK比值均显著增加(P<0.05),但p-mTOR/mTOR比值明显降低(P<0.05),si-VDR+VD组上述相关蛋白指标均无明显变化(P>0.05),而si-NC+VD+3-MA组中CYP27B1蛋白与p-mTOR/mTOR比值明显增加(P<0.05)、但p-AMPK/AMPK比值显著降低(P<0.05);同时与si-VDR+VD组相比,si-VDR+VD组与si-NC+VD+3-MA组中p-AMPK/AMPK比值显著降低(P<0.05),但p-mTOR/mTOR比值明显增加(P<0.05),见图7。
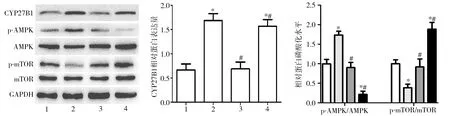
图7 Western blot检测各组滋养细胞中CYP27B1蛋白表达及AMPK和mTOR磷酸化水平表达1:si-NC组;2:si-NC+VD组;3:si-VDR+VD组;4:si-NC+VD+3-MA组;*P<0.05 vs si-NC组;#P<0.05 vs si-NC+VD组
3 讨 论
研究表明,活性形式的VD能改善胎盘滋养细胞的功能障碍。Westwood等[15]发现,子痫前期中VD能降低抑制鞘氨醇-1-磷酸表达来改善滋养细胞迁移功能的损伤。本研究证实,VD能上调滋养细胞的自噬水平,显著促进滋养细胞的增殖与侵袭功能。表明VD可能是改善滋养细胞功能损伤的有效药物。
大量数据证实,RSA患者胎盘组织中VDR表达与VD代谢较正常妊娠女性明显降低[8,11]。表明VD及其相关代谢可能与RSA的病因与发病机制有关。既往关于VD在RSA中的作用多集中在免疫调节和炎症反应方面。Ji等[16]结果显示,RSA患者外周血中VD含量与较低的Treg/Th17比值呈正相关,补充VD能明显增加RSA患者外周Treg/Th17的比值。但由于1,25(OH2)D3在机体中被迅速代谢,临床常用血清25OHD水平来指示VD的状态。同时,催化活性VD代谢的CYP27B1在母胎界面分布广泛,且最新的一项研究发现其具有类似VD的功能,能参与妊娠建立或维持的某些机制[17]。本研究结果显示,与正常妊娠女性比较,RSA患者胎盘绒毛组织中VDR与CYP27B1表达均显著降低,这与上述研究结论一致;两组妊娠女性外周血中25OHD含量无明显差异,均存在VD含量的不足现象(<50nmol/L),这与Hou等[18]结论一致,可能与体内25OHD广泛的生物作用与代谢相关。
自噬作为真核细胞中维持细胞稳态的一种重要代谢过程,其功能障碍能通过影响细胞的功能直接参与多种疾病,如心肌梗死、肿瘤、糖尿病和RSA等的发生发展[19]。而在生殖领域,有研究表明,抑制滋养细胞的自噬水平能降低父系表达基因10的水平,进而导致滋养细胞的侵袭能力减弱,同时自噬受到抑制的滋养细胞能减弱蜕膜自然杀伤细胞的分泌功能,进一步降低其增殖与侵袭能力[9]。在滋养细胞的氧化应激模型中发现,白藜芦醇能通过其抗氧化与促自噬作用显著改善过氧化氢诱导的滋养细胞功能损伤,降低其凋亡率[20]。这表明自噬在滋养功能的维持中具有关键地位。此外,有研究通过对比健康孕妇与RSA患者的滋养层细胞中的自噬水平发现,RSA患者的绒毛中自噬囊泡数显著减少,且分布紊乱,提示RSA患者滋养层细胞的自噬活性明显降低[9]。同时,国内外大量学者研究证实,VD在多种疾病中能通过调节自噬水平发挥保护细胞与组织正常功能的作用。肖超等[21]发现,糖尿病肾病中VD能通过逆转高糖诱导的自噬水平的下调,保护足细胞的结构与功能损伤,改善疾病的进展。在幽门螺杆菌感染的胃黏膜上皮细胞中,补充VD可恢复溶酶体的降解功能,上调细胞的自噬水平促使幽门螺杆菌的清除[22]。上述文献表明,VD可通过促进多种组织细胞的自噬水平维持其正常功能。众所周知,LC3是检测自噬的常用指标。在自噬过程中,胞质可溶形式的LC3-Ⅰ与亲脂性磷脂酰乙醇胺结合转换为自噬囊泡相关形式的LC3-Ⅱ,而p62作为最为著名的自噬底物,它能与泛素化蛋白进行结合,并在自噬体的降解过程中被消耗。Li等[23]研究表明,VD可提高高脂喂养小鼠肝脏中LC3-Ⅱ的表达,从而诱导自噬能力的增强促进肝脏脂质的清除。本实验结果同样证实,RSA患者胎盘绒毛组织中的自噬水平较正常对照组显著降低,而外源性予以滋养细胞活性VD可促进细胞的增殖与侵袭功能,并提高LC3-Ⅱ表达,降低p62含量,上调细胞的自噬水平,而上述作用能被沉默VDR的siRNA与自噬抑制剂3-MA所抵消,表明VD发挥促进滋养细胞功能的作用与VDR和细胞自噬水平的提高相关。
调控细胞自噬的信号通路众多,但多项研究证实AMPK/mTOR信号通路是自噬的重要调控因子,且该通路也是参与调控细胞增殖、分化、侵袭与凋亡等行为的重要信号级联途径[24-25]。同时,既往有文献报道,VD能通过激活AMPK,下调mTOR诱导的乳腺癌细胞和单核细胞的自噬抑制[26]。本研究发现,VD可上调AMPK途径而抑制mTOR信号的传导,这与其在2型糖尿病中的对肝脏脂质失调的改善机制一致[27]。
综上所述,RSA患者胎盘绒毛组织中VD、VDR和自噬水平表达较正常妊娠女性显著降低,而外源性予以VD能显著促进滋养细胞的增殖与侵袭功能,并上调其自噬水平,而这可能通过AMPK/mTOR信号通路发挥作用。本研究为VD/VDR在RSA患者中的潜在应用价值提供了新的见解与思路,有望为VD在临床实践中的研究提供依据。

