双棘黄姑鱼源致病发光杆菌的分离与鉴定
黄 婷,陈福艳,张 彬,黎 铭,林 勇,李莉萍,童桂香,唐瞻杨,韦信贤,蒋伟添
(1.广西壮族自治区水产科学研究院/广西水产遗传育种与健康养殖重点实验室,南宁 530021;2.广西北海市海城区海洋局,广西 北海 536000)
【研究意义】双棘黄姑鱼(Protonibeadiacanthus) 隶属于鲈形目石首鱼科原黄姑鱼属,是近海暖温性底层鱼类,主要分布在朝鲜、日本、东南亚国家及我国沿海海域,因其生长较快、抗病力强、肉味鲜美、经济效益高,近年来已发展成为我国南方沿海新兴的水产养殖品种[1]。但随着养殖规模的不断扩大,双棘黄姑鱼在养殖过程中病害时有发生。目前,关于双棘黄姑鱼的研究主要集中在人工育苗技术[2]、养殖技术[3]、摄食[4]及人工繁育[5-7]等方面,对其发生病害的病原了解较少。因此,分离鉴定双棘黄姑鱼源致病性病原菌,对查明引起双棘黄姑鱼出现大批量死亡的病因和及科学指导其防控的规范用药具有重要意义。【前人研究进展】发光杆菌属(Photobacterium)是弧菌科(Vibrionaceae)的成员,该属包括29个有效物种[8-10],属于革兰氏染色阴性和兼性好氧细菌,主要从沿海、公海和深海环境分离获得[11]。发光杆菌属的几个物种对低温动物包括鱼类[12-14]和软体动物[15-16]均表现出致病性。目前,关于托鲁尼发光杆菌(P.toruni)的研究较少,仅见Labella等[17]报道从患病的海鲷(Sparussarba)体内分离到托鲁尼发光杆菌,且能在春季和秋季感染海鲷发病,感染鱼体大小为85.00~300.00 g。而与托鲁尼发光杆菌同属的美人鱼发光杆菌(P.damselae)可感染多种养殖鱼类,具有较高致病性,对海水养殖业造成的经济损失较严重,因此研究较多。Pedersen等[12]从患病虹鳟鱼分离到美人鱼发光杆菌美人鱼亚种(P.damselaesubsp.damselae),并证实其具有很强的溶血性,毒力最强的菌株半数致死量达3.9×103CFU(20 ℃),可导致病鱼出血而大批量死亡。邵蓬等[18]研究发现,美人鱼发光杆菌美人鱼亚种对半滑舌鳎(Cynoglossussemilaevis)具有较强的致病性,可导致病鱼肝脏和肠道发生出血性坏死而死亡,死亡率达25%。张飞等[19]从患病的大黄鱼分离到美人鱼发光杆菌,病鱼体表无破损,但可见血丝,短期内死亡率在20%以上,该美人鱼发光杆菌的胞外产物含多种毒力因子,与该菌对大黄鱼的致病性密切相关。王瑞旋等[20]从患病的卵形鲳鯵(Trachinotusovatus)脾脏分离到美人鱼发光杆菌杀鱼亚种,病鱼体表完好,其脾脏和肝脏有灰白色结节。王庚申等[21]从患病条石鲷(Oplegnathusfasciatus)的内脏分离到美人鱼发光杆菌杀鱼亚种(P.damselaesubsp.piscicida),病鱼体色加深,体表无明显发病症状,内脏可见1~2 mm大小的白色结节,病鱼死亡率在20%以上。【本研究切入点】2021年1月广西北海市某养殖场网箱养殖的双棘黄姑鱼大批量死亡,养殖经济损失极大,亟需弄清病因及对症施药,但目前针对双棘黄姑鱼源致病菌的研究鲜见报道。【拟解决的关键问题】分离鉴定发病双棘黄姑鱼的致病菌并进行药敏试验,以期为指导广西沿海地区养殖户防治双棘黄姑鱼托鲁尼发光杆菌引发的病害提供参考依据。
1 材料与方法
1.1 试验材料
试验于2021年1—8月在广西水产遗传育种与健康养殖重点实验室进行。患病双棘黄姑鱼样品于2021年1月20日采自广西北海市铁山港养殖网箱,湿重为150.00~250.00 g[平均为(194.52±50.46)g],健康双棘黄姑鱼采自广西北海市某养殖场,湿重为(61.38±5.14)g,试验前暂养7 d。
主要试剂及仪器设备:细菌分离用血琼脂培养基(广东江门市凯林贸易有限公司)、基因鉴定用16S rRNA序列扩增通用引物及PCR扩增所用试剂[宝生物工程(大连)有限公司]、药敏纸片(杭州天和生物制剂公司)。
1.2 剖检与病原菌分离
在无菌条件下,剖解患病双棘黄姑鱼,取肝脏、脾脏和肾脏组织分别接种于血琼脂培养基上,28 ℃培养24~48 h,挑取优势单菌落继续分离纯化,获得的菌株20210120,将纯化获得的菌株接种至胰蛋白胨大豆肉汤(TSB)中,28 ℃下100 r/min振荡培养24 h,一部分用于人工感染试验,一部分加20%甘油保种于-86 ℃保存备用。
1.3 人工感染试验
人工感染试验在500 L水族箱中进行,共设6组,每组20尾双棘黄姑鱼。将1.2中培养的菌液浓度用生理盐水分别调整至2.5×108、2.5×107、2.5×106、2.5×105和2.5×104CFU/mL后进行腹腔注射(0.2 mL/尾,即菌悬液的注射剂量分别为5.0×107、5.0×106、5.0×105、5.0×104和5.0×103CFU/尾),以每尾腹腔注射生理盐水溶液0.2 mL为对照(CK)。每2 d换水50%,连续充气,水温保持在22~30 ℃,每天按试验鱼体重的3%分2次投料。每天观察、统计双棘黄姑鱼发病情况,同时采用血琼脂培养基对濒临死亡的双棘黄姑鱼脑、肝脏、脾脏和肾脏进行细菌分离。
采用Reed-Muench法测得的半数致死量(LD50)根据如下公式计算。
距离比例r=(高于50%死亡率-50%)/(高于50%-低于50%死亡率)
lgLD50=高于50%死亡率稀释度倒数的对数+距离比例×稀释倍数的对数
1.4 病原菌鉴定
1.4.1 形态学观察 分离菌株纯化培养后,进行细菌革兰氏染色,观察其形态特征。
1.4.2 16S rDNA序列测定分析 细菌基因组DNA提取:分离菌株接种于TSB液体培养基中,28 ℃下100 r/min振荡培养24 h。取1.5 mL菌液,12 000 r/min离心5 min,弃上清液,参考Biospin细菌基因组DNA提取试剂盒(杭州博日科技有限公司)操作说明提取细菌基因组DNA。
16S rDNA序列扩增:参考Heuer等[22]的方法合成细菌16S rDNA序列扩增通用引物,引物序列见表1。参考康为世纪生物科技股份有限公司的2×EsTaqMaster Mix聚合酶PCR反应试剂盒说明进行PCR扩增,扩增程序:94 ℃预变性5 min;94 ℃ 30 s,56 ℃ 30 s,72 ℃ 30 s,进行35个循环;72 ℃延伸5 min。反应结束后,以1.0%琼脂糖凝胶电泳(电压120 V,电泳30 min)对PCR扩增产物进行鉴定。
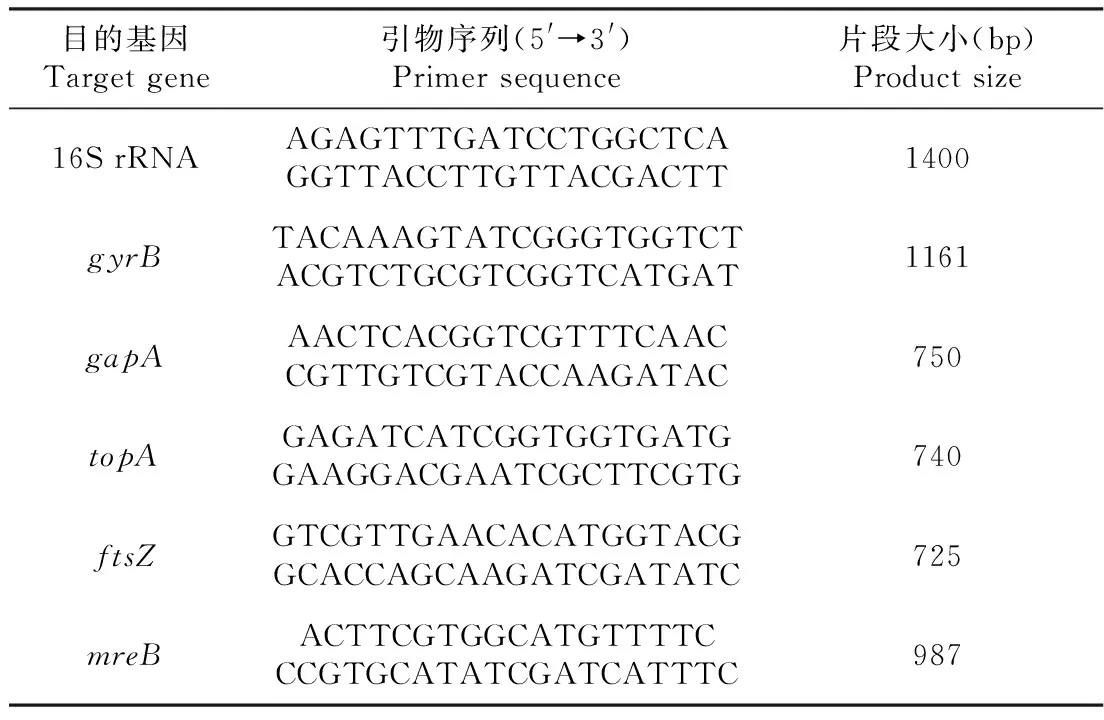
表1 特异性引物序列Table 1 The specific primers used for PCR analysis
PCR产物回收纯化和测序:引物合成、PCR产物纯化和测序均委托广州擎科生物技术有限公司完成。将所得序列在GenBank中进行BLAST比对,利用Clustal X和MEGA 7.0进行序列同源分析和构建系统发育进化树。
1.4.3 多位序列分析 多基因序列扩增:参照Labella等[17]的方法,选取gapA(甘油醛-3-磷酸脱氢酶A)、topA(DNA拓扑异构酶I)、mreB(细胞壁结构复合物MreBCD)、ftsZ(GTP微管蛋白结合)和gyrB(细胞分裂蛋白)基因进行多位序列分析。参考1.4.2的方法进行PCR扩增(退火温度均为55 ℃)。
PCR产物胶回收纯化:参考天根生化科技(北京)有限公司的通用型DNA纯化回收试剂盒说明进行PCR产物纯化回收。
连接:参考TaKaRa克隆载体pMD19-T Vector试剂盒操作说明进行PCR产物克隆,反应体系:Solution I 5.0 μL,pMD19-T Vector 1.0 μL,DNA模板4.0 μL。配置好后混匀,16 ℃过夜。
转化:取出-80 ℃保存的DH5a感受态细胞,置冰上融化后加入于含连接的产物中,轻微旋转离心管以混匀内容物,冰浴30 min;将离心管置于42 ℃热激60~90 s后迅速冰浴2~3 min;向每个离心管中加入500.0 μL LB培养基(不含抗生素),混匀后置于37 ℃摇床振荡培养45 min(150 r/min);将离心管内容物混匀,吸取100.0~400.0 μL加入含Amp+的LB培养基上均匀涂开。将LB培养基置于室温下至液体全部被吸收,37 ℃下倒置培养过夜。
转化子筛选和鉴定:用无菌枪头挑取LB培养基上3~5个单菌落,分别接种于3.5 mL LB液体培养基中(含100.0 g/mL Amp),37 ℃下165 r/min振荡培养10~12 h;以5.0 μL菌液为模板,进行PCR鉴定(反应体系50.0 μL),操作步骤同1.4.3中的多基因序列扩增。阳性菌液委托广州擎科生物技术有限公司测序鉴定,余下菌液4 ℃保存备用;测序结果在GenBank数据库中进行BLAST比对。使用MEGA 6.0中的Neighbour-joining构建系统发育进化树,Bootstrap值设置为1000次。
1.5 药物敏感性试验
采用纸片扩散法,将培养24 h的细菌培养物用灭菌PBS洗下后,将菌液浓度稀释至1.0×108CFU/mL,取0.2 mL菌悬液涂布于TSA培养基。选择12种药敏纸片(恩诺沙星、氧氟沙星、环丙沙星、复方新诺明、头孢氨苄、链霉素、庆大霉素、罗红霉素、阿莫西林、头孢拉啶、新生霉素和利福平)匀贴于培养基上,每种药敏片设3个平行试验,28 ℃培养24 h后测量抑菌圈直径,根据说明书的标准确定分离菌株20210120对不同抗生素的敏感性。
2 结果与分析
2.1 病原菌分离
从图1可看出,菌株20210120在血琼脂培养基上生长较好(图1-A);28 ℃培养24 h后,菌株20210120的菌落直径约2.0 mm,圆形,乳白色,中心隆起,表面光滑,边缘整齐;革兰氏染色呈阴性,菌体宽0.6~1.1 μm、长2.3~3.3 μm(图1-B)。说明菌株20210120在血琼脂培养基上生长良好,菌落较小。

图1 菌株20210120的革兰氏染色(1000×)Fig.1 Gram staining of 20210120 strain(1000×)
2.2 人工感染试验
由表2可知,对健康双棘黄姑鱼腹腔注射菌株20210120的菌悬液后,各感染组双棘黄姑鱼陆续出现死亡。其中,5.0×107CFU/尾处理组试验鱼全部死亡(注射后3 d内出现大量死亡,6 d内全部死亡);10 d后各处理组试验鱼均不再死亡;在整个试验过程(14 d)中,对照组的试验鱼未发生死亡,5.0×106和5.0×105CFU/尾处理组试验鱼的死亡率分别为90.00%和75.00%,5.0×104和5.0×103CFU/尾处理组试验鱼的死亡率较低,分别为40.00%和10.00%。同时,从感染死亡的双棘黄姑鱼肾脏中均分离到相同病原菌。可见,分离到的菌株20210120能使健康双棘黄姑鱼致病,且毒性较强,经Reed-Muench法测得感染14 d该菌对双棘黄姑鱼(61.38±5.14)g的半数致死量(LD50)为1.59×102CFU/g。人工感染症状与自然发病症状相似,表现为鳍条基部出血,眼浑浊,空肠、肠壁出血,腹水,胆汁稀少,肝脏肿大变白,离群慢游,并伴有每天数尾到数十尾死亡。
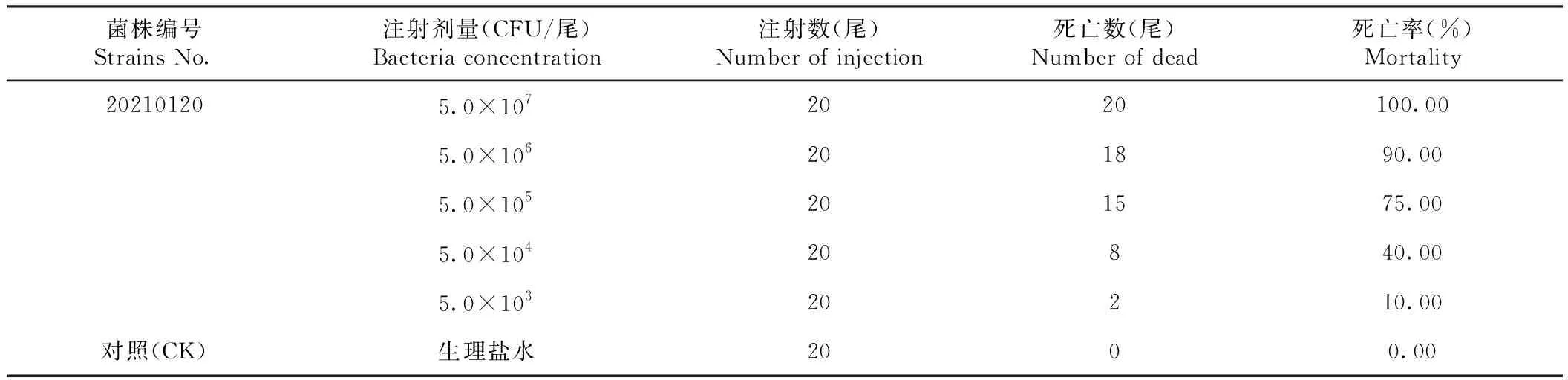
表2 菌株20210120的人工感染试验(14 d)结果Table 2 Results of artificial infection of the 20210120 strain(14 d)
2.3 16S rRNA序列分析及系统发育进化树构建
PCR产物经DNA双向测序,将测得的16S rRNA序列与GenBank中的16S rRNA序列进行BLAST比对分析,结果(图2)发现,菌株20210120与已报道托鲁尼发光杆菌(登录号KX855661)的16S rRNA序列相似性最高(99.93%);基于16S rRNA序列相似性构建的系统发育进化树分析结果(图3)也显示,菌株20210120与托鲁尼发光杆菌聚成一簇。因此,初步鉴定菌株20210120属于托鲁尼发光杆菌。

图2 菌株20210120的16S rRNA序列测序Fig.2 16S rRNA sequencing of strain 20210120
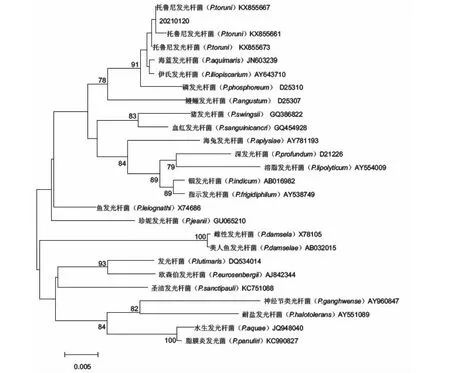
图3 菌株20210120与其他同属不同种发光杆菌16S rRNA序列的聚类分析Fig.3 Cluster analysis of strain 20210120 and 16S rRNA sequences from other different species of Photobacterium
2.4 多基因序列分析及系统发育进化树构建
选择6个管家基因(16S rRNA、gyrB、gapA、topA、ftsZ和mreB)序列,使用MEGA 6.0对连接的16S rRNA序列(3700 bp)进行比对并进一步构建系统发育进化树,结果(图4)表明,菌株20210120与托鲁尼发光杆菌形成一个独立的簇,且与其他5个管家基因的相似性分别为99.50%(gyrB)、99.44%(mreB)、100.00%(topA)、99.86%(gapA)和99.83%(ftsZ)。因此,综合文献[17,23-24]的结论和图4的分析结果,可确定菌株20210120为托鲁尼发光杆菌。

图4 6个基因(16S rRNA、gyrB、gapA、topA、ftsZ和mreB)序列相似性构建的系统发育进化树Fig.4 Neighbor joining phylogenetic tree based on six concatenated genes(16S rRNA,gyrB,gapA,topA,ftsZ and mreB) sequence similarity
2.5 菌株20210120的药敏试验
由表3可知,在对12种抗生素的敏感性试验结果中,菌株20210120对喹诺酮类药物(恩诺沙星、氧氟沙星和环丙沙星)、磺胺类药物(复方新诺明)、β-内酰胺酶类(头孢氨苄)、氨基糖苷类抗生素(链霉素和庆大霉素)7种药物敏感,对罗红霉素、阿莫西林、头孢拉啶和新生霉素4种药物耐药,对利福平中等敏感。说明恩诺沙星、氧氟沙星、环丙沙星、复方新诺明、头孢氨苄、庆大霉素和链霉素可作为防治双棘黄姑鱼托鲁尼发光杆菌的备选药物。根据农业农村部发布的《水产养殖用药明白纸》2020年 1号和2号文件,恩诺沙星是农业农村部批准使用药物目录中的药物,因此,建议选用恩诺沙星对双棘黄姑鱼托鲁尼发光杆菌进行防治。

表3 菌株20210120的药敏试验结果Table 3 The results of the drugs sensitivity test on 20210120 strain
3 讨 论
对病原细菌进行形态学观察、生理生化分析和基因序列分析,可确保鉴定结果的可靠性[17-20]。本研究从广西北海铁山港网箱养殖的患病双棘黄姑鱼肾脏分离到1株病原菌20210120,通过16S rRNA序列测序并构建系统发育进化树,结果显示分离菌株与GenBank中的托鲁尼发光杆菌聚为一簇,16S rRNA序列相似性达99.93%;由于目前缺乏病原菌20210120的标准菌株,因此未能进行生理生化指标验证,但参考Labella等[17]的方法利用6个管家基因(16S rRNA、gyrB、gapA、topA、ftsZ和mreB)进行多位点序列分析验证,结果发现菌株20210120与托鲁尼发光杆菌形成一个独立分支,证实其为托鲁尼发光杆菌;双棘黄姑鱼的发病季节为冬季低温季节,感染鱼体的体重为150.00~250.00 g,与Labella等[17]报道感染托鲁尼发光杆菌海鲷的体重相近,但发病季节不同,推测托鲁尼发光杆菌能导致150.00~250.00 g规格的海水鱼发病,而发病季节存在差异是由鱼种不同或地理位置不同引起。
发光杆菌属隶属于弧菌科,其中有些发光杆菌对鱼类致病性较强,如美人鱼发光杆菌可感染多种鱼类,且具有高致病性[12,18-20]。感染发光杆菌后,患病鱼类表现的症状存在明显差异。王瑞旋等[20]报道2006年从海南省陵水患病的卵形鲳鯵分离出美人鱼发光杆菌杀鱼亚种,病鱼体表完好,脾脏和肾脏出现灰白色结节;邵蓬等[18]报道2018年天津市感染美人鱼发光杆菌美人鱼亚种的半滑舌鳎大量死亡,腹腔严重肿胀,腹部两侧肌肉出血,肠道和肝脏也有大量出血。本研究中,感染托鲁尼发光杆菌双棘黄姑鱼的症状有出血和腹部胀大,与邵蓬等[18]报道的半滑舌鳎感病症状相似,推测托鲁尼发光杆菌也像美人鱼发光杆菌美人鱼亚种一样感染海水鱼并致死。本研究发现的养殖双棘黄姑鱼感染托鲁尼发光杆菌尚属首次报道,该菌的病原在症状上与以往报道的黄姑鱼创伤弧菌病[25]、哈维氏弧菌病[26]、溶藻弧菌病[27]相似,均出现鳍条出血、肝脏胀大和空肠症状。但目前对于托鲁尼发光杆菌的致病机制及危害程度的了解甚少,有待后续深入探究。
托鲁尼发光杆菌分离后需及时开展病原菌药敏试验,以便指导养殖户科学用药。已有研究表明,恩诺沙星对革兰氏阴性菌有很强的杀灭作用,可控制致病菌引起的危害[28-29]。本研究药敏试验结果表明,菌株20210120对喹诺酮类药物(恩诺沙星、氧氟沙星和环丙沙星)、磺胺类药物(复方新诺明)、β-内酰胺酶类(头孢氨苄)和氨基糖苷类抗生素(链霉素和庆大霉素)等表现敏感。结合农业农村部《水产养殖用药明白纸》文件中批准使用的药物目录,建议选用恩诺沙星对双棘黄姑鱼托鲁尼发光杆菌进行防治。
4 结 论
托鲁尼发光杆菌是引起广西北海双棘黄姑鱼发病死亡的病原菌,对喹诺酮类药物(恩诺沙星、氧氟沙星和环丙沙星)、磺胺类药物(复方新诺明)、β-内酰胺酶类(头孢氨苄)和氨基糖苷类抗生素(链霉素和庆大霉素)等表现敏感,实际生产中可考虑将该7种药物作为防治双棘黄姑鱼托鲁尼发光杆菌引起相关疾病的药物使用,尤其推荐使用恩诺沙星。

