兔BMP4基因对毛囊发育相关基因表达的影响
张 琛,李佳丽,靳荣帅,白少成,姚 凡,赵博昊,陈 阳,吴信生
(扬州大学动物科学与技术学院,江苏 扬州 225009)
【研究意义】毛囊是哺乳动物特有的皮肤组织,毛囊发育存在周期性并具备自我再生能力。动物的整体毛发发育与毛囊呈正相关[1]。目前,已有不少影响哺乳动物家兔毛囊发育的基因因子被鉴定[2],如表皮生长因子(Epidermal Growth Factor, EGF)、成纤维生长因子(Fibroblast Growth Factor, FGF)、角蛋白(Keratin)和角蛋白相关蛋白(Keratin Association Protein, KAPs)、类胰岛素生长因子(Insulion-Like Growth Factor, IGF)等。骨形态发生蛋白(Bone Morphogenetic Protein,BMP)参与毛囊的生长发育,BMP 信号通路在动物毛发生长过程中发挥重要作用[3]。【前人的研究进展】骨形态发生蛋白4(Bone Morphogenetic Protein 4,BMP4)隶属于BMPs家族,其作用是抑制毛囊发育,进而调控毛囊形状、大小和位置[4]。Shh和FGF4促进BMP4的表达,但是BMP4会抑制毛囊发育,进而阻碍FGF4和Shh的表达[5]。毛乳头细胞(Dermal papilla cells, DPCs)是真皮源性细胞,是毛囊生长、分化的必要信号因子,位于毛囊的基底部[6],在毛囊周期变化过程中起着重要的作用[7]。【本研究切入点】毛乳头细胞作为毛囊发育的信号中心,本文通过构建BMP4基因过表达载体,并转染至家兔毛乳头细胞中,检测其对下游相关基因表达的影响,进而验证BMP4基因对下游基因的调控作用。【拟解决的关键问题】为进一步研究BMP4对兔毛乳头细胞的影响奠定基础。
1 材料与方法
1.1 家兔毛乳细胞的分离与鉴定
首先进行毛乳头细胞的分离,用眼科剪将獭兔两边的触须垂直与皮肤剪下,放入装有D-Hank’s液的培养皿中进行清洗;70%酒精浸泡1 min,用添加双抗的PBS冲洗,除去不规则组织。将采集的样品进行裁剪,裁剪成长条状组织块,并放置于无菌细胞培养皿里,缓慢加入0.25%中性蛋白酶,直至浸没组织块,4 ℃孵育16~24 h,移除蛋白酶液。在新培养皿中,用精细镊和眼科剪分离毛囊,转移到10 mm × 35 mm培养皿中。显微镜下用手术刀将毛球部分离,清除周围其他组织。将分离的单个毛囊放入35 mm培养皿中,加入胶原酶2 mL,37 ℃孵育5~6 h,也可4 ℃过夜消化[8]。
细胞生长至培养瓶70%~80%时,开始转染实验,转染试剂Lipofectamine 3000,具体操作步骤按照试剂盒说明书。设置pcDNA3.1空载组和pcDNA3.1-BMP4过表达组,每个组3个重复。37 ℃培养10 h后进行换液处理,48 h后收细胞。
1.2 仪器与试剂
实验所用的主要试剂和器材如表1~表2所示。
表2 实验所用的主要器材Table 2 Main equipment used in the experiment
1.3 兔BMP4基因CDS序列的扩增与克隆
NCBI上查找兔BMP4基因序列(NP_001182652.1)。查找pcDNA3.1载体上的酶切位点。一步克隆软件(CE Design V1.04)设计BMP4特异性扩增引物。BMP4基因上游引物为:5′-tagtccagtgtggtggaattcATGATTCCTGGTAACCGAATGC-3′;下游为:5′-ggtttaaacgggccctctagaTCAGCGGCACCCAC ACCC-3′。
使用总RNA提取试剂盒提取兔皮肤组织RNA,再通过核酸蛋白分析仪对提取的RNA进行浓度和纯度检测,然后将其反转录成cDNA作为下一步高保真酶PCR扩增的模板,进行PCR扩增。反应体系:50 μL,上游引物和下游引物各2 μL、2 × Phanta Max Buffer 25 μL、dNTP Mix 1 μL、Phanta Max Super-Fidelity DNA Polymerase 1 μL、模版1 μL、ddH2O 18 μL。扩增程序:95 ℃ 3 min;95 ℃ 15 s,65.5 ℃ 15 s,72 ℃ 2 min,35个循环;72 ℃ 5 min;4 ℃保存。琼脂糖凝胶电泳检测反应产物,南京擎科生物科技有限公司测序。
1.4 BMP4生物信息学分析
ProtParam用于预测BMP4编码蛋白的等电点、分子式、分子量和不稳定性系数(http://web.expasy.org/protparam/)[9]。信号肽预测用SignalP 4.1(http://www.cbs.dtu.dk/services/SignalP-4.1/)[10]。分析分泌蛋白、定位信号和蛋白跨膜区域用TMHMM 2.0(http://www.cbs.dtu.dk/services/TMHMM/)[11]。潜在的丝氨酸、苏氨酸或酪氨酸磷酸化位点预测用NetPhos 3.1 Server(http://www.cbs.dtu.dk/services/NetPhos/)[12]。蛋白质二级结构预测用Hopfield(http://npsa-pbil.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_gor4.html)[13]。推测蛋白质结构保守域和三维同源性用SWISS-MODEL[14]。
1.5 BMP4过表达载体的构建与鉴定
将BMP4扩增产物和pcDNA3.1质粒用EcoI和XbaI快切酶进行双酶切,用T4DNA连接酶连接。然后转化至大肠杆菌DH5α细胞中并均匀涂抹至含有氨苄青霉素的LB琼脂板上,在37 ℃条件下,培养12 h。然后进行选择单菌落PCR,阳性克隆液送擎科生物科技有限公司测序,用SeqBuilder软件进行序列分析。使用测序正确的克隆菌液提取质粒备用。
1.6 CCK-8检测细胞增殖
兔毛乳头细胞在24孔板内培养48 h后,将细胞分别接种于4个96孔板内以检测0、24、48、72 h时的细胞增殖状况。待细胞贴壁后,吸出培养基。在每孔内分别加入10 μL CCK-8溶剂,放入细胞培养箱孵育4 h,放入酶标仪检测吸光度OD450值,记为0 h。以后每24 h用同样的方法测量1次,共4次。
1.7 荧光定量PCR
提取兔毛乳头细胞中的RNA。细胞在24孔板底部长至95%,收集细胞,按照RNA提取试剂盒说明书提取RNA。将提取的RNA进行浓度和纯度测定,并反转录成cDNA。使用软件Primer Premier 5.0设计BMP4、ID1、ID2、SMAD7、FGF1、TGF-β基因引物。具体引物信息如表2所示(其中GAPDH为内参基因)。

表2 引物信息Table 2 Primer information
1.8 数据分析
SPSS 22.0分析数据,方法为成对T检验,采用2-△△Ct法进行分析,每组3个重复。*P<0.01为差异极显著,**P<0.05为差异显著。
2 结果与分析
2.1 兔毛乳头细胞的鉴定
兔毛乳头细胞分离培养后,用标志性基因α-平滑肌肌动蛋白(α-SMA)和波形蛋白(VIM)进行免疫荧光检测。特异性标记物α-SMA及毛囊真皮源性细胞标记物VIM均呈现绿色荧光,为阳性表达,DAPI核染定位显示,细胞核中有蓝色荧光(图1)。
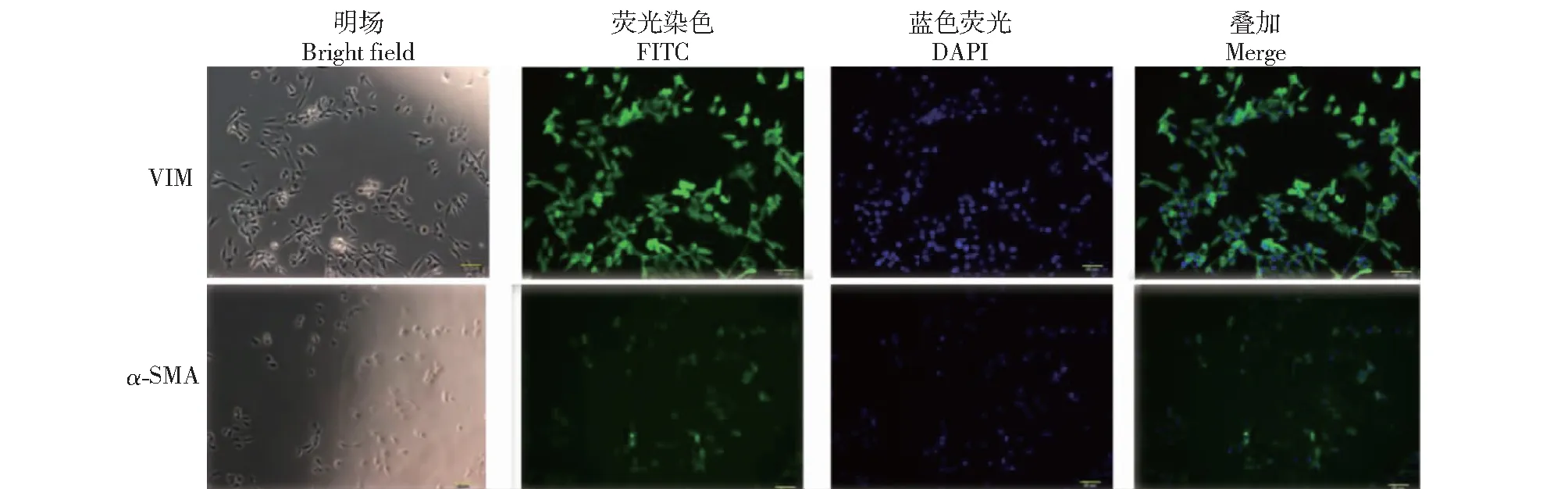
图1 兔毛乳头细胞的免疫荧光染色鉴定Fig.1 Identification of rabbit hair papilla cells by immunofluorescence staining
2.2 BMP4基因的克隆
对兔BMP4基因片段进行扩增,获得与预期片段大小一致的明亮条带,长度为1230 bp(图2-A)。菌液PCR的电泳分析(图2-B)显示,在目的基因处可见明亮条带。
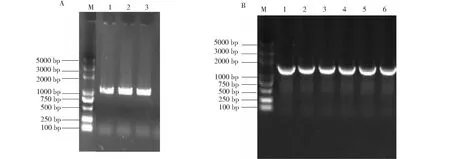
M.DL 5000 DNA 分子标记。A.BMP4基因扩增结果;1,2,3为目的基因BMP4基因条带。B.BMP4基因菌液PCR结果;1,2,3,4,5,6为目的基因BMP4基因条带M.DL 5000 DNA marker.A.BMP4 gene amplification results;1, 2 and 3 were both BMP4 gene bands of the target gene.B.PCR results of BMP4 gene bacterial;1,2,3,4,5,6 were the bands of the target gene BMP4图2 BMP4基因克隆Fig.2 Cloning of BMP4 genesolution
2.3 BMP4基因生物信息学分析
兔BMP4基因CDS区序列全长1230 bp,编码409个氨基酸,2个外显子,BLAST分析表明该序列与NCBI发布的序列(NP_001182652.1)完全一致,并位于第17号染色体上。BMP4蛋白的分子量为46 511.76,分子式为C2043H3205N623O592S17,pI理论值为8.73,带正电荷的残基总数为51,带负电荷的残基总数为46,表明该蛋白整体上带正电荷。亲水性的总体平均值为-0.571,预计不稳定性指数(II)为59.56,表明该蛋白为不稳定蛋白。脂肪族指数为77.46。具有稳定的信号肽(图3-A),切割位点最高为0.554,位于第25个氨基酸残基,而位于第16个氨基酸残基处信号肽区域的最高值为0.953;信号肽得分(第1至24个氨基酸残基)为0.872。不包含跨膜结构域,细胞质中N末端的总概率为0.10364(图3-B)。
BMP4蛋白的11个丝氨酸、3个苏氨酸和3个酪氨酸具有假定的磷酸化位点。在编码的409个氨基酸中,有128个氨基酸(31.30%)形成了α-螺旋,76个氨基酸(18.58%)形成了一条延伸链,而205个氨基酸(50.12%)形成一个无规则卷曲(图3-C)。预测的蛋白三级结构如3-D所示。
2.4 BMP4基因过表达对毛囊发育相关基因的影响
实时荧光定量PCR结果显示,过表达BMP4基因后其mRNA水平显著提高(P<0.01,图4-A)。
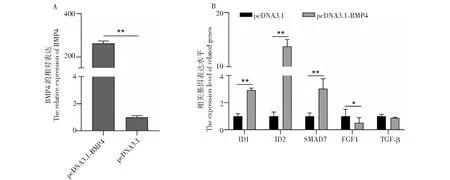
A.过表达后的BMP4 mRNA表达水平;B.下游基因表达水平A.mRNA expression level after overexpression;B.Downstream gene expression level图4 BMP4过表达对相关基因的影响Fig.4 Effects of BMP4 overexpression on related genes
BMP4基因过表达后,其下游基因ID1、SMAD7和ID2的表达量与对照组相比显著升高(P<0.01),FGF1的表达量显著降低(P<0.05,图4-B)。
2.5 过表达BMP4会抑制细胞增值
CCK-8实验显示,随着时间的延长,相比对照组pcDNA3.1,过表达BMP4组细胞增值能力逐渐减弱,在72 h时差异极显著(P<0.01,图5)。
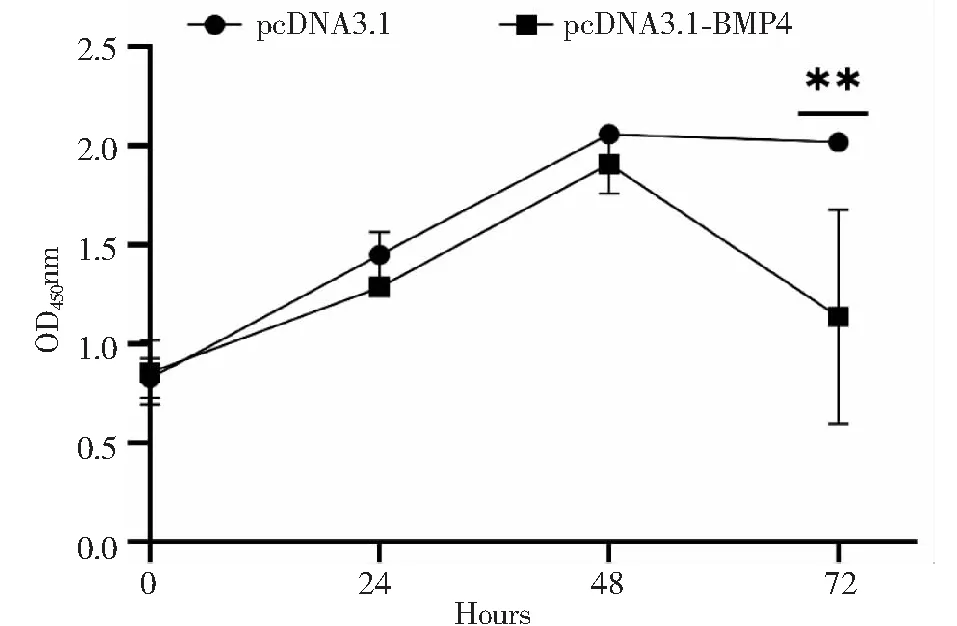
图5 过表达BMP4基因对细胞增殖的影响Fig.5 Effect of overexpression of BMP4 gene on cell proliferation
3 讨 论
毛囊是哺乳动物具有周期性再生功能的皮肤附属器官,毛囊的结构和性状会影响毛用动物的被毛质量以及品质。毛乳头细胞是毛囊中重要的真皮成分,产生多种针对上皮细胞的调节因子,可诱导上皮细胞增殖分化,进而形成毛囊[15]。在裸鼠中,将毛乳头细胞与表皮细胞一起移植会诱导毛囊产生。当毛乳头细胞与毛囊上皮一起培养时,会促进毛囊上皮的生长[16]。
毛乳头细胞与毛囊其他真皮细胞不同,毛乳头细胞能表达特定的基因及蛋白[17]。α平滑肌肌动蛋白(α-SMA),一种已知的毛乳头细胞标记物[18]。波形蛋白(VIM)是毛囊真皮源性细胞标记物,用来鉴别真皮源性细胞与表皮源性细胞[19]。有研究采用中性蛋白酶与胶原酶两步消化法及预铺设鼠尾胶原促貼壁基质相结合,检测到α-SMA和VIM的表达,成功分离并纯化家兔毛乳头细胞[20]。有研究采用一步酶消化法对胎儿头皮毛乳头细胞进行分离,并使用雌二醇处理原代毛乳头细胞,发现雌二醇显著调节人毛乳头细胞生物钟基因的表达水平[21]。本实验免疫荧光结果显示分离出的细胞表达α-SMA和VIM,表明分离的细胞为毛乳头细胞。
BMP信号通路在皮肤的发育过程中起关键作用[22-23]。BMP信号可以通过抑制皮肤形态发生过程中毛囊分化促进表皮发育[24-25]。研究发现,在皮肤受损愈合过程中,BMP4的表达受到抑制[26]。通过对鹅BMP4基因的部分进行扩增,并与其他动物进行比较,发现BMP4基因可能是影响毛发形态的因素之一[27]。BMP4不仅会影响动物的毛发形态,并且在毛囊和羽毛发生发育过程中有表达且主要起负调控作用[28]。BMP4基因在绒山羊毛囊发育过程中,退行期时表达量最高,并且随着毛囊周期发育逐渐降低[29]。本研究通过对敲除和过表达BMP4基因细胞增殖情况进行鉴定,发现过表达BMP4基因会抑制毛乳头细胞的生长。研究表明,FGF-1通过诱导毛囊生长期毛囊数量和大小增长,促进毛囊生长[30]。本研究中,BMP4过表达对FGF-1有抑制作用,与BMP4在其他物种上的已知功能一致。Id基因家族中,ID1、ID2和ID3是典型BMP信号通路中磷酸SMADS的直接靶标,对BMP刺激高度敏感[31-32]。研究发现,通过在毛乳头细胞中过表达BMP4导致ID1、ID2、SAMD7的mRNA表达水平显著升高,与已有研究结果一致。
4 结 论
BMP4共编码409个氨基酸,为亲水性外分泌蛋白,含有1个信号肽序列,无跨膜结构域。过表达BMP4可调控兔毛乳头细胞中ID1、ID2、SMAD7的mRNA表达,抑制毛乳头细胞增殖,参与家兔毛囊的生长发育。

