足三里和肾腧穴位埋线对大鼠类风湿关节炎NF-κB信号通路的影响*
陈丽川, 段 波, 喻 昭, 马志毅, 孟倩文
(武汉市中医医院风湿病科针灸科,湖北 武汉 430050)
类风湿关节炎(rheumatoid arthritis,RA)是一种由遗传因素以及环境因素引起的疾病,其特征在于关节、软骨和骨骼的滑膜组织及较少见的关节外部位的炎症变化[1]。炎症进一步引起关节疼痛、肿胀和随后的软骨及骨骼破坏,因此RA 最终导致功能缺损、残疾和死亡率增加[1-2]。目前药物治疗仍是治疗RA 的主要方法,早期的药物通常采用非甾体抗炎药和糖皮质激素等,但这些药物并不能起到治愈性或预防性的作用[3]。对于RA 进展到后期的病人而言,手术介入有治疗效果,但也有相当大的风险[4]。
穴位埋线(acupoint catgut embedding,ACE)是古代传统针灸与现代疗法相结合的延伸和发展。它通过在穴位内嵌入的可吸收羊肠线产生持久的刺激,再加上其易于操作和长期作用的特性,常被用于治疗RA[5-6]。研究表明,足三里和肾腧穴埋线能减轻RA 的炎症反应,同时可下调滑膜细胞MMP-2 和MMP-9 的表达[7-8]。目前关于 ACE 治疗 RA 的作用机制研究较少,因此本研究采用ACE 联合药物干预大鼠RA 并探讨其中核因子κB(nuclear factor-κB,NF-κB)信号通路的改变。
材料和方法
1 材料
1.1 动物 SPF 级雌性 SD 大鼠 30 只,8 周龄,体重为150~180 g,来源于三峡大学,实验动物使用许可证号为SYXK(鄂)2018-0104;于温度22~26 ℃,相对湿度50%~60%的饲养条件下进行饲养,人工光照明暗各12 h。在本次实验过程中,按照《实验动物管理条例》等相关文件标准进行饲养与处置。
1.2 试剂 戊巴比妥钠和完全弗氏佐剂(Sigma);来氟米特(leflunomide,LEF)购自上海阿拉丁生化科技股份有限公司;苏木素和伊红(上海碧云天生物技术有限公司);中性树脂(国药集团上海有限公司);大鼠白细胞介素6(interleukin-6,IL-6)和IL-8酶联免疫吸附试剂盒、GAPDH 抗体、羊抗兔蛋白Ⅱ抗及NF-κB p65抗体(Bioswamp);蛋白质Marker(Helix);化学发光试剂(Millipore);p-p65抗体(Cell Signaling Technology);MaxVisionTMHRP-Polymer anti-Mouse/Rabbit IHC Kit(福州迈新生物技术开发有限公司)。
1.3 仪器 正置显微镜和石蜡切片机(Leica);生物组织包埋机(孝感阔海医疗科技有限公司);酶标仪(Thermo Fisher);电泳仪(Bio-Rad);全自动化学发光分析仪(上海天能科技有限公司)
2 方法
2.1 大鼠RA 模型的构建与鉴定 大鼠右后足趾皮下注射0.1 mL完全弗氏佐剂构建大鼠RA 模型[9],对照组不注射完全弗氏佐剂,注射等体积PBS。免疫大鼠右后足24 h后开始出现明显红肿;在5~6 d后出现一个炎症高峰,跖骨和足骨出现多处红斑,足趾明显肿胀;11~12 d 出现次级炎症高峰;20 d 后免疫的大鼠右后足严重红肿,大鼠行走受限,即可判定造模成功。
2.2 分组及处理 将30 只大鼠随机分为5 组:对照组、模型组、LEF 组、ACE 组和 ACE+LEF 组,每组 6只。除对照组外,其他组均按照2.1 的方法进行造模。各组于造模第10 天开始治疗,对照组与模型组每天灌胃生理盐水1 次,连续42 d;LEF 组每天灌胃LEF(10 mg·kg-1·d-1),连续 42 d;ACE 组采用主穴双侧“足三里”和“肾腧”埋线,参照“大鼠穴位图谱”,分别作穴区定位。将大鼠俯卧位固定,外展拉直后肢,将已预先置入0.8 cm 长无菌羊肠线的9 号针头,刺入已常规消毒的双侧“足三里”和“肾腧”,将肠线完全置入穴内。治疗时间共42 d,埋线3 次,每14 d 一次。ACE+LEF 组每天灌胃 LEF(10 mg·kg-1·d-1),连续42 d,灌胃的同时按照ACE 组的方法进行穴位埋线,每14 d一次,埋线3次[10]。
2.3 关节炎指数评分 大鼠免疫后每7 d 进行关节炎指数评分[11]。根据大鼠踝关节、跖趾关节和趾关节红肿程度及受影响关节数进行评分:正常记0 分;踝或腕关节出现轻微红斑、肿胀记1 分;后足踝关节及跗骨出现红斑和肿胀记2 分;踝关节至跖骨处或掌关节出现红斑和中度肿胀记3 分;踝关节至跖骨处严重肿胀和红斑,且不能负重记4 分。分别对四肢进行评分,累计总和即为关节炎指数。
2.4 血液及组织样本采集 在第42 天,用3%的戊巴比妥钠麻醉大鼠,收集每只小鼠的颈动脉血和滑膜组织样本,保存备用。
2.5 HE 染色观察大鼠滑膜组织变化 将大鼠滑膜组织固定,切取大约300 μm 的厚度,进行脱水浸蜡包埋操作,包埋后切片,切片厚度为3 μm,水浴后将切片贴附于载玻片上,控片,展片后及时烤片。根据步骤进行HE 染色,光学显微镜下观察拍照,Leica Application Suite图象系统进行分析。
2.6 ELISA 检测大鼠血清中炎症因子水平 将血液样本置于4 ℃冰箱中静置1 h,呈45°角放置,3 000×g离 心 5 min 收 集 血 清 。 根 据 Bioswamp 的ELISA 试剂盒说明书进行各组样品中炎症因子IL-6和IL-8含量的检测。
2.7 免疫组化检测大鼠滑膜组织NF-κB p65蛋白的表达 首先固定滑膜组织,冲洗后置于包埋盒内,脱水浸蜡包埋。将蜡块切成厚度为约4 μm 的切片,烤片,3% H2O2孵育 10 min。加入 0.5% BSA 封闭 30 min,PBS清洗3次。加入Ⅰ抗稀释液,4 ℃孵育过夜,PBS 清洗3 次。加入Ⅱ抗稀释液,室温孵育30 min,PBS 清洗3 次。苏木素复染3 min,流水冲洗后乙醇脱水,二甲苯透明,中性树脂封片,光学显微镜观察拍照(×200)。
2.8 Western blot 检测大鼠滑膜组织p-p65 蛋白水平 滑膜组织剪碎后加入裂解液,使用匀浆器充分裂解。4 ℃、12 000×g离心15 min,取上清,进行蛋白质定量。将各组样品于10%的SDS-PAGE 分离,湿转至PVDF 膜。PVDF 膜放入5%的脱脂牛奶中,室温摇床封闭2 h。分别加入Ⅰ抗(p-p65 和GADPH 抗体,1∶1 000)于4 ℃孵育过夜。洗膜3次后,加入山羊抗兔Ⅱ抗(1∶10 000),室温孵育1 h。洗膜3 次后,将膜置于暗室中,发光液混匀后加在膜的正面与膜充分接触。最后置于全自动化学发光分析仪中检测,利用TANON GIS软件读取灰度值。
3 统计学处理
采用SPSS 19.0 软件进行数据分析,GraphPad Prism 8.0 软件作图。计量资料以均数±标准差(mean±SD)表示。多组间比较使用单因素方差分析。以P<0.05为差异有统计学意义。
结 果
1 大鼠RA模型关节炎指数
如图1 所示,造模49 d 后,与对照组相比,模型组大鼠关节炎指数显著升高(P<0.01);与模型组相比,LEF 组、ACE 组和 ACE+LEF 组关节炎指数均显著下降(P<0.01);其中ACE+LEF 组治疗后关节炎指数较LEF组和ACE组更低,治疗效果最佳。此外,在治疗过程中关节炎指数略有增加,但随着治疗时间的延长关节炎指数呈下降趋势。
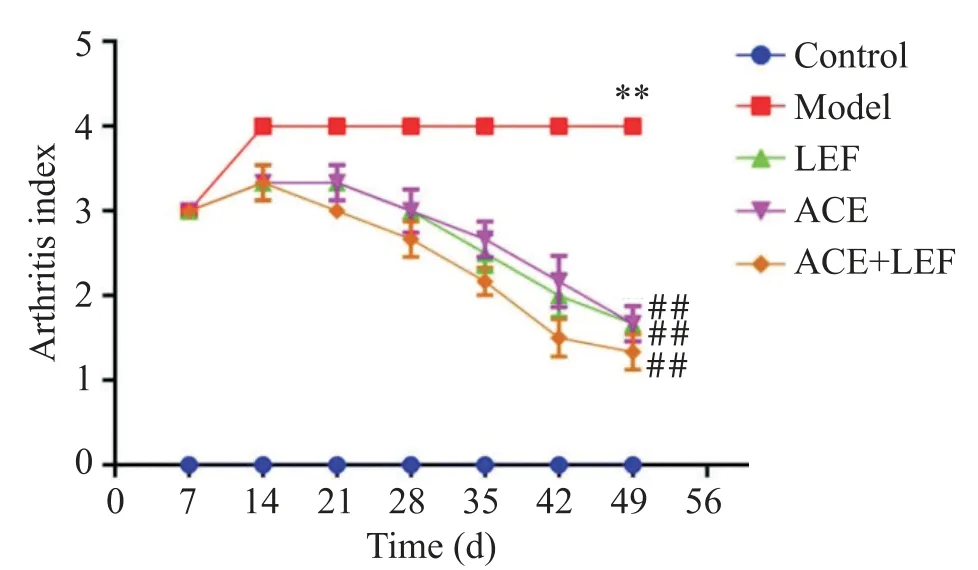
Figure 1. Comparison of arthritis index in each group. Mean±SD. n=6.**P<0.01 vs control group;##P<0.01 vs model group.图1 各组关节炎指数比较
2 大鼠滑膜组织HE染色结果
如图2 所示,对照组显示出正常的关节软骨结构,没有炎症细胞浸润;模型组大鼠表现出滑膜增生,滑膜组织中炎症细胞浸润,关节软骨侵蚀;ACE及LEF 治疗的RA 大鼠滑膜细胞增生有所改善,炎症细胞浸润减少;然而,ACE+LEF 组的大鼠表现出轻度的滑膜增生、炎症和软骨侵蚀。

Figure 2. The synovial tissues of rats observed by HE staining(scale bar=50 μm). The arrows indicate inflammatory cell infiltration and cartilage erosion.图2 HE染色观察大鼠滑膜组织
3 大鼠血清IL-6和IL-8含量的变化
ELISA 结果如图3 所示,与对照组相比,模型组大鼠血清IL-6 和IL-8 含量显著升高(P<0.01);与模型组相比,LEF 组、ACE 组和 ACE+LEF 组大鼠血清IL-6 和 IL-8 含量均显著降低(P<0.01),其中 ACE+LEF 组 IL-6 和 IL-8 含量最低;与 ACE 组相比,ACE+LEF组IL-6和IL-8含量显著降低(P<0.01)。
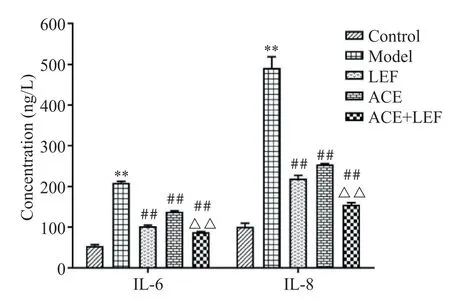
Figure 3. The serum levels of IL-6 and IL-8 in rats. Mean±SD.n=6.**P<0.01 vs control group;##P< 0.01 vs model group;△△P<0.01 vs ACE group.图3 大鼠血清中IL-6和IL-8含量
4 大鼠滑膜组织NF-κB p65表达的变化
免疫组化结果如图4 所示,与对照组相比,模型组大鼠滑膜组织NF-κB p65 阳性表达显著增多(P<0.01);与模型组比较,LEF 组、ACE 组和 ACE+LEF组大鼠滑膜组织NF-κB p65 阳性表达均显著减少(P<0.05),其中ACE+LEF 组的表达最少;与ACE 组相比,ACE+LEF 组 NF-κB p65 阳性表达减少,但差异不显著。
5 大鼠滑膜组织p-p65蛋白水平的比较
Western blot 结果如图5 所示,与对照组相比,模型组大鼠滑膜组织p-p65 蛋白水平显著升高(P<0.01);与模型组相比,ACE 组、LEF 组和 ACE+LEF组大鼠滑膜组织p-p65 蛋白水平均显著降低(P<0.01),其中 ACE+LEF 组 p-p65 水平最低;与 ACE 组相比,ACE+LEF组p-p65水平显著降低(P<0.01)。
讨 论
RA 在全球的发病率达0.5%~1%,主要年龄段在 30~60 岁[12-13],且越来越年轻化。治疗 RA 的药物利用率低,起效较慢,而且可引起严重的副作用[14]。因此,研究其发病机制并寻找有效的治疗方法具有重要意义。目前认为炎症反应的持续作用是RA 病变加重的主要原因[15]。研究显示,CFA 诱导 RA 大鼠模型成功率高、重复性好,广泛用于RA 致病机理的研究。本实验采用CFA 诱导的RA 大鼠模型造模完成后大鼠右后足出现严重红肿,提示本研究模型建立成功。

Figure 5. Comparison of p-p65 protein levels in synovial tissues of rats. Mean±SD. n=6.**P<0.01 vs control group;##P<0.01 vs model group;△△P<0.01 vs ACE group.图5 大鼠滑膜组织p-p65蛋白水平的比较
ACE 能够改善机体的血液循环,促进经络气血疏通,因此可以作为治疗RA 的有效的方法,而且该治疗方法在早年也已得到验证[16]。足三里有固本培元、祛风利湿和通经活络之效果;而肾腧穴滋阴补阳,也具备培元之功,因此本研究采用这两个穴位进行埋线[8]。我们的结果显示,ACE 组大鼠相较于模型组关节炎指数显著下降,提示穴位埋线能够有效缓解关节炎的相关症状。LEF 是用于治疗RA 的常见药物,通常也与其他药物联用[17-18]。本研究采用ACE 和LEF 单独或联合治疗,结果显示,无论单独或联合使用,RA 大鼠的关节炎指数均显著降低,证明ACE对治疗RA具有一定的作用。
滑膜炎症反应是RA 的主要特征之一,本研究显示ACE 及LEF 均能改善RA 大鼠的滑膜细胞增生并缓解炎症细胞浸润,表明RA 大鼠滑膜组织中炎症反应得到了缓解。IL-6 和IL-8 在RA 中起到重要作用,IL-6 通过作用于分泌活性氧中间体和蛋白水解酶的中性粒细胞而引起炎症和关节破坏;IL-8 诱导产生多种细胞因子并增加糖胺聚糖的释放,同时抑制软骨细胞增殖并刺激血管生成继而加重炎症反应[19-20]。我们检测了RA 大鼠血清中IL-6和IL-8的含量,结果显示,ACE 及 LEF 显著减少炎症因子 IL-6 和 IL-8 的产生,而ACE+LEF 组炎症因子含量最低,表明ACE能够显著抑制炎症因子IL-6和IL-8产生,抑制RA 的炎症反应,且联合LEF后的抑制效果更好。
作为经典的炎症通路之一,NF-κB 信号通路在RA 进展中发挥重要的作用,抑制NF-κB 信号传导可以明显缓解关节炎症状[21]。在本研究结果显示,经过ACE 治疗后大鼠滑膜组织中的NF-κB p65 表达降低,证实ACE 通过抑制NF-κB 信号通路发挥抑炎作用。另外,在静息状态下,NF-κB p65 一般由 p50 及p65 形成异二聚体并结合NF-κB 抑制蛋白形成无活性的蛋白复合物,一旦接受外源刺激,NF-κB p65 最终发生磷酸化入核发挥作用[22]。由于经典NF-κB 信号通路主要通过p65 磷酸化发挥作用,因此我们采用Western blot 检测NF-κB p65 磷酸化水平。结果显示经过ACE 治疗后NF-κB p65 磷酸化水平显著下降,证明ACE 能有效抑制NF-κB 信号通路的激活。ACE联合LEF治疗后NF-κB p65磷酸化水平最低,因此进一步证实穴位埋线联合来氟米特具备抑制RA炎症反应的作用。
综上所述,ACE 可通过抑制NF-κB 信号通路进而缓解骨关节炎引起的炎症反应。

