肉鸡骨骼发育的调控机制
王翠月,李明睿,高玉时,陈大伟*
(1. 江苏省家禽科学研究所,扬州 225125; 2. 山东农业大学,泰安 271018; 3. 山西农业大学,太谷 030801)
骨骼发育主要是通过生长板处进行的软骨内骨化完成的,该过程由多种调控因子组成的复杂调控网络精准调控以确保骨骼正常的生长发育。骨骼起保护脏器、支撑体重和维持运动的作用,例如胫骨是肉鸡主要的负重骨骼,强健的胫骨保证了肉鸡正常的生命活动。商品肉鸡体重增长迅速,骨骼生长速度与体重增长速度不匹配,腿部骨骼不足以支撑快速增长的体重,尤其是胸肌的快速生长使肉鸡重心前倾,进一步压迫胫骨并损伤生长板,使其更易患腿病。常见的肉鸡腿病包括胫骨软骨发育不良(TD)、外翻-内翻畸形(VVD)和胫骨短粗等,病鸡表现为行走困难、瘫痪、料肉比高、死淘率高等,严重阻碍了家禽养殖业的发展并引发了动物福利问题。然而,目前对于肉鸡腿病发病的分子机制的研究较少且治疗困难,综述骨形成过程及参与骨骼发育的调控因子对于从骨骼发育角度探究肉鸡腿病的发病机制以及制定合理治疗方案至关重要。
1 骨形成过程
骨形成是一个严格的调控过程,包括膜内成骨和软骨内成骨。膜内成骨发生于胚胎时期,间充质细胞浓缩凝聚并转分化为成骨细胞,主要形成颅骨、锁骨等。为保证躯体大多数骨骼的形成,特别是长骨的发育,间充质干细胞分化为软骨细胞,软骨细胞凝集形成软骨基质模板,即在骨骺处形成生长板结构,通过软骨内骨化来调控骨骼发育。软骨内骨化是长骨发育的第二阶段,肉鸡胫骨和股骨的发育主要是通过该过程驱动的,这一过程一直持续至骨成熟。生长板是机体进行软骨内骨化的场所,主要包括五个区域,从上到下依次是静止区、增殖区、前肥大区、肥大区和成骨区。在软骨内骨化的进程中,静止区是软骨细胞的“补充池”,其具体功能存在争议,但可实现自我更新并进入增殖区形成排列规则、紧密且平行于骨长轴的柱状结构的增殖型软骨细胞,增殖型软骨细胞进行快速增殖以保证足够数量的软骨细胞进行肥大性分化。在增殖区柱状结构的最下端,软骨细胞停止增殖,进入肥大区进行肥大性分化,实现细胞体积的迅速扩大并逐渐形成终末肥大软骨细胞。随后,终末肥大软骨细胞凋亡或转分化为成骨细胞,并形成骨岭和骨化中心,软骨基质随着血管、破骨细胞的侵入逐渐矿化,最终实现成骨取代软骨基质,完成长骨的纵向延伸。研究表明,在福美双诱导肉鸡TD和锰缺乏导致肉鸡腿病时,生长板病变,生长板增殖型和肥大型软骨细胞严重受损。生长板软骨细胞受损会破坏软骨内成骨的进程,严重抑制骨骼发育。软骨细胞增殖和肥大是软骨内骨化的重要步骤,该过程异常会导致骨骼发育异常。软骨内骨化是由多种因子协作调控的,这些因子构成了复杂精密的调控网络确保骨骼正常的生长发育。
2 骨骼发育的调控因子
在骨骼发育的过程中,多种信号通路和转录因子共同调控生长板软骨细胞的增殖、分化、转分化和成骨细胞分化等。调控骨骼发育的转录因子主要包括性别决定基因盒9(SOX9)、Runt相关转录因子2(RUNX2)和肌细胞增强因子2C(MEF2C)等,信号分子主要包括转化生长因子β(TGF-β)、骨形态发生蛋白(主要是BMP2)、成纤维细胞生长因子(FGFs)、血管内皮生长因子(VEGF)、甲状旁腺激素相关肽(PTHrP)和印度刺猬因子(IHH)等。生长板软骨细胞外基质(ECM)主要包括Ⅱ型胶原(COLⅡ)、X型胶原(COLX)和蛋白聚糖(ACAN)等。这些调控因子在生长板各区内特异性表达或不同区内发挥特定调控作用(图1),例如SOX9特异性表达于软骨生成早期、RUNX2和MEF2C主要表达于前肥大和肥大区、PTHrP与前肥大和肥大区的受体Pth1r结合后发挥调控作用等。研究表明,福美双诱导肉鸡发生TD时,BMP2、RUNX2、VEGF、IHH和PTHrP等多种调控因子表达异常,锰缺乏诱导肉鸡发生TD时,TGF-β、MEF2C、COLⅡ和COLX等表达异常,肉鸡患细菌性软骨坏死合并骨髓炎时,SOX9、IHH和ACAN等表达异常。
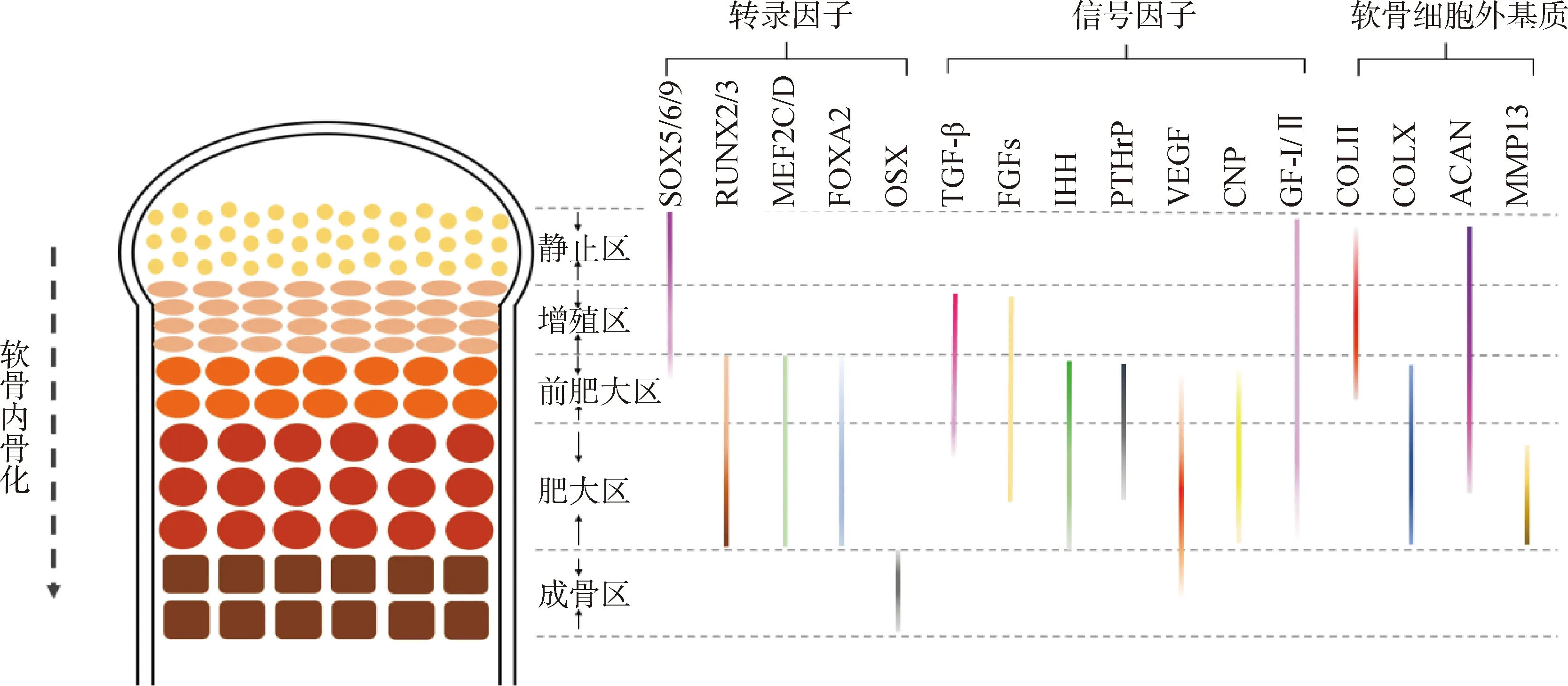
虚线箭头表示从上到下为软骨内骨化的进程(下图同);带颜色实线表示该因子在此区域内表达或发挥主要调控作用,颜色越深表示在此区域表达越高或在此区域内发挥作用越强Dotted arrow indicates the process of endochondral ossification from top to bottom (same as below). The colorful solid lines indicate that the factor is expressed or plays a major regulatory role in this zone. The darker the color, the higher the expression or the stronger the function of the factor in this zone图1 各调控因子在生长板各区的表达情况或在各区内发挥主要调控作用示意图Fig.1 Diagram of the regulatory factors are expressed in different zone or play a major role in certain zones of the growth plate
2.1 骨骼发育相关转录因子
2.1.1 SOX转录因子家族 SOX9正向调控软骨细胞增殖,促进早期软骨细胞形成的标志物(COLⅡ和ACAN)表达。SOX9是调控早期软骨形成的主要转录因子,能够调控SOX5/6表达并与其协同调控软骨细胞增殖。9基因缺失使细胞增殖受阻,导致生长板增殖区变窄。此外,SOX9能够抑制RUNX2的转录活性,降低RUNX2泛素化并驱动RUNX2被溶酶体降解,从而抑制软骨细胞从增殖到前肥大的进程,防止软骨细胞过早肥大。SOX9还可以通过抑制β-catenin信号通路抑制成骨细胞表型的获得,并协同MEF2C激活COLX的表达。因此,SOX9在骨形成的早期阶段和软骨细胞肥大过程中发挥复杂的调控作用,有利于维持骨骼发育及稳态。
2.1.2 RUNX转录因子家族 RUNX2和RUNX3表达于前肥大和肥大型软骨中,是调控软骨细胞肥大及成熟的主要转录因子,对终末肥大软骨细胞转分化为成骨细胞至关重要。RUNX2调控肥大软骨细胞中X型胶原基因(101)以及终末肥大软骨细胞中MMP13和VEGF表达。2基因缺失抑制COLX合成、血管侵袭、软骨细胞肥大和成熟,导致生长板结构破坏和骨化过程完全失败。RUNX2诱导软骨细胞表达IHH,促进软骨细胞的增殖,IHH也能够诱导软骨膜中RUNX2表达,RUNX2还能抑制SOX9的转录活性。因此,RUNX2与多种调控因子协同合作共同确保骨骼正常发育。研究表明,锰缺乏可能通过抑制RUNX2和SOX9的表达抑制软骨内骨化的进程进而诱发肉鸡TD。
2.1.3 MEF2转录因子家族 MEF2C和MEF2D表达于前肥大和肥大软骨细胞,协同控制软骨细胞肥大,其中MEF2C起主要调控作用,MEF2C在RUNX2的上游发挥作用,是诱导或维持肥大软骨细胞表达RUNX2所必需的。在软骨内骨化的进程中,MEF2C通过激活软骨细胞肥大的基因程序来控制骨骼发育,2基因缺失抑制软骨细胞肥大和血管侵入,导致骨骼发育受阻。相反,MEF2C过表达导致软骨细胞过早肥大和生长板过早骨化,引起侏儒症。此外,MEF2C是101转录的直接调控因子。
2.1.4 FOXA转录因子家族 FOXA家族成员能够调控软骨细胞分化,与SOX9竞争,与RUNX和MEF2家族共同调控COLX和其他肥大软骨标记物的表达。小鼠软骨细胞中缺失FOXA2和FOXA3,软骨细胞肥大被抑制,碱性磷酸酶(ALP)表达下调和胸骨矿化缺陷,表现为出生后侏儒症,生长板中COLX和MMP13表达水平显著下调。此外,敲除FOXA2能够降低的表达,而编码,因此,FOXA2通过PTHrP通路调控骨骼发育。
2.1.5 成骨细胞特异性转录因子Osterix(OSX) OSX是成骨细胞分化和骨形成所必需的。OSX作用于RUNX2下游,是软骨内骨化的重要转录因子,在软骨内骨化晚期(如钙化)发挥调控作用,OSX缺陷导致肥大期软骨细胞停止软骨内骨化且软骨基质钙化受损。此外,OSX在2基因敲除鼠中不表达,且基因缺失小鼠不会发生骨形成。OSX靶向诱导MMP13表达,OSX和RUNX2的相互作用是诱导软骨内成骨过程中MMP13表达的必要条件。研究表明,褪黑素能够通过增强OSX表达直接调控晚期成骨细胞分化,促进碱性磷酸酶活性和骨矿化。
2.2 骨骼发育相关信号分子
2.2.1 转化生长因子β(TGF-β) TGF-β在软骨形成、软骨细胞增殖、细胞外基质沉积和终末分化等阶段均起作用。在软骨内骨化的早期,TGF-β主要起正向调控作用,在分化后期起抑制作用来维持肥大软骨细胞表型。TGF-β能够诱导COLⅡ表达,促进软骨细胞增殖,增加S期细胞比例。在分化的后期,TGF-β通过激活Smad2/3通路下调RUNX2功能,抑制软骨细胞肥大,还能抑制Wnt8c和β-catenin通路,进而抑制软骨细胞成熟和COLX启动子的激活。研究表明,分解素和金属蛋白酶12(ADAM12)可通过调控TGFβ1诱导的IGF1和RUNX2的表达参与软骨细胞分化。
2.2.2 骨形态发生蛋白(BMPs) BMPs属于转化生长因子β家族成员,在成骨细胞分化和骨形成中起着关键作用。BMP信号通路通过其受体BMPR1 (BMPR1a和BMPR1b)和BMPR2发挥作用,BMP信号通路能够促进IHH表达,抑制FGF信号通路的关键效应因子STAT和ERK1/2 MAPK的激活。BMP2通过激活Smad1/5/8信号调控多种转录因子的表达和功能,进而控制骨和软骨的发育,例如BMP-Smad信号能够通过RUNX2和OSX通路调控骨形成。研究表明,骨碎补总黄酮对肉鸡TD模型BMP2和RUNX2表达的下调有缓解作用。
2.2.3 成纤维细胞生长因子(FGF) FGF及其受体(FGFRs)在骨形成及发育中起重要作用,敲除FGFR1和FGFR2的小鼠出生后表现为纵向骨生长受损。FGF18能够抑制MIR-195对软骨细胞增殖以及对COLⅡ和ACAN表达的抑制作用,FGF2能够诱导MMP13表达。FGFR1和FGFR2失活使FGF9表达代偿性增加,进而异常激活FGFR3,抑制软骨细胞增殖和肥大,而FGFR3信号通路的增强又进一步促进FGF9和FGF18表达,抑制IHH和Pthlh表达。FGFR3表达和信号传导的异常激活可损害生长板软骨细胞增殖、终末分化和细胞外基质的合成。此外,FGF还通过调控软骨细胞自噬来调节生长板ECM的组成。
2.2.4 印度刺猬蛋白(IHH) IHH主要表达于前肥大区和肥大区,是骨骼发育和稳态的关键调控因子。IHH能够促进软骨细胞增殖和成骨过程,也通过刺激PTHrP分泌调控肥大软骨细胞的分化。IHH能够调控软骨膜中RUNX2的表达,下调IHH导致ALP活性减低和软骨基质矿化减少。基因缺失小鼠表现为增殖型软骨细胞显著减少,软骨细胞成熟异常以及缺乏成熟的成骨细胞。Deng等研究表明,敲除小鼠软骨细胞基因可能通过影响TGF-β/Smad和OPG/RANKL信号通路抑制软骨细胞生长和分化。
2.2.5 甲状旁腺激素相关肽(PTHrP) PTHrP在骨发育和成熟过程中发挥作用,通过与PTH1R受体结合来抑制软骨细胞终末分化。敲除基因导致软骨内成骨严重异常,基因缺失仔鼠的四肢骨明显缩短,生长板显著变窄。研究表明,通过添加环巴胺抑制PTHrP上游的IHH信号后,基因表达水平随时间的延长显著降低。PTHrP的表达受到其上游信号因子IHH影响,而过表达PTHrP又能下调IHH表达,形成IHH/PTHrP负反馈环调控软骨细胞增殖和分化,保证软骨内骨化有条不紊地进行。
2.2.6 C型利钠肽(CNP) CNP是维持软骨稳态和软骨内成骨的重要调节因子,CNP与其主要受体利钠肽受体B(NPRB)结合后,刺激软骨细胞和软骨基质的合成。Fujii等用ZFN技术成功建立CNP敲除大鼠模型,CNP 敲除大鼠表现为骨骼生长受损,长骨较野生型大鼠短,生长板较野生型大鼠窄,特别是肥大区明显变窄。研究表明,CNP通过抑制丝裂原激活蛋白激酶(MAPK)通路来拮抗FGFR3下游信号通路。然而,有关CNP在肉鸡发生腿病时表达的研究较少,需要进一步探索。
2.2.7 WNTs信号因子 WNTs信号因子对于骨骼形成、维持骨稳态和进行骨修复至关重要。在早期骨骼发育的过程中,Wnt/β-catenin信号通路激活OSX表达,诱导间充质干细胞向成骨细胞分化。随后,生长板软骨细胞中的WNTs信号因子促进软骨细胞存活并调控软骨内骨化进程。WNTs信号因子能够促进BMP和IHH表达,促进软骨细胞肥大和调控骨矿化。此外,WNT11能够上调RUNX2表达,并与TGF-β协同促进软骨细胞分化。研究表明,在福美双诱导肉鸡TD模型中,WNT4表达下调,使用淫羊藿苷通过上调WNT4表达能够改善TD的发生。
2.2.8 血管内皮生长因子(VEGF) 在软骨内骨化的进程中,血管内皮生长因子A(VEGFA)由前肥大和肥大软骨细胞分泌,对于维持软骨内骨化中血管生成和侵入以及成骨细胞分化至关重要。VEGFA能够诱导内皮细胞迁移和增殖,间接刺激成骨和血管生成,并通过旁分泌信号调节成骨生长因子的分泌。VEGFA缺失导致胚胎骨形成受阻,基因敲除小鼠的生长板肥大区变宽、无血管侵入并出现细胞的大面积死亡。VEGFA能够刺激IHH的表达和活性,增加β-catenin表达。研究表明,在福美双诱导的TD模型中,VEGFA表达显著下调,生长板血管形成和侵入延迟。
2.2.9 缺氧诱导因子(HIF-1α) 生长板软骨细胞形成的早期阶段是处于缺氧状态的,局部激活HIF-1α有利于保证软骨细胞生存并调控软骨细胞胶原合成和修饰,延长HIF-1α信号能够干扰细胞生物能学和生物合成,进而导致骨骼发育不良。在缺氧条件下,缺失HIF-1α的软骨细胞表现为Ⅱ型胶原表达显著下调、能量生成不足和软骨细胞增殖迟缓。HIF-1α和BMP2协同促进软骨细胞的增殖、抑制软骨细胞肥大并维持软骨细胞表型。此外,HIF-1α能够正向调控VEGF的表达。
2.2.10 胰岛素样生长因子(IGF) 软骨内成骨受多种激素和分泌因子调节,其中GH-IGF轴对于骨骼发育至关重要。IGF-I和IGF-Ⅱ是生长和代谢的关键调控因子,IGF-I表达于生长板各个区域,但表达程度低,而IGF-Ⅱ在生长板中高度表达,从静止区到肥大区表达水平逐渐降低。研究表明,IGF-I可增强BMP在体外和体内成骨作用,添加ICF-1有助于提高大鼠异位骨模型的骨矿化。然而,有关IGF-Ⅱ对生长板维持正常生理机能的作用以及对骨骼发育的调控作用的研究报道较少,需要进一步探究。
2.2.11 微RNA(miRNA) 多种miRNA均有保证骨骼发育的作用,能够调控软骨细胞增殖和维持软骨表型。例如,miR-218靶向并下调了多种调控因子(RUNX2、MEF2C和COLⅩ)的表达,进而调控软骨细胞的终末肥大。miR-21通过调控MEF2C、RUNX2和OSX等来调控成骨细胞发育和骨矿化。miR-195负向调控FGF18,通过ERK1/2途径调控软骨细胞增殖,通过SOX9途径调控Ⅱ型胶原及蛋白聚糖的表达,从而起到维持软骨表型的作用,下调miR-195可通过靶向FGF-18途径促进软骨细胞增殖和维持软骨细胞表型。
2.3 细胞外基质(ECM)
ECM起支持和保护软骨细胞的作用,同时作为一种媒介使信号分子和生长因子能够通过无血管的软骨向靶细胞扩散。软骨细胞ECM主要由Ⅱ型胶原(COLⅡ)、X型胶原(COLX)、蛋白聚糖(ACAN)组成,并富含基质金属蛋白酶(主要是MMP13)。内骨化的早期阶段,软骨细胞特异性合成COLⅡ和ACAN,COLⅡ是早期软骨生成的特异性标志物。COLX主要表达于肥大区,是软骨细胞肥大性分化的特异性标志物。研究表明,Ⅱ型胶原基因2a1缺失的仔猪表现为长骨明显缩短。此外,COLⅡ能够促进FOXA2表达,ACAN与FOXA2表达呈正相关。MMP13主要由终末肥大软骨细胞分泌,起降解软骨基质的作用,小鼠生长板13基因缺失使间质胶原大量聚集,导致肥大区明显变宽,并延迟软骨内成骨进程、初级骨化中心的形成和血管侵入。
上述调控因子构成了复杂精密的网络调控生长板软骨内骨化(图2、图3),其中SOX9、RUNX2、IHH和PTHrP等主要调控生长板软骨细胞的增殖和分化, RUNX2、OSX和VEGF等主要调控骨形成后期阶段的成骨细胞分化、骨矿化和血管侵入等,各调控因子独自调控或不同调控因子间相互作用协同调控软骨内骨化的进程以完成骨骼正常的生长发育。
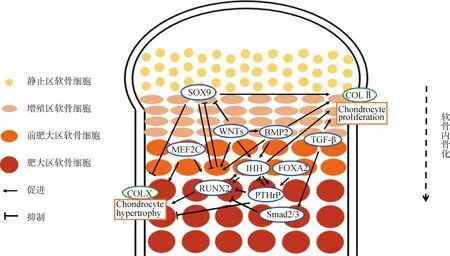
图2 软骨内骨化过程中调控软骨细胞增殖和分化的分子机制图Fig.2 Diagram of molecular mechanism that regulate chondrocyte proliferation and differentiation during endochondral ossification
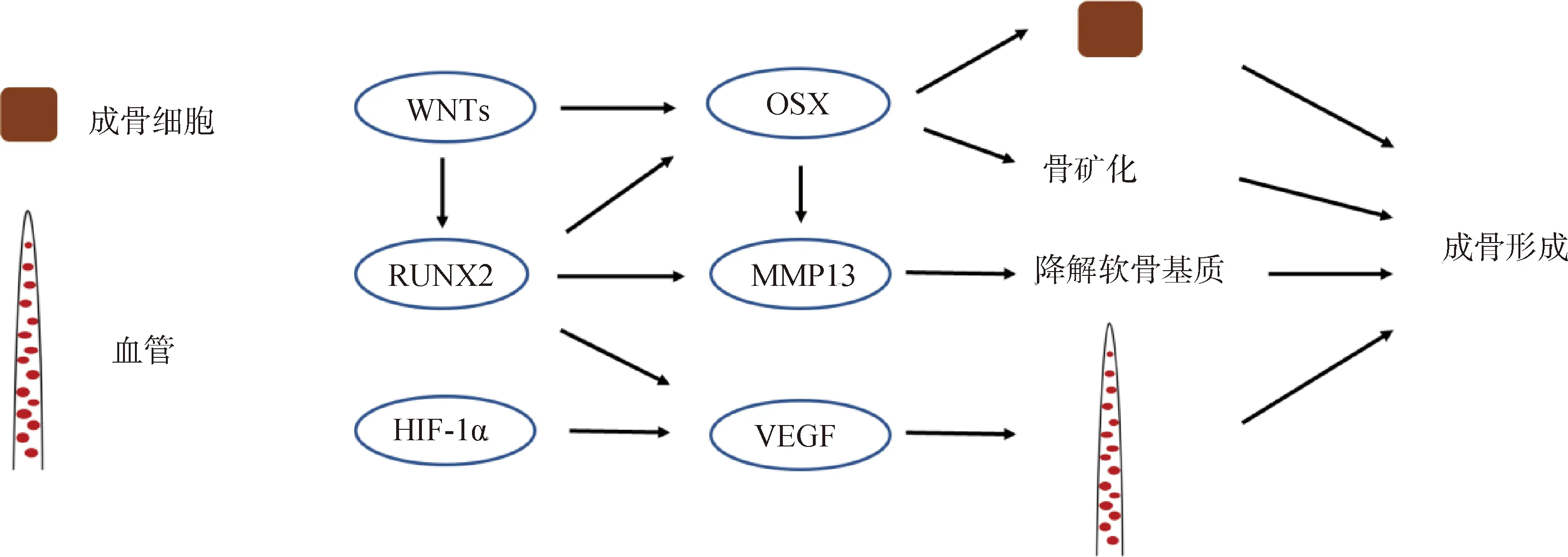
图3 软骨内骨化过程中调控成骨形成的分子机制图Fig.3 Diagram of molecular mechanism that regulate osteogenesis during endochondral ossification
3 小 结
骨骼发育主要是通过由SOX9、RUNX2、MEF2C、TGF-β、BMP2、FGFs、IHH和PTHrP等多种因子组成的复杂精确的调控网络调控的软骨内骨化完成的。持续研究调控骨骼发育的分子机制,特别是进一步探究各调控因子的局部调控作用及不同调控因子间的相互作用,对于充分理解机体如何精确调控骨形成和生长板的软骨内骨化至关重要,有助于加快对肉鸡腿病发病的分子机制的探究,为开发新的治疗靶点和方法提供可能,通过调控软骨内成骨来逆转各种骨骼疾病。

