非洲猪瘟病毒免疫逃逸分子机制研究进展
赵旭阳,靳家鑫,路闻龙,张 帅,黄 丽,张改平,孙爱军*,庄国庆*
(1. 河南农业大学动物医学院,国家动物免疫学国际联合研究中心,郑州 450046;2. 中国农业科学院 哈尔滨兽医研究所,兽医生物技术国家重点实验室,哈尔滨 150069)
非洲猪瘟(African swine fever,ASF)是由非洲猪瘟病毒(African swine fever virus,ASFV)感染猪引起的一种出血性传染病,对我国生猪养殖业造成重大威胁,迄今尚无安全有效的商品化疫苗面市。ASFV属于非洲猪瘟病毒科()、非洲猪瘟病毒属(),也是已知仅有的虫媒DNA病毒,其基因组为170~193 kb的双链DNA,包含151~167个开放阅读框(open reading frame,ORF),病毒粒子呈正二十面体对称结构,直径260 nm左右,由类核、核心壳、内膜、衣壳和外囊膜5层结构组成。
ASFV属于一类具有相同远古起源的核质大DNA病毒(nucleocytoplasmic large DNA viruses,NCLDVs)。NCLDVs包括痘病毒科、虹彩病毒科、囊泡病毒科、疫霉病毒科、潘多拉病毒科和马赛病毒科等,多数成员的基因组大小为100~400 kb,主要在被感染真核生物胞质中名为“病毒工厂”的特定区域进行复制。除了结构上的一些共同和独特的特征,在NCLDVs的感染复制周期也存在一些转录共性,但这种共性是否影响病毒的生物特性有待于进一步解析。在长期协同进化过程中,大多数NCLDVs表现出针对宿主机体免疫防御的适应性,可通过编码相关蛋白抑制宿主细胞凋亡并调节免疫反应,形成复杂的免疫逃逸机制。例如:虹彩病毒和ASFV(224)均可独立表达抑制细胞凋亡的凋亡抑制蛋白(inhibitor of apotosis proteins, IAPs),与宿主的抗凋亡蛋白Bcl-2协同调节细胞凋亡;痘病毒和ASFV(238)等可表达抑制宿主细胞NF-κB转录因子活化的蛋白,通过调控NF-κB通路影响多种免疫相关分子的功能发挥。
ASFV可编码超过150种蛋白,其中24%为结构蛋白,19%与病毒转录相关,6%参与维持病毒基因组完整,4%与病毒入侵相关,3%与病毒的免疫逃逸相关,还有34%功能未知。目前,已证实与免疫逃逸相关的病毒蛋白有DP71L、A238L、MGF360、MGF 530/505、I329L、A224L、A179L、EP153R、p54、CD2v、L83L等,参与抑制Ⅰ型干扰素(interferon,IFN)反应、调节炎症反应、调节细胞凋亡和细胞自噬等信号通路并影响获得性细胞免疫。本文总结了ASFV免疫逃逸相关机制的国内外研究进展,并探讨其在ASF疫苗研发中的潜在价值,期望为ASF疫苗研发和综合防控提供一定理论支持。
1 ASFV的入侵与复制
ASFV感染周期始于病毒吸附并侵入宿主细胞。体内感染过程中,ASFV经口-鼻传播途径或者皮肤伤口感染进入机体,在扁桃体和鼻黏膜附近淋巴结侵入单核巨噬细胞、树突状细胞(dendritic cell,DC)等抗原递呈细胞(antigen presenting cells, APC)并增殖,随后感染其他淋巴组织和器官,破坏机体的免疫系统。ASFV主要通过网格蛋白介导的受体依赖性内吞(clathrin-mediated receptor-dependent endocytosis)途径侵入宿主细胞,也可经由巨胞饮(macropinocytosis)进入细胞,但与其特异性结合细胞受体尚不明确。ASFV侵入宿主细胞后,经过内体途径逐渐脱去衣壳,暴露出的病毒内膜与晚期内体发生膜融合释放出病毒核心,核心经微管转运到核周微管组织中心(microtubule organizing centers,MTOC)区域开始早期基因表达和基因组的复制。随着“病毒工厂”的形成,ASFV开始大量复制增殖,组装好的子代病毒颗粒通过微管转运至细胞膜附近,以“出芽”的方式释放。
2 ASFV参与的免疫反应
天然免疫系统是机体抵抗病原微生物感染的第一道防线,巨噬细胞通过Toll样受体(toll-like receptors,TLRs)等一系列模式识别受体(pattern recognition receptors,PRRs)识别病原体和损伤相关分子模式(pathogen associated molecular patterns,PAMPs),分泌细胞因子/趋化因子启动免疫反应,也可通过吞噬作用将病原体摄入胞内,将处理后的抗原递呈在细胞表面激活特异性免疫应答。ASFV通过网格蛋白介导的吞噬作用侵入巨噬细胞,经内体途径脱去衣壳,并将含有遗传物质的病毒核心释放至胞质。这一过程中,PAMPs通过内质网应激引起自噬和凋亡通路激活,膜融合的过程也刺激了凋亡信号的生成;病毒基因组DNA迅速被细胞PRRs识别,进而引起干扰素和炎症反应,但ASFV也能通过众多结构和非结构蛋白调控cGAS-STING、TLRs、NF-κB、JAK-STAT等炎症和干扰素相关信号通路,抑制IFN、白细胞介素(IL)等细胞因子的表达,增强自身致病性。另一方面,ASFV感染下调了MHC-Ⅱ类分子相关基因,抑制抗原加工和递呈,同时调节CXCL10等趋化因子的表达大量招募T细胞、自然杀伤(natural killer,NK)细胞等经典单核细胞,但避免中性粒细胞等抗病毒细胞的募集,有利于自身传播和复制。ASFV感染机体时体液免疫发挥的作用当前仍存在争议,表达ASFV的抗原或者抗原混合物能够刺激机体产生中和抗体,但不能形成完全的免疫保护力。ASFV免疫猪体中CD8淋巴细胞的缺失降低了对相关强毒株的保护性免疫,提示仅有ASFV特异性抗体不足以抵抗ASFV感染,CD8淋巴细胞在ASFV保护性免疫中也具有重要作用。对小鼠接种rNDV-P72,发现机体除了能产生较高浓度的P72特异性抗体外,T细胞也发生增殖并分泌细胞因子IFN-γ、IL-4。因此,体液免疫和细胞免疫在抗ASFV感染中均起一定作用。
3 ASFV免疫逃逸机制
作为一种基因组大、蛋白多样、结构复杂的大型DNA病毒,ASFV在长期的进化过程中逐渐形成了一套极为复杂的免疫逃逸机制,可以通过不同的方式逃避机体的免疫应答。ASFV编码超过150种蛋白,其中3%与病毒的免疫逃逸相关,多种蛋白能对宿主的免疫系统起到干扰作用,分别参与调控宿主细胞的IFN反应、细胞凋亡、炎症反应和细胞自噬等,帮助病毒逃避免疫监视,在机体内增殖并引起疾病(图1)。
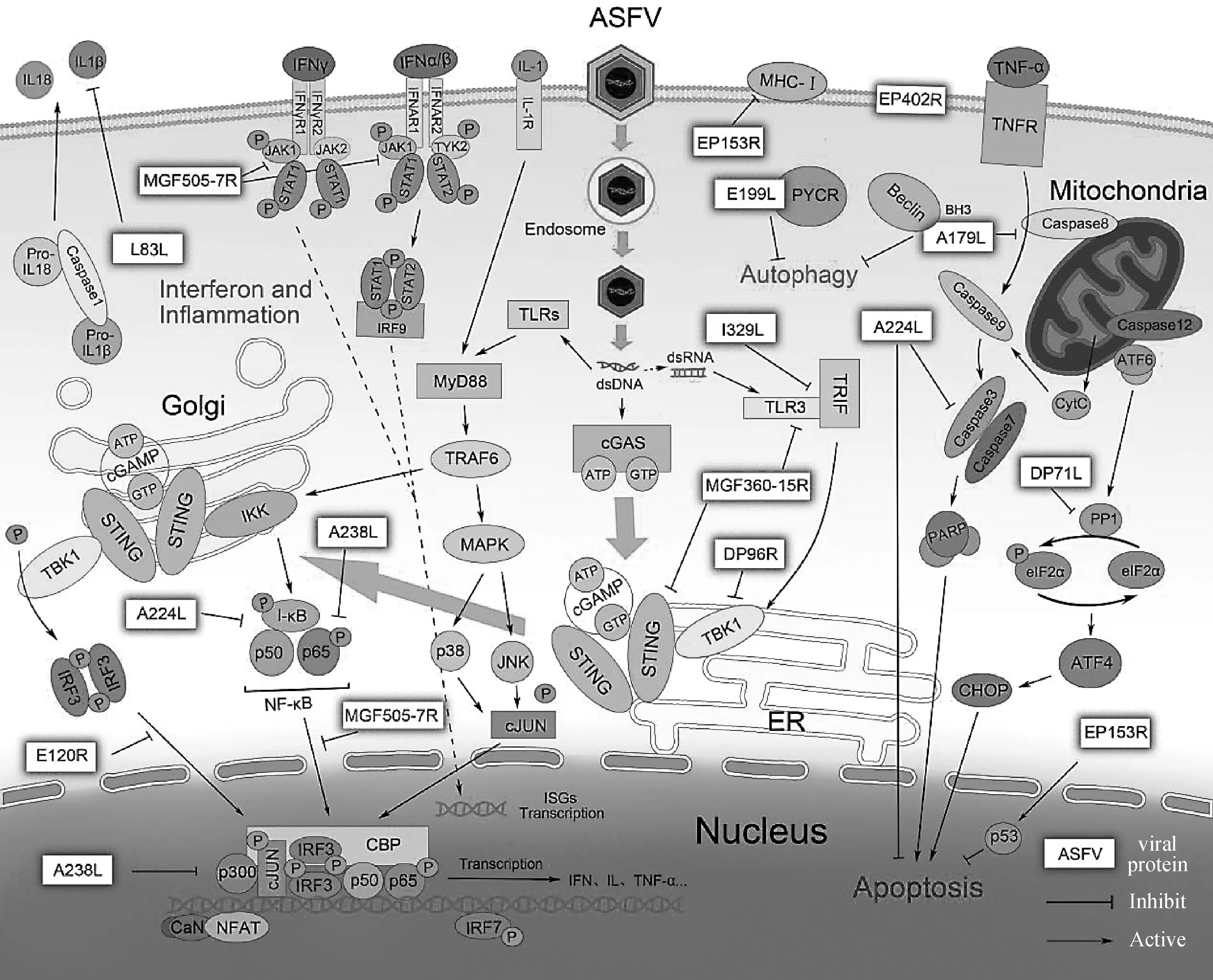
图1 ASFV通过编码蛋白干扰宿主天然免疫反应Fig.1 ASFV proteins interference the host immune response
3.1 ASFV抑制干扰素反应
ASFV主要的靶细胞是巨噬细胞,其能够通过TLRs等一系列PRRs识别PAMPs启动免疫反应,激活IFN信号通路进而分泌细胞因子/趋化因子。IFN是一类细胞因子,能够在感染和未感染的邻近细胞中诱导抗病毒状态,脊椎动物的抗病毒机制高度依赖于IFN的作用。IFN是宿主对病毒感染产生天然免疫反应的关键介质,诱导数百种可能具有直接抗病毒活性的ISGs表达,并通过激活未成熟DC增强NK细胞功能,促进T和B淋巴细胞的存活和效应功能来调节先天免疫和适应性免疫。DC进一步通过TLRs激活相关功能并完成抗原提呈,有效地将天然免疫与获得性免疫联系起来。研究表明,体外表达的猪IFN蛋白具有很高的抗ASFV活性,可以有效抑制ASFV的复制。
由于IFN介导的巨噬细胞激活对ASFV构成严重威胁,ASFV必须进化出对抗策略来对抗这种反应,从而导致调控IFN应答的ASFV基因不断进化。ASFV基因组结构可分为中间的保守区和两端的可变区,位于可变区的多基因家族(multi gene family,MGF)基因决定了ASFV基因的多样性。早期研究发现,MGFs的主要功能为抑制机体IFN反应,其多个基因拷贝缺失后导致宿主细胞IFN表达水平随之发生变化。MGF 360-9L是MGF 360家族成员之一,构建其重组真核表达质粒,转染至PK-15细胞,证实该蛋白主要定位在核内,其抑制天然免疫信号转导的功能可能发生在核内;而MGF360-15R(A276R)通过独立于IRF7机制的TLR3和胞质途径抑制IFN的诱导表达;MGF360-12L能阻断核转运蛋白与NF-κB之间的相互作用,干扰NF-κB的核易位从而显著抑制IFN的产生;另外,MGF505-7R(A528R)靶向p65的激活与核易位来抑制TLR8介导的NF-κB活性,进而抑制干扰素和炎症因子信号通路,并能通过抑制JAK1和JAK2信号通路促进病毒致病性;MGF505-11R通过与STING的相互作用负调节cGAS-STING信号通路,进而抑制Ⅰ型IFN的产生。基因缺失试验表明,MGF360-505R敲除的ASFV通过抑制NF-κB信号通路减少IL-1β的转录,最终降低了细胞凋亡和病毒复制水平。这些研究表明,多种MGFs可能是ASFV的致病因子,通过调控炎症和IFN信号通路促进免疫逃逸。
在ASFV感染宿主细胞过程中,cGAS-STING信号通路在调控IFN反应中发挥着重要作用。宿主细胞通过环型GMP-AMP合成酶(cyclic GMP-AMP synthase,cGAS)感应ASFV基因组DNA,在ATP和GTP存在的情况下,催化形成环二核苷酸(cyclic GMP-AMP,cGAMP),cGAMP与IFN刺激因子(stimulator of interferon,STING)在内质网结合并导致其构象变化,二聚化的STING转移至高尔基体并招募TBK1形成磷酸激酶复合物,进一步促进 NF-κB与IRF3磷酸化和入核,启动IFN和炎症因子的转录。研究表明,ASFV China 2018/1株的编码蛋白DP96R抑制了cGAS-STING-TBK1信号通路从而干扰TBK1诱导的Ⅰ型IFN抗病毒反应,但不影响IRF3-5D介导的IFN-β启动子激活。另一方面,与ASFV弱致病性毒株NH/P68相比,高致病性毒株Armenia/07能够显著抑制cGAS-STING信号通路进而抑制IFN-β产生,这可能揭示cGAS-STING诱导Ⅰ型IFN表达与ASFV的毒力相关。另外的一些研究发现,ASFV编码的I329L蛋白是TLR3的同源物,能在TRIF水平上抑制IFN的诱导,引起免疫逃逸;ASFV结构蛋白E120R在细胞内穿梭和释放过程发挥重要作用,最新研究发现E120R能阻断IRF3的活性,进而抑制IFN-β的产生。这些结果表明,ASFV的免疫抑制和免疫逃逸效果是多种策略共同调控的结果,深入研究ASFV调控IFN信号通路的方式和策略,对于揭示ASFV免疫逃逸分子机制有着重要意义。
3.2 ASFV调节炎症反应
机体内多数炎症反应的发生与NF-κB信号通路相关,白细胞介素等炎症因子的转录被NF-κB转录因子激活。ASFV的A238L蛋白具有与NF-κB抑制剂类似的蛋白重复序列,被认为是I-κBα的同源物,并作为NF-κB依赖基因转录的抑制因子参与宿主炎症反应调控。在ASFV感染早期,A238L蛋白穿梭于细胞质和细胞核,通过CBP/p300转录共激活因子途径抑制TNF-α的产生和激活,阻断炎症相关信号通路;通过蛋白激酶C-θ介导的p300氨基末端反式激活域上调进一步抑制NFATc2、NF-κB和c-Jun的激活。另外,A238L还能够抑制钙调神经磷酸酶的活性,并抑制NFAT依赖途径中的环氧合酶2基因转录,是十分有效的抗炎症反应蛋白。
白细胞介素-1β(IL-1β)和白细胞介素-18(IL-18) 是被激活的炎症小体中产生的一类关键促炎细胞因子。活化的Caspase-1在两个位点分别切割它们的蛋白前体(pro-IL-1β和pro-IL-18)使其转化为相应的活性形式,进而激活APCs等天然免疫细胞。在高致病性ASFV Georgia 2007分离株感染早期瞬时表达的蛋白L83L可特异性地结合IL-1β而非IL-18或IL-1α,从而抑制相应的细胞因子介导抗病毒反应,这是ASFV免疫应逃避的一种有效机制。MGF505-7R与IKKα相互作用以抑制NF-κB 信号通路,并与NLRP3结合来抑制炎症小体的形成,从而减少了IL-1β的产生。然而,即使ASFV通过多种途径抑制炎症反应,但是强毒株无论在体外和体内都会显著诱导炎症/趋化因子等细胞因子的分泌,这类细胞因子风暴导致了感染猪的急性发病和死亡。这表明ASFV对宿主炎症反应的调控和自身毒力基因的表达可能不是协调一致的,其中的动态变化及相互关联需要更多的研究来阐明。
3.3 ASFV调节细胞凋亡
细胞凋亡是一个主动的过程,在此过程中细胞经历着自我毁灭,以响应各种各样的刺激。在病毒感染早期主动诱导细胞死亡会严重限制病毒的产生,减少或消除子代病毒在宿主中的传播。然而,许多动物病毒已经进化出逃避或延迟早期细胞凋亡的策略,利于产出子代病毒。ASFV侵入宿主细胞过程中的脱壳是触发凋亡所必须的,病毒内膜与晚期内体膜融合过程引起的膜扰动可能启动凋亡信号通路导致细胞死亡。在感染后期,ASFV则主动诱导凋亡以抑制炎症信号的产生,进而阻止免疫反应对子代病毒的清除。
在ASFV感染的细胞中,DNA断裂、caspase-3激活以及细胞色素C(cytochrome C,CytC)从线粒体释放出来是诱导宿主细胞凋亡的特征。已有研究证明,ASFV感染通过内质网应激诱导caspase-9激活,与线粒体凋亡信号通路和caspase-12活性相关:内质网应激使得细胞内Ca浓度急剧升高,导致内质网伴侣钙黏连蛋白和钙网蛋白的激活,并增加线粒体外膜的通透性,造成CytC释放。ASFV感染Vero细胞也会诱导DNA修复酶(poly ADP-ribose polymerase,PARP)的裂解,PARP是一种被caspase-3和caspase-7特异性裂解的核蛋白,说明这是ASFV诱导细胞凋亡的下一步活化途径。
关于ASFV编码蛋白调控宿主细胞凋亡的研究发现:ASFV编码的EP153R蛋白一种非必需蛋白,在病毒生命周期的早期和晚期都有表达,可能通过p53途径抑制细胞凋亡;IAP是细胞凋亡抑制剂家族成员,能够保证宿主细胞的存活,ASFV编码IAP同源蛋白A224L可特异性阻断细胞凋亡。细胞的Bcl-2家族蛋白有促凋亡作用,ASFV编码的A179L是 Bcl-2蛋白的同系物,可与Bcl-2家族蛋白结合从而发挥抑制细胞凋亡的作用,防止哺乳动物细胞程序性死亡。蛋白磷酸酶1激活剂DP71L是ASFV晚期表达的蛋白,可促进eIF2α的去磷酸化,从而抑制感染细胞的凋亡,促进病毒增殖。此外,ASFV的238基因编码两种形式的蛋白,一种是32 ku的蛋白,主要在感染的后期聚集在细胞核中;另一种是28 ku的蛋白,主要存在于细胞质中;A238L蛋白具有干扰NF-κB活化的功能,在ASFV感染的早期,其诱导低活性的NF-κB 抑制机体的免疫应答,而在AFSV感染晚期诱导高浓度的NF-κB引起宿主细胞凋亡,出现典型的膜起泡特征,导致大量包含子代病毒的囊泡形成。因此受调控的细胞凋亡也是病毒传播子代的一个非常有效的机制,同时能够限制感染引起的炎症和免疫反应强度,在病毒免疫逃逸机制中十分重要。
3.4 ASFV调节自噬
自噬是某些细胞的组分发生的有序降解和再循环使用,是细胞自身的一种防御保护措施。细胞自噬可以清除DNA病毒等抗原物质,然而很多病毒进化出了相应的抵御策略,如HSV-1的ICP34.5通过靶向结合自噬蛋白Beclin-1来阻止自噬发生。ASFV编码的A179L不但是一种Bcl-2同源蛋白,能与促凋亡Bcl-2家族蛋白相互作用抑制细胞凋亡,它也是一种ICP34.5的同源物,可通过其BH3结构域与Beclin-1相互作用来抑制自噬。另外, ASFV编码蛋白E199L能通过与宿主的一种还原酶(pyrroline-5-carboxylate reductases,PYCR)相互作用,在Vero 和 HEK-293T 细胞中诱导完整的自噬过程。实际上,抑制自噬在多种病毒感染宿主模型中结果各不相同,大多数RNA病毒会诱导宿主细胞自噬,而且自噬可能会促进病毒的复制。ASFV可能通过至少两种机制抑制自噬小体的形成:利用Ba71v毒株构建179敲除株(Ba71vΔ179),感染细胞后检测结果表明,179并不是抑制自噬小体的必须基因;ASFV的DP71L蛋白能抑制内质网应激反应,阻止PP1/蛋白磷酸酶1激活,虽然也与ICP34.5有一定的序列同源性,但该途径与Beclin-1无关。因此,ASFV 感染、复制与自噬的复杂关系有待深入研究。
3.5 ASFV调节细胞免疫
巨噬细胞上MHC-I类和MHC-II类分子的表达会影响抗原递呈和保护性T细胞免疫反应的发展。序列分析显示,ASFV蛋白EP153R与CD94、CD69和Ly94A等宿主细胞蛋白同源,其存在一个C型动物凝集素样结构域,具有结合MHC类分子的功能。进一步研究发现,EP153R抑制了MHC-I类抗原的表面表达,但并未影响MHC-I类抗原的合成、糖基化和降解。ASFV感染下调了巨噬细胞组织蛋白酶的表达,损害了抗原消化和处理能力,而SLA-DMA和SLA-DMB的抑制也阻碍了MHC-II类分子的成熟。因此,ASFV通过阻碍抗原递呈延迟了T细胞的活化。另外,ASFV的402基因编码的CD2v蛋白是宿主T细胞表面黏附受体CD2的类似物,在ASFV感染的后期表达,具有细胞黏附、增强病毒毒力和免疫反应调节的作用。当ASFV感染巨噬细胞时,抑制了其他细胞的增殖以及非感染淋巴细胞对促分裂原的反应,而当402基因缺失时,这种抑制效果被破坏。因此,CD2v不但参与病毒的细胞内转运以及红细胞吸附,还参与抑制淋巴细胞增殖,调节T细胞介导的细胞免疫反应。
4 小结与展望
ASFV侵入巨噬细胞后迅速脱去衣壳并将含有遗传物质的病毒核心释放至胞质,这一过程中,PAMPs激活各类PRRs引起干扰素、炎症、自噬和凋亡等天然免疫信号通路激活,分泌细胞因子形成免疫应答。与此同时,ASFV通过众多编码蛋白调控宿主细胞的天然免疫信号通路,抑制抗病毒反应以促进自身的复制。ASFV还通过抑制抗原加工和递呈、调控趋化因子表达等方式进一步影响宿主的淋巴细胞分化成熟,阻碍获得性免疫的形成。
目前关于ASF疫苗已有大量研究,但对保护机制深入研究的报道罕见。Zhu等通过ASFV感染巨噬细胞的基因表达变化分析了ASFV致病和免疫逃逸的一些可能机制。Sun等通过p72蛋白T细胞表位的全景扫描初步开发ASF细胞免疫疫苗。因此,基于深度测序和转录组、蛋白质组的生物信息学分析研究将有助于解析ASFV免疫逃逸核心基因和关键抗原的信息,对于后续的免疫逃逸和疫苗研发工作至关重要。随着对ASFV编码蛋白及其参与免疫逃逸分子机制的逐渐了解,毒力基因缺失减毒疫苗的开发显示出越发广阔的前景;T细胞抗原表位的深入分析也为重组亚单位/活载体疫苗研究工作带来曙光。针对ASFV免疫逃逸机制的研究将极大促进疫苗和治疗药物的研发。
ASF自20世纪初期发现以来,其发生和流行的范围越来越广,给世界养猪业带来了巨大挑战,至今仍无有效的商品化疫苗问世。我国是世界上最大的猪肉生产和消费国,在当前防疫形势下,尽快开发有效疫苗进行预防控制是一项非常必要且重要的措施。然而, ASFV复杂的基因结构、多样的蛋白表达以及强大的免疫逃逸能力,使得ASF疫苗的研制工作变得十分困难。本文对ASFV免疫逃逸相关机制最新研究进展,以及部分免疫逃逸相关蛋白的种类和功能作出概述,希望对深入研究ASFV免疫逃逸分子机制提供帮助,为ASF疫苗研发和疫病防控提供理论支持。

