鸢尾素促进高糖环境中兔BMSCs骨向分化的机制
史志芸,邹蓉芳,时 权,陈 飞,翟玉洁,黄 阳
近年来,2型糖尿病因患病人数迅速增多,已成为严重危害人类生活健康的全球性公共卫生问题。2型糖尿病患者体内的高糖环境可抑制骨髓间充质干细胞(bone-marrow mesenchymal stem cells,BMSCs)成骨分化并影响种植体的初期稳定性,进而降低口腔种植手术的成功率。新近有研究发现,鸢尾素能促进高糖环境中BMSCs成骨分化,但是其作用机制目前还不清楚。因自噬是维持干细胞的干性和分化能力所必需的,高糖环境中干细胞活性受抑制,而且鸢尾素能激活自噬。因此,本研究将探讨鸢尾素促进高糖环境中BMSCs成骨分化是否是通过激活自噬实现的。
1 材料与方法
1.1 主要材料、试剂 新西兰大白兔BMSCs(解放总医院骨科研究所惠赠)。鸢尾素(美国Phoenix Pharmaceuticals);α-MEM培养液(美国Gibco);葡萄糖(湖北科伦药业);胎牛血清(杭州四季青);胰蛋白酶、二甲基亚砜(dimethyl sulfoxide, DMSO; 美国Sigma);成骨诱导培养液(赛业生物);青霉素、链霉素(石家庄华北制药);Trizol(美国Invitrogen);碱性磷酸酶(alkaline phosphatase,ALP)试剂盒(上海碧云天生物);一抗[P62抗体(货号:#5114, 美国Cell Signaling Technologies);LC3B抗体(货号:Ab192890, 英国Abcam);β-actin抗体(货号:BM0627,武汉博士德)]、辣根过氧化物酶标记的山羊抗兔单克隆二抗(美国Cell Signaling Technology);BCA测定试剂盒(南京建成);PVDF膜(美国Millipore)。
1.2 主要仪器 MCO-15AC型二氧化碳恒温培养箱(日本三洋);SW-CJ-1FD型生物净化工作台(苏州安泰);5702R型低速离心机、Bio-photometer核酸蛋白测定仪(德国艾本德);340型酶标仪(英国BDSL);DYY-7C型电泳仪、DYCZ-40型转膜仪(北京六一仪器);流式细胞仪(CytoFLEX,美国Beckman Coulter);正置荧光显微镜(BX-53,日本奥林巴斯)。
1.3 兔BMSCs复苏、培养 从液氮中取出冻存的兔BMSCs,直接将冻存管浸没在温水中,并不断摇动冻存管使冻存液快速融化。5 ml PBS重悬细胞沉淀,离心(716 g,5 min)后弃上清。最后,将BMSCs接入培养瓶中培养,3 d后首次换培养液并在显微镜下观察细胞形态。
1.4 干性鉴定 0.5%胰蛋白酶消化BMSCs,将其制成单细胞悬液(2×10/ml)备用。在EP管中分别加入异硫氰酸荧光素(fluorescein Isothiocyanate;FITC)标记的抗CD11b、CD45、CD29和CD90抗体,低温环境中避光孵育30 min后洗脱未结合的抗体,流式细胞仪检测。
1.5 细胞分组 将兔BMSCs接种于24孔板(6.0×10/孔),当细胞长满孔底面积的80 %时,换为成骨诱导液培养并将细胞分为4组:对照组,高糖组(培养液中葡萄糖的浓度为44 mmol/L),鸢尾素组[高糖(44 mmol/L)+鸢尾素(100 ng/ml)]和氯喹组[高糖(44 mmol/L)+鸢尾素(100 ng/ml)+氯喹(20 μmol/L)]。各组细胞成骨诱导5 d后,进行后续实验。
1.6 自噬相关蛋白的表达检测 以β-actin为内参,按照Western blotting常规步骤检测自噬相关蛋白P62和LC3B的相对表达。步骤如文献[5]:裂解各组细胞并提取总蛋白。测定总蛋白浓度后,各样本取50 μg蛋白进行凝胶电泳(200 mA, 90 min),将蛋白转膜于PVDF膜上。室温条件下封闭2 h,分别滴加特异性一抗封闭过夜(P62抗体的稀释比例1∶1000;LC3B抗体的稀释比例1∶2000;β-actin抗体的稀释比例1∶200),再以辣根过氧化物酶标记的二抗封闭2 h,最后用化学发光剂显影,采用Image J软件分析胶片灰度值。
1.7 成骨相关基因的转录表达检测 按照qRT-PCR常规步骤检测成骨相关转录因子(Runt-related transcription factor 2,Runx2)、ALP、I型胶原(collagen type I,COL-I)和骨钙素(osteocalcin, OCN)的相对表达量:提取各组细胞的总RNA并检测RNA含量,再将RNA反转录为cDNA,并按95 ℃预变性3 min,95 ℃变30 s,58 ℃退火30 s,70 ℃延伸45 s,扩增35个循环,最后72℃ 延伸15 min的条件进行扩增。成骨相关基因序列见表1。

1.8 ALP活性定量 按照试剂盒说明书行ALP活性定量检测,方法参照文献[13]。吸去孔板中的成骨诱导液,PBS缓冲液漂洗,加入30 μl Triton X-100,4℃过夜。然后,每孔加入ALP缓冲液和基质液各50 μl,室温下孵育0.5 h后加入ALP显色液100 μl,酶标仪520 nm处检测OD值。每孔重复测试3次。

2 结 果
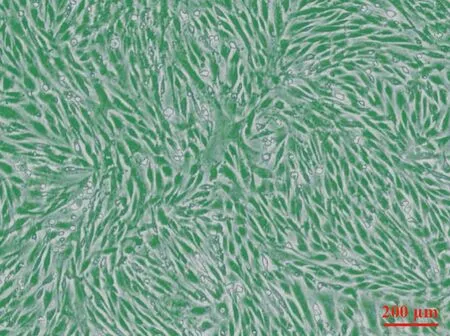
2.1 BMSCs形态观察及干性鉴定 兔BMSCs复苏后贴壁生长,总体观察呈旋涡状,单个细胞在形态上呈长条状或者纺锤状(图1)。干性鉴定结果显示:兔BMSCs低表达造血干细胞表面标志物: CD11b(4.28%),CD45(7.41%);高表达间充质干细胞表面标志物:CD29(99.4%)和CD90(99.6%)。
2.2 自噬相关蛋白的表达 Western blotting结果显示,与对照组相比,高糖显著升高P62蛋白的表达,同时明显降低LC3B-II的表达(均<0.05)。鸢尾素干预能显著降低P62蛋白的表达,同时明显升高LC3B-II的表达(均<0.05)。加入自噬抑制剂氯喹后,P62和LC3B-II的蛋白表达量均升高(<0.05,表2)。

2.3 成骨相关基因的转录表达 qPCR检测结果(表3)显示:与对照组相比,高糖组成骨相关基因Runx2、ALP和COL-I的转录表达降低,差异有统计学意义(均<0.05);鸢尾素组Runx2、ALP和COL-I的表达水平显著升高(均<0.05);当加入氯喹后,Runx2和ALP的转录水平下调,差异有统计学意义(均<0.05)。
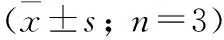
2.4 ALP活性 在成骨诱导5 d后:与对照组相比,高糖组细胞的ALP活性显著降低[(0.171±0.033)(0.257±0.046);<0.05];而鸢尾素组细胞的ALP活性明显升高[(0.276±0.017)(0.171±0.033);<0.05];加入氯喹后,ALP活性明显下降[(0.182±0.029)(0.276±0.017);<0.05]。
3 讨 论
鸢尾素是运动诱导产生的肌源性细胞因子,具有抗炎和抗分解代谢的作用,鸢尾素也能抑制胰岛β细胞和人脐静脉内皮细胞凋亡。而且,鸢尾素可通过激活自噬缓解压力诱导的心肌肥大和血管紧张素II诱导的心肌细胞凋亡。而本研究发现鸢尾素通过激活自噬促进高糖环境中BMSCs成骨分化。
BMSCs具有分化成骨细胞、软骨细胞和脂肪细胞等多种细胞的潜能,是防治种植术区骨量不足的重要调控靶点。因此,本研究选择BMSCs研究自噬在干细胞成骨分化中的作用。自噬是一个吞噬细胞自身蛋白或细胞器并将其包裹到囊泡,并与溶酶体融合形成自噬溶酶体,降解和再利用其包裹的内容物的过程,生物体借此满足自身代谢或者细胞器更新的需求。自噬作为多种疾病的发生机制再过去几十年被广泛研究。本研究发现,在BMSCs成骨分化的过程中,高糖环境降低BMSCs的自噬活性,而鸢尾素干预能重新激活自噬。当采用自噬抑制剂氯喹抑制自噬后,鸢尾素促进高糖环境中BMSCs成骨分化的作用明显减弱,这至少在某种程度上说明鸢尾素促进高糖环境中BMSCs成骨分化是通过激活自噬实现的。既往的研究与本实验结果一致,即激活自噬能促进BMSCs成骨分化,而使用巴弗洛霉素A1抑制自噬后导致骨生成减少。而且,自噬激活剂雷帕霉素能抑制骨吸收并促进骨生成。
Runx2是BMSCs在成骨分化的过程中发挥启动作用的关键转录因子,本研究的PCR结果显示,当采用氯喹抑制自噬后,鸢尾素促进高糖环境中BMSCs细胞Runx2转录表达的作用明显减弱。而启动Runx2的转录表达能够促进BMSCs成骨分化的早期标志物ALP和COL-I的表达。当采用氯喹抑制自噬后,鸢尾素促进高糖环境中BMSCs细胞ALP转录表达的作用也明显减弱,COL-I的转录表达亦呈下降的趋势。与此同时,ALP活性检测也证实,抑制自噬后,鸢尾素促进高糖环境中BMSCs细胞ALP活性的作用明显降低。但是,鸢尾素对BMSCs成骨分化标志物OCN的转录表达却无影响。抑制自噬后,OCN的转录表达也无明显改变。造成这种差异的原因可能是基因转录表达具有时间效应。因为OCN是在成骨晚期,即骨质沉积阶段才高表达的,而本研究进行PCR实验的时间是在成骨诱导后的第5天。
自噬主要受哺乳动物雷帕霉素受体(mammalian target of rapamycin,mTOR)依赖性和mTOR非依赖性信号通路的调节,AMP依赖的蛋白激酶(adenosine monophosphate-activated protein kinase, AMPK)是细胞内AMP/ATP比例敏感性的能量感受器,AMPK激活后可直接抑制mTOR,进而激活自噬。Sirt1是细胞内NAD依赖性的能量感受器,可以调节细胞的能量代谢和细胞生存,也可以通过使几种自噬相关蛋白和转录因子去乙酰化来调节自噬。本研究仅表明鸢尾素通过激活自噬促进高糖环境中BMSCs成骨分化,但对鸢尾素干预激活自噬的信号途径未进行探讨。因此,后续实验需进一步明确鸢尾素激活自噬的信号转导途径。
综上所述,本实验发现鸢尾素在体外促进高糖环境中BMSCs成骨分化是通过激活自噬实现的,而这对于加深认识鸢尾素的作用机制具有重要意义。
——鸢尾花

