运用流式细胞术推进自主研究型免疫学实验改革的探讨
窦 环, 乔晓月, 傅娟华, 王婷婷, 侯亚义, 沈苏南
(南京大学 a.医学院; b.生命科学学院, 南京 210023)
0 引 言
拔尖创新能力的培养有助于新医科人才成功面对未来医学的挑战,提高我国在医学科学领域的核心竞争力。免疫学作为基础医学的前沿学科,在临床医学、重大疾病的预防与治疗、生物制药等领域发挥了越来越重要的作用。自主研究型教学将有利于免疫学实验教学发挥其对于新医学专业人才综合能力和创新能力培养的关键性作用。我校医学院免疫学教研室在推进自主研究型免疫学实验教学改革的过程中,围绕总体教学目标,在夯实免疫学基本理论和基本实验方法的基础上,引导学生发现未知答案的新问题,学生在强烈学习动机的支配下,制定明确的研究目标和研究计划,采用前沿性的免疫学检测分析方法,创新性地完成实验过程。学生在完成此类型实验的过程中,大大提升了免疫学研究的科学素养,而不仅仅满足于知识点的学习。
一般认为,在肿瘤、慢性炎症、创伤等病理状态下,固有免疫系统出现了一群未成熟的髓系细胞:髓源抑制性细胞(Myeloid-derived suppressor cells,MDSCs),包括髓系祖细胞、不成熟的巨噬细胞、不成熟的粒细胞以及不成熟的树突状细胞等[1]。通常,MDSCs 细胞主要分为两大类:粒细胞样 MDSC(granulocytic MDSC,G-MDSC)和单核细胞样 MDSC(monocytic MDSC,M-MDSC);G-MDSC 在表型和形态上与中性粒细胞相似,而 M-MDSC 与单核细胞更相似,并且利用不同的功能分子抑制免疫反应。在多种肿瘤患者的组织中,MDSCs 明显增加且可通过直接或间接方式抑制 T 细胞的免疫活性,进而介导肿瘤的免疫逃逸[2]。近年研究显示,MDSCs 及其亚群具有一些新的生物学功能:MDSCs可作为破骨细胞祖细胞,在骨髓微环境的 IL-6、IL-11 和 RANKL 细胞因子作用下向成骨细胞分化;在肿瘤微环境内,M-MDSC 可直接破坏肿瘤相关抗原特异的 T 细胞活化反应;临床肝衰竭病人体内发现,M-MDSC 具有较弱的细菌吞噬能力等。在以往的免疫学实验教学过程中,上述学科进展仅停留在知识点层面,对MDSCs的免疫学特性无法通过实验操作进行深入学习。
我院免疫学教研室尝试推进自主研究型免疫学实验教学,如何有效地开展相关实验教学一直是工作的重点。近期,同学们分别对两批周龄相同的雌性C57BL/6小鼠进行侧脑室生理盐水注射手术,发现除了一批小鼠术后恢复良好外,另一批小鼠出现了明显的神经损伤现象,具体表现为:小鼠身体呈屈曲状,有向左侧或右侧倾斜、旋转以及连续转圈的行为,甚至引发小鼠死亡。指导教师立即引导同学们分析原因,复盘实验过程,同学们推测这可能与实验动物销售公司在出售前,分别给两批小鼠喂食了维持饲料和繁育饲料这两种不同的饲料有关。基于此次教学实践中的偶然发现,在病原体鉴定与免疫细胞分析技术教学中,以学生为中心,突出流式细胞术(Flow Cytometry,FCM)这一抓手,开展了“繁殖饲料对脑室注射小鼠髓系细胞免疫功能影响评价”的探索,详细分析脑室注射小鼠MDSCs及其亚群的比例与功能在维持饲料饮食组和繁殖饲料饮食组之间的差异。本文以此教学实践为例,对自主研究型实验教改经验进行了总结,以期为培养拔尖创新型新医科人才做好准备。
1 实验动物及饲料
无特定病原体(Specific pathogen free, SPF)级雌性C57BL/6小鼠,6~8周龄,由常州卡文斯实验动物有限公司提供[SCXK(苏)2016-0010],饲养于SPF级屏障系统中,室温22~24 ℃,室内相对湿度40%~70%,保持室内12 h进行灯的明暗自动切换,小鼠可以自由进行水和食物的摄取。维持饲料及繁殖饲料均委托江苏协同医药生物工程有限责任公司制作。
2 实验试剂及仪器
红细胞裂解液、Fc受体阻断剂(Miltenyi Biotec,货号:130-092-575)、抗鼠CD45-APC(Biolegend,货号:103112)、抗鼠CD11b-FITC(BD Pharmingen,货号:553310)、抗鼠Ly-6G/Ly-6C(Gr-1)-Alexa Flour 647(Biolegend,货号:108418)、抗鼠Ly6c-PE(Biolegend,货号:128008)、抗鼠CD3-Alexa Flour 532(Miltenyi Biotec,货号:130-109-836)、抗鼠CD4-PE Cy5.5(Biolegend,货号:100410)、抗鼠CD8-APC Cy7(Biolegend,货号:100714)均购自南京福麦斯生物技术有限公司。
GentleMACS全自动组织处理器(Miltenyi Biotec)、全光谱流式细胞仪(Cytek)由南京大学医学院基础医学教学中心提供。
3 实验步骤
基于教学实践中的偶然发现,结合本实验目的——掌握流式细胞术原理及方法,引导学生自主查阅文献,经课堂讨论与任课教师商议后,最终拟定具体步骤。实验流程见图1。

图1 繁殖饲料对脑室注射小鼠MDSCs免疫功能影响评价实验流程
4 FCM检测方法的建立
4.1 单细胞悬液的制备
以脾脏细胞为例,获取小鼠脾脏组织,取大小约1/4组织块放入GentleMACS分离管C管中,加PBS 5 mL,选择小鼠脾脏裂解程序,研磨组织块2次;组织匀浆以滤网过滤去除残渣,收集至离心管中,再用PBS冲洗C管,残液经过滤网收集至离心管中,4 ℃,300 g离心5 min,弃上清;加入1 mL 红细胞裂解液重悬细胞,室温下裂解红细胞1 min,5 mL PBS终止裂解,4 ℃,300 g离心5 min,弃上清;1 mL PBS洗两次,调整细胞密度为1×106/mL,备用。
4.2 流式抗体染色
将制备好单细胞悬液分装各流式管中(每管不少于1×106个细胞),于各样品管中加入FC-blocker稀释液,室温下封闭10 min;加入10 μL流式抗体稀释液混匀,注意做好阴性对照、同型抗体对照、单标抗体对照、FMO对照等处理,4 ℃避光孵育30 min,500 μL PBS洗涤两次,加100 μL PBS混匀,进行流式检测。
4.3 流式细胞术圈门策略
以小鼠外周血MDSCs的圈门策略为例,学生们通过参考相关文献[3-4],先依据FSC-A/SSC-A散点图排除细胞碎片并圈出细胞(一级门),然后在SSC-H/SSC-A散点图中去除粘连细胞(二级门)并圈出单个细胞,接着在CD11b-FITC/Gr-1-AF647细胞群散点图中选定 CD11b+Gr-1+细胞群为 MDSCs(三级门),在CD11b-FITC/SSC-A细胞群散点图中选定CD11b+细胞群(三级门),最后在Gr-1-AF647/Ly6c-PE细胞群散点图中选定CD11b+Gr-1+Ly6Clo细胞群为G-MDSC(四级门)、选定CD11b+Gr-1-Ly6Chi细胞群为M-MDSC(四级门),详见图2。
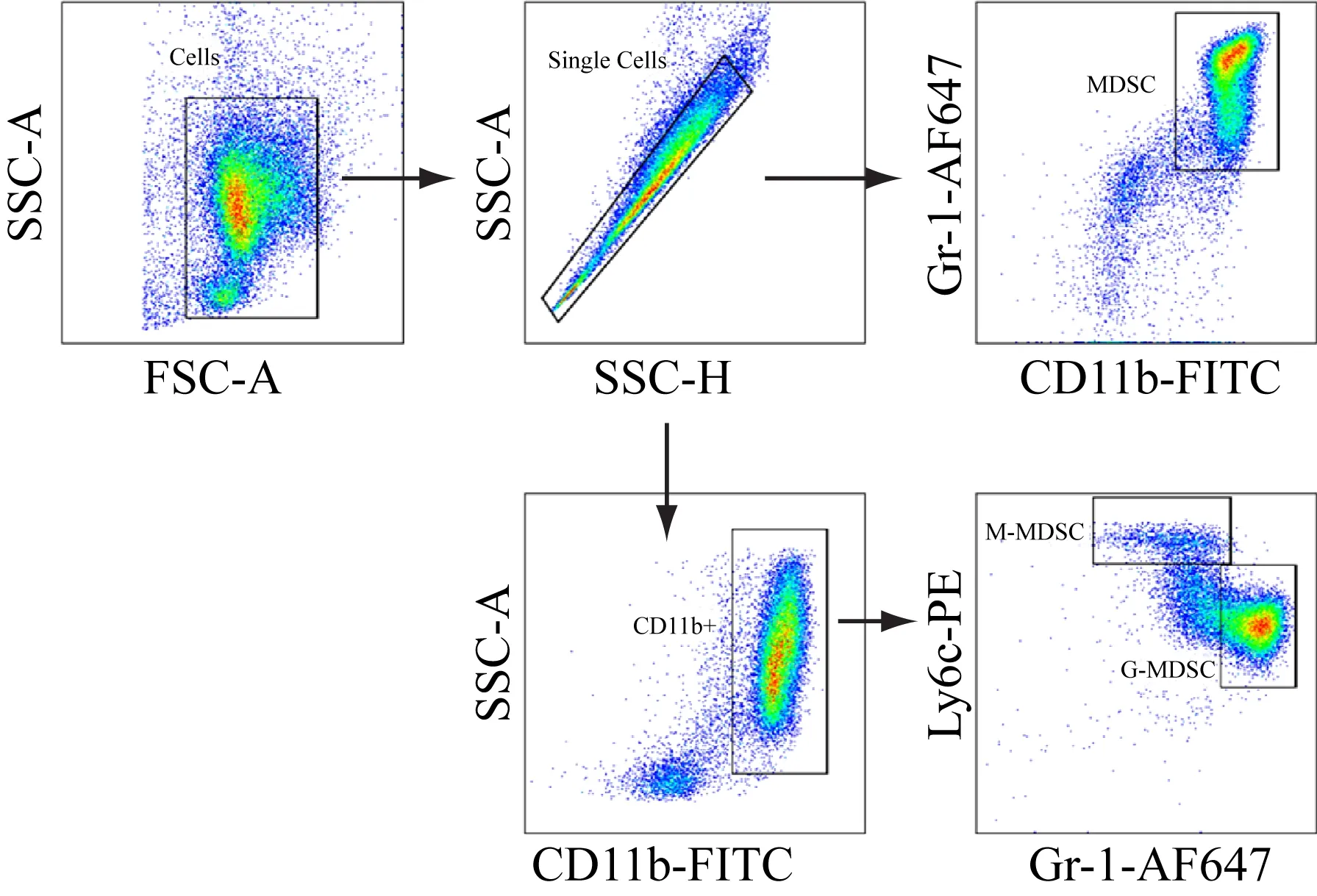
图2 流式细胞仪分析MDSCs的圈门策略
5 实验结果与分析
5.1 繁殖饲料对脑室注射小鼠MDSCs及其亚群细胞比例的影响
通过FCM技术检测各组小鼠骨髓样本后,学生们发现:术后第1天,与维持饲料组相比,繁殖饲料组骨髓中总的MDSCs比例无明显变化,G-MDSCs细胞比例减少,M-MDSCs比例增多;术后3或5天,繁殖饲料组小鼠骨髓总的MDSCs比例与G-MDSCS变化一致,均表现为增加,而M-MDSCs比例减少[见图3(a)]。小鼠脾脏样本结果显示:与维持饲料组相比,繁殖饲料组小鼠在术后1~5天内,脾脏总MDSCs和G-MDSCs的比例一直呈现明显增加现象,而M-MDSCs的比例出现相反的变化趋势[见图3(b)]。

5.2 繁殖饲料对脑室注射小鼠外周T细胞及其亚群比例的影响
学生通过查阅文献,了解到MDSCs常在晚期癌症患者体内出现[5-6],被认为是先天性和适应性免疫的有效抑制剂,可以抑制CD4+和CD8+T细胞的活化[7-8]。因此,指导老师建议学生继续分析两组小鼠的T细胞及其亚群细胞比例。通过FCM技术检测各组小鼠外周血样本,学生还发现:与维持饲料组相比,术后1~3天,小鼠外周血的CD3+总T细胞、CD4+以及CD8+T细胞比例均无明显改变;术后5天,CD3+T细胞比例仍无明显变化,但CD4+T细胞比例显著减少,CD8+T细胞比例明显增加[见图4(a)]。小鼠脾脏的结果也显示:与维持饲料组相比,术后1~5天,小鼠脾脏CD3+总T细胞、CD4+和CD8+T细胞的比例均明细增加[见图4(b)]。结合MDSCs及其亚型比例的变化,因此,可以推测,在不同饲料条件下,M-MDSCs可能产生抑制T细胞的作用。
图4 小鼠外周血和脾脏内T淋巴细胞的变化
5.3 繁殖饲料对脑室注射小鼠脑免疫细胞的影响
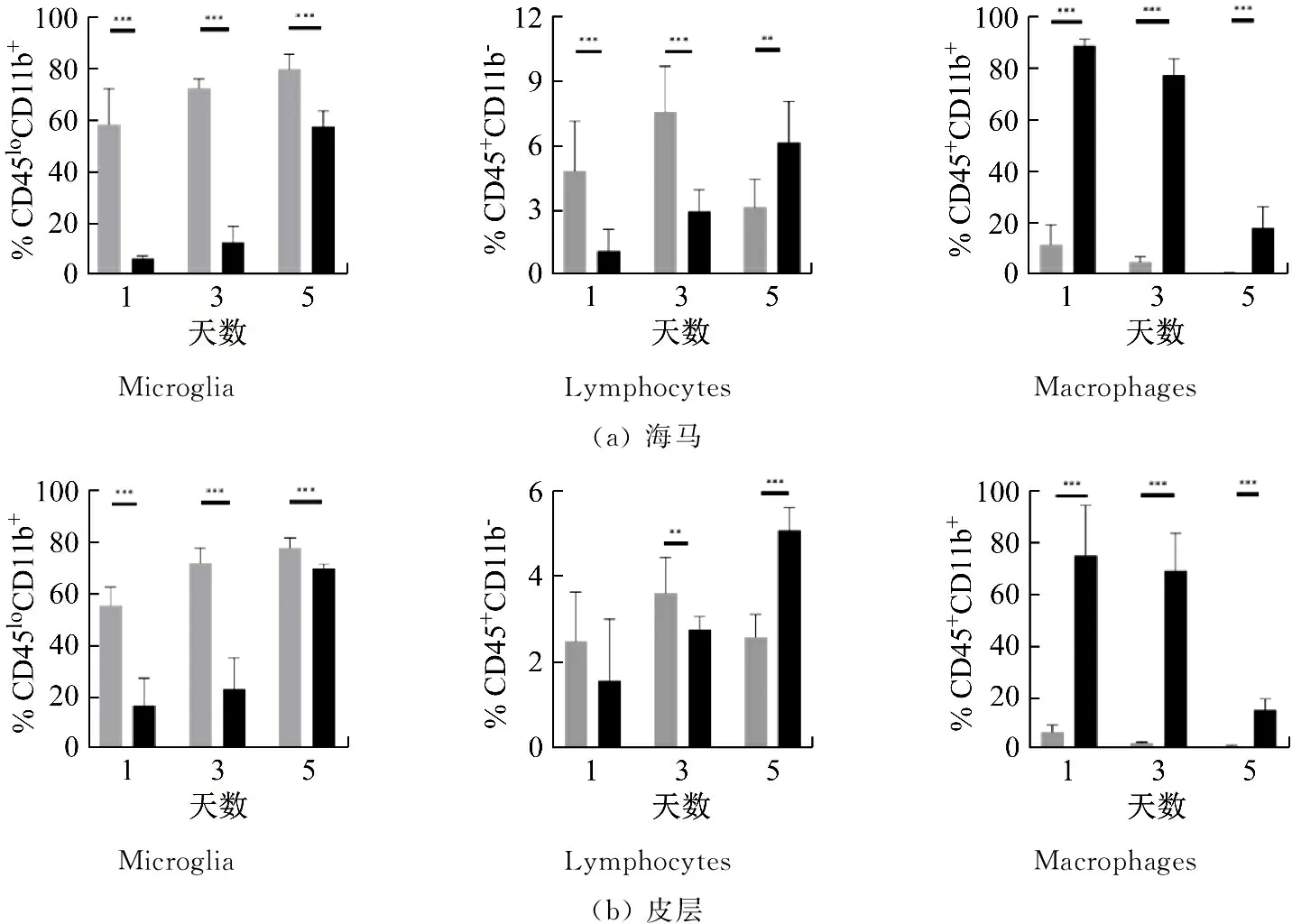
炎症介质会损害未成熟的骨髓细胞通过MDSCs向巨噬细胞、粒细胞或树突状细胞的分化。当炎症发生时,位于骨髓和外周淋巴器官中的MDSCs通过趋化性迁移到发炎的组织中,发挥其免疫抑制功能,预防组织损伤,但同时也干扰组织中免疫稳态的维持,例如抑制小胶质细胞和效应T细胞的功能[9]。因此,在上述实验探索的基础上,指导教师建议学生也继续对脑中免疫细胞改变进行分析。通过FCM技术检测,学生发现:与维持饲料组相比,术后1~5天内,繁殖饲料组小鼠海马和皮层中的小胶质细胞比例持续减少,浸润的巨噬细胞比例持续增加;但是,淋巴细胞先术后在第1~3天内减少、第5天时增加(见图5)。
6 讨论与总结
病原体鉴定与免疫细胞分析技术实验课程是我院免疫学学科体系中重要的组成部分,主要介绍了医学微生物、寄生虫等病原体的基本特征及分离鉴定方法、各类免疫细胞基本功能以及临床上常用的免疫检测技术。通过基础型、综合型实验教学的努力,实现了临床医学专业学生在病原微生物和免疫学理论知识上的拓展和实践[10-12]。因此,在培养高层次医学拔尖创新人才目标指导下,如何对该实验课程进行教学改革,这是免疫学教研室一直以来关注的焦点。自主研究型实验,不仅可以加深学生对理论知识的理解,而且通过自主设计实验、实施相关操作,更加有助于提高他们动手操作、独立思考和灵活调用理论知识来发现问题、分析问题并解决问题的综合能力。高校实验教学同行们也在根据自身教学资源以及施教学生的素质情况,进行不断教学探索和创新。刘亚丰等将虚拟仿真技术运用于生物技术自主研究型实验,弥补生物大分子分离纯化实验教学中的不足[13]。吾尔恩·阿合别尔迪等利用新疆伊犁河谷特色微生物资源,融入微生物学研究型实验教学改革,取得了积极的教学效果[14]。FCM是一种综合了激光技术、电子物理、光电测量、流体力学、计算机技术以及细胞荧光化学、单克隆抗体等各学科的知识为一体的新型分析技术[15]。以流式细胞术为抓手开展的自主研究型实验,能够帮助学生掌握FCM的基本原理及应用领域,培养流式细胞仪独立操作技能,与免疫学研究的前沿进展相结合,促成了学生创新和科研实践能力的提高。
基于免疫学实验教学中的偶然发现,尝试以流式细胞术为抓手开展自主研究型实验教学,引导学生根据实验目的自主查阅文献、总结实验方案,经过课堂讨论环节拟定具体流式细胞术实验方案,以学生为主体实施实验检测过程,最终学生们通过详细分析小鼠MDSCs及其亚群、T细胞以及脑内免疫细胞的比例,评价了脑室注射小鼠在维持饲料组和繁殖饲料组之间的MDSCs细胞的免疫功能差异,这极大地提高了学生学习的自主性和实践性。同学们通过自主研究型免疫学实验教学的实践,初步发现小鼠6~8周前喂食繁育饲料和维持饲料等两种不同的饲料,将对脑室注射手术的小鼠产生影响,如外周血、脾脏、骨髓甚至脑中主要免疫细胞的比例以及免疫功能出现显著差异,提示实验前及实验过程中需要确保实验小鼠喂食正确,否则会对实验结果造成不良影响。此外,本教学实践还存在不足,对于造成维持饲料组和繁殖饲料组的脑室注射手术小鼠免疫细胞数量产生差异的原因尚不能最终确认,还有待进一步探究。学生还通过分析饲料营养成分,发现这两种饲料的差别主要在于繁殖饲料中赖氨酸、蛋氨酸和胱氨酸的含量高于维持饲料,接着他们通过查阅氨基酸代谢与抗肿瘤研究领域的文献,惊喜地发现,恰恰有报道指出胱氨酸能够抑制MDSCs 的活性,进而减少免疫抑制的发生[16]。然而,在脑室注射小鼠中未有这3种氨基酸与MDSCs相互作用的相关报道。大家一致认为,本实验教学发现喂养繁殖饲料的脑室注射小鼠骨髓和脾脏中MDSCs数量与正常组相比有显著变化,可能为氨基酸代谢与MDSCs的相关性研究初步提供依据,也为进一步提高学生科学研究能力解决相关科学问题打好了扎实的理论和实践的基础。
综上所述,在病原体鉴定与免疫细胞分析技术教学中运用流式细胞术推进自主研究型免疫学实验教学的经历十分宝贵,为其他医学院校的相关课程改革提供了一定的参考,也为国家培养拔尖创新型新医科人才贡献了力量。

