内蒙古不同气候带白桦外生菌根真菌群落结构及影响因素
李 敏,吕桂芬,牛艳芳,孟兆云,杨勋爵
1 内蒙古师范大学生命科学与技术学院,呼和浩特 010022 2 内蒙古自治区高等学校生物多样性保护与可持续利用重点实验室,呼和浩特 010022
土壤微生物是土壤生态系统的重要组成部分,它们驱使和影响了有机物分解、营养循环、生态系统生产力等许多生态系统过程,对于维持全球生态系统功能至关重要[1—5]。菌根真菌约占土壤生态系统微生物总量的70%,构成了生态系统中最重要的功能群之一[5]。 外生菌根真菌与植物的关系主要表现为互惠共生关系,可增加宿主植物对氮、磷、钾等营养元素的吸收,并增强植物的抗病、抗寒、抗盐及抗重金属等对极端环境的适应能力[6—8];外生菌根共生体还可以通过加速宿主光合作用和对微生物的生物分解而抑制土壤呼吸[9—10],从而降低大气中的二氧化碳浓度。同时宿主植物提供给外生菌根真菌光合产物等物质以供其生长。外生菌根真菌与宿主植物的相互作用在整个陆生植物进化过程中扮演了重要角色[11],强烈影响着森林生态系统的功能[6]。外生菌根真菌的物种及功能多样性是维持生态系统稳定性的重要因素[1,12]。因此,菌根真菌群落变异影响着植物群落和陆地生态系统碳循环以及整个陆地生态系统格局的变化[1, 13]。
在全球尺度上对土壤真菌的地理分布研究表明,气候因素、土壤特征和空间格局是全球范围内土壤真菌丰富度和群落组成的最佳预测因子,但不同真菌类群随着气候、土壤、植物参数变化的模式表现出了很大的差异[1,3]。大量研究表明,土壤pH是微生物多样性响应全球变化因子的一个重要预测因子[14—15]。也有研究表明,大空间尺度上温度是森林土壤中微生物多样性最重要的调控因素[16]。另有报道纬度也是影响土壤真菌多样性的重要因子[17]。上述研究表明,在不同的地理尺度上,土壤微生物多样性变化的关键驱动因子会有所不同,即表现出一定的尺度依赖性[1]。
白桦作为天然次生林生态系统演替过程的先锋树种,是温带落叶阔叶林的优势树种,对于维持区域生态平衡具有重要的意义。白桦是典型的外生菌根植物,据报道,与白桦共生的外生菌根真菌主要有红菇科(Russulaceae)、鹅膏菌科(Amanitaceae)、牛肝菌科(Boletaceae)、丝膜菌科(Cortinariaceae) 和口蘑科(Tricholomataceae)等科及铆钉菇属(Gomphidius)、乳牛肝菌属(Suillus)、豆马勃属(Pisolithus)、牛肝菌属(Boletus)、丝膜菌属(Cortinarius)、丝盖伞属(Inocybe)、蜡壳耳属(Sebacina)、Piloderma、滑菇属(Hebeloma)、空团菌属(Cenococcum)、块菌属(Tuber)、地怀菌属(Geopyxis)和鹅膏菌属(Amanita)等属的真菌[18—19]。上述报道主要是基于外生菌根形态学进行的鉴定,不仅工作量大,效率低,更重要的是仅通过对外生菌根的形态鉴定很难准确地反映出白桦外生菌根真菌多样性。为更全面的了解白桦外生菌根真菌群落结构,杨岳等采用高通量测序技术对内蒙古东部的赤峰市黑里河、赛罕乌拉以及内蒙古西部的贺兰山3个国家自然保护区的白桦根围外生菌根真菌群落组成进行了研究,结果表明,白桦具有较高的外生菌根真菌多样性[20]。但其采样点较少,采样点的气候、植被梯度跨越较小。因此本研究在更大尺度范围内(东西跨越约2400km,南北跨越约1700km)开展了白桦外生菌根真菌的调查研究工作。样地内从东到西水、热和植被有显著的地带性分布,从气候温度带上来说,依次跨越了寒温带-中温带-暖温带;从湿润度来看,依次呈现出湿润-半湿润-半干旱的气候变化特征;植被也有相应的演替过程,跨越了森林-森林草原-草原的植被地带;这种地带性分布在群落演替和生物多样性保护研究中具有重要作用。研究表明,微生物群落结构比微生物多样性对环境因子的响应更敏感,且微生物稀有种相对于常见种对环境变化的响应更敏感[14]。那么,外生菌根真菌在这种地带性分布的环境中是否有相应的变化?因此,本文拟解决以下两个主要科学问题:(1)跨气候带条件下白桦根围外生菌根真菌多样性及群落结构的特点是什么?(2)内蒙古白桦根围外生菌根真菌菌群结构的主要影响因素是什么?虽然不同气候带水热条件和植被存在显著差异,但是,外生菌根真菌主要是通过与宿主植物共生而存在,基于此,提出如下假设:相比较气候因素,土壤环境对白桦外生菌根真菌群落结构的影响更显著。
1 材料与方法
1.1 研究区概况
研究样地跨越整个内蒙古自治区,从西到东分别选择内蒙古西部的贺兰山国家级自然保护区(HLS,105°25′—105°28′E,38°36′—38°40′N,海拔1965—2040 m)、乌拉山国家森林公园(WLS,109°21′—109°24′E,40°43′—40°48′N,海拔1739—1928 m)、内蒙古中部的呼和浩特大青山小井沟(XJG,110°47′—110°49′E,41°2′—41°8′N,海拔 1715—1854 m)、内蒙古东部的赤峰市黄岗梁国家森林公园(HGL,117°36′—117°38′E,43°32′—43°35′N,海拔1501—1756 m)和呼伦贝尔市根河市大兴安岭森林监测站(GH,121°29′—121°33′E,50°54′—50°58′N,海拔848—853 m)作为采样点(图1)。

图1 内蒙古自治区白桦根围土壤采样点分布图 Fig.1 Distribution of sampled Betula platyphylla in Inner Mongolia Autonomous RegionHLS: 贺兰山;WLS: 乌拉山;XJG: 小井沟;HGL: 黄岗梁;GH: 根河
1.2 样品采集
内蒙古从东到西共设5个采样点,各采样点随机设置5个100 m×100 m的重复样方,样方间隔200 m,各样方内按S型随机布点,采集10棵健康白桦的根围土壤,共收集土样样品250份。采样时,先用铁锹除去表层枯枝落叶,沿着树的根部轻轻拽到根的末端,深度在20—50 cm,收集根围土壤。将各采样点的同处理土样混合均匀,使用低温冰盒保存并迅速带回实验室。将土样过2 mm土壤筛,各处理的土样分成两份;一份用于高通量测序(置于-80℃保存),另一份用于土壤理化性质的检测(土样部分风干,部分冷冻)。
1.3 土壤理化性质测定
土壤理化性质的测定方法参照鲍士旦的方法进行[21]。土壤全氮(total nitrogen,TN)测定采用半微量凯氏定氮法;土壤有机质(soil organic matter,SOM)含量测定采用重铬酸钾外加热法;土壤含水量(soil water content,SWC)测定采用烘干法;速效钾(Available potassium,AK)测定采用乙酸铵浸提-火焰光度法;有效磷(Available phosphorus,AP)测定采用分光光度计法;土壤pH值测定采用酸度计法(土水比1∶2.5)。
1.4 土壤真菌总 DNA 提取、PCR 扩增及测序
本实验选用长度约为250bp的真菌ITS基因的高度可变的ITS1区为目标片段,并选用真菌ITS5F(5′-GGAAGTAAAAGTCGTAACAAGG- 3′)和ITS1R(5′-GCTGCGTTCTTC-ATCGATGC- 3′)为特异性引物。PCR扩增产物的定量测定、均一化、文库制备、上机测序及数据质量控制等均由上海派森诺生物科技股份有限公司完成。上机测序采用 Illumina Miseq平台。通过质量筛查获得有效序列,对优化后的序列进行 OTU 的划分。对OTU进行分类单元名称指定时,参考UNITE数据库(Release 5.0,https://unite.ut.ee/)[22]。对各样品的全部数据均一化处理后进行后续分析。
1.5 生物信息学分析
采用QIIME 软件分析样品的β多样性。用SPSS 22.0软件进行外生菌根真菌丰度及土壤理化性质的Pearson相关性分析及显著性检验。利用Canoco(version 4.5)软件完成土壤理化性质对外生菌根真菌群落组成差异的冗余分析(db-RDA)。运用R软件进行各种分析图的绘制与结果输出。
2 结果与分析
2.1 土壤理化性质分析
内蒙古5个样地的生态环境因子如表1所示。各样地的土壤有机质含量、pH值、年平均温度和年平均降水量均有显著差异(P<0.05)。在内蒙古从西到东,土壤pH值有明显的变化趋势,由HLS的碱性(pH 7.93)逐渐过渡为根河的酸性(pH 4.13)。土壤含水量、有机质含量和有效磷含量均为GH最高,分别为32.08%、113.03g/kg和15.00mg/kg;HGL最低,分别为7.36%、46.03g/kg和3.87mg/kg。另外,总氮的变化范围为1.93—3.87 g/kg,速效钾的变化范围为0.19—0.39 g/kg,HLS、WLS、XJG和HGL的土壤总氮和速效钾均有显著差异,而GH和HLS间无显著性差异。内蒙古从西到东,年平均降水量逐渐增加,由HLS的267mm逐渐增加到GH的484mm;XJG的年平均温度最高,为2.70℃,越往东年平均温度越低,GH最低,为-4.18℃。

表1 内蒙古5个样地生态环境因子分析(平均值±标准误)Table 1 Analysis of eco-environmental factors from five sites in Inner Mongolia(Mean±SE)
2.2 白桦外生菌根真菌群落组成
内蒙古白桦根围土壤中共获得261个外生菌根真菌OTUs,隶属于2门、4纲、11目、29科、50属(表2)。其中绝大部分为担子菌门(Basidiomycota)真菌,相对丰度占93.5%;其余为子囊菌门(Ascomycota)真菌,相对丰度占6.5%。在纲水平上,所有外生菌根真菌隶属于4个纲,其中伞菌纲(Agaricomycetes)真菌为绝对优势真菌,相对丰度为93.5%,其次分别为盘菌纲(Pezizomycetes,3.7%)、座囊菌纲(Dothideomycetes,2.0%)和 锤舌菌纲(Leotiomycetes,0.8%)。相对丰度较高的目为红菇目(Russulales,32.9%),其次为蜡壳耳目(Sebacinales,21.8%)和伞菌目(Agaricales,21.1%)。科水平上,相对丰度较高的科为红菇科(32.9%)、蜡壳耳科(Sebacinaceae,20.8%)和丝膜菌科(11.8%)。属水平上,红菇属(Russula)真菌相对丰度最高,为32.1%;其次为蜡壳耳属(Sebacina,19.9%)和丝膜菌属(11.8%),另外,锁瑚菌属(Clavulina,3.91%)、棉革菌属(Tomentella,3.27%)、蜡伞属(Hygrophorus,2.73%)、丝盖伞属(2.61%)、辐片包属(Hysterangium,2.57%)、Piloderma(2.55%)、空团菌属(2.01%)、粉褶蕈属(Entoloma,1.91%)、粉孢牛肝菌属(Tylopilus,1.22%)、鹅膏菌属(1.14%)和革菌属(Thelephora,1.00%)的相对丰度也都超过了1.0%,为白桦根围土壤的优势外生菌根真菌。
2.3 白桦外生菌根真菌群落结构差异
内蒙古5个样地共检测到外生菌根真菌OTUs 261个(图2)。从西到东的样地HLS、WLS、XJG、HGL和GH的OTUs数量分别为77、60、49、51、54个,各地的特有OTUs数量分别为65、44、34、44和47个,各地的特有OTUs数量占各地所有OTUs数量的比例分别为84.42%、73.33%、69.39%、86.27%和87.04%,表明内蒙古东部的GH、HGL和西部的HLS的特有OTUs比例高于中部的XJG和WLS。5个样地中没有检测到共有OTUs。
其四,学校应该营造特色的教师文化。“学校应该有向心力,也就是组织文化。现在教师凝聚力还是比较差一点,学校有学生学习的文化,但是教师文化还是比较欠缺的。例如有的学校重视教科研,全校教师都在参与教科研。有的学校比较重视课外活动,教师们则都在参与活动。例如咱们学校教师逐渐通过做科研获得一些荣誉,变得更加自信、高兴,所以也更乐于参与教科研。”[HDW—TY]

图2 内蒙古5个样地白桦根围外生菌根真菌OTUs数量 Fig.2 The OTUs number of Betula platyphylla rhizosphere soils from five sites in Inner Mongolia
图3表示属水平上的外生菌根真菌的相对丰度(仅列出相对丰度前20个属)。5个样地白桦外生菌根真菌群落结构差异的比较见表2和图3。50个外生菌根真菌属中,5个样地的共有属仅有3个,分别为红菇属、蜡壳耳属和丝膜菌属,这3个属也是白桦根围土壤相对丰度最高的3个属。HLS相对丰度最高的3个属分别为蜡壳耳属(38.73%)、棉革菌属(10.27%)和粉褶菌属(9.53%),这3个属的相对丰度占该样地所有外生菌根真菌的58.53%。WLS蜡壳耳属(52.77%)的相对丰度最高,其次分别为丝膜菌属(12.60%)和红菇属(7.90%),这3个属的相对丰度占该样地所有外生菌根真菌的73.27%。XJG相对丰度最高的3个属分别为丝膜菌属(32.10%)、锁瑚菌属(16.03%)和辐片包属(12.83%),这3个属的相对丰度占该样地所有外生菌根真菌的60.96%。HGL相对丰度最高的3个属分别为红菇属(71.57%)、空团菌属(8.67%)和鹅膏菌属(4.07%),这3个属的相对丰度占该样地所有外生菌根真菌的84.31%。GH相对丰度最高的3个属分别为红菇属(66.37%)、丝膜菌属(10.07%)和Piloderma(9.53%),这3个属的相对丰度占该样地所有外生菌根真菌的76.97%。某些属的相对丰度在该样地超过了50%,构成了该样地的绝对优势属,如WLS的蜡壳耳属(52.77%),HGL (71.57%)和GH(66.37%)的红菇属。另外,红菇属、Piloderma和空团菌属在东部地区(HGL和/或GH)的相对丰度更高;丝膜菌属、蜡伞属、锁瑚菌属和辐片包属在中部地区(XJG)的相对丰度更高;蜡壳耳属和革菌属在西部地区(HLS和/或WLS)的相对丰度更高。上述结果表明,5个样地在外生菌根真菌优势属的组成上存在显著差异,而且部分优势属在不同样地的相对丰度存在显著差异。

图3 内蒙古白桦根围土壤外生菌根真菌属水平的群落结构Fig.3 The ectomycorrhizal fungal community structure of Betula platyphylla rhizosphere soils on generic level from five sites in Inner Mongolia
所有样地中,红菇属的相对丰度最高(32.05%),但在不同样地的相对丰度差异显著,在内蒙古东部的HGL和GH,其分布显著高于中部的XJG和西部的HLS、WLS;蜡壳耳属在内蒙古中部(WLS)和西部(HLS)的相对丰度显著高于东部地区(HGL和GH);丝膜菌属在内蒙古中部(XJG)的相对丰度显著高于东、西部地区。
对5个样地的优势属的进一步分析发现,5个样地的共有优势属的相对丰度占所有优势属的68.22%,表明5个样地的真菌群落结构有所差异。HLS、WLS、XJG、HGL和GH各样地的优势属的相对丰度分别占所有外生菌根真菌优势属的19.73%、18.67%、20.58%、20.88%和20.13%,说明虽然各样地白桦根围外生菌根真菌的组成有所差异,但各样地的优势外生菌根真菌的相对丰度差异较小。
为了进一步探究不同样地白桦根围外生菌根真菌群落标记物,找出组间具有显著差异的物种,以及显著影响组间差异性的物种或群落,基于LEfSe(LDA Effect Size)分析方法,对样品组间菌群丰度差异特征进行了分析(图4)。结果表明,5个样地共有15个不同分类水平的外生菌根真菌存在显著性差异。其中,HGL有3个差异指示种,分别为红菇属,红菇科和红菇目;HLS有4个差异指示种,分别为革菌目(Thelephorales)、革菌科(Thelephoraceae)、盘菌目(Pezizales)和盘菌纲;WLS有3个差异指示种,分别为蜡壳耳目、蜡壳耳科和蜡壳耳属;XJG有5个差异指示种,分别为丝膜菌科,丝膜菌属、鸡油菌目(Cantharellales),锁瑚菌科(Clavulinaceae)和锁瑚菌属。

图4 不同样地白桦根围外生菌根真菌LEfSe物种差异分析 Fig.4 LEfSe species difference analysis of Betula platyphylla ectomycorrhizal fungi from five sites
2.4 β多样性分析
为了阐明5个样地白桦外生菌根真菌群落结构差异,进行了主成分分析(PCA),如图5所示。结果表明,除WLS样地外,其余4个样地的样品均聚类在同一象限,表明样品的重复性较好。同时,HGL和GH样品存在交错,HLS和WLS样品也存在交错,表明它们的外生菌根真菌群落组成差异较小。HLS、XJG和GH的样品聚类距离较远,说明这3个样地的外生菌根真菌群落结构差异显著。在PC1维度上,属于内蒙古东部的GH和HGL的外生菌根真菌群落组成更接近,而属于内蒙古中西部的XJG、WLS和HLS的外生菌根真菌群落组成更接近,由于内蒙古东部和中西部在气候、地理和土壤等的组成上均有显著差异,说明外生菌根真菌群落受生态环境条件的显著影响。
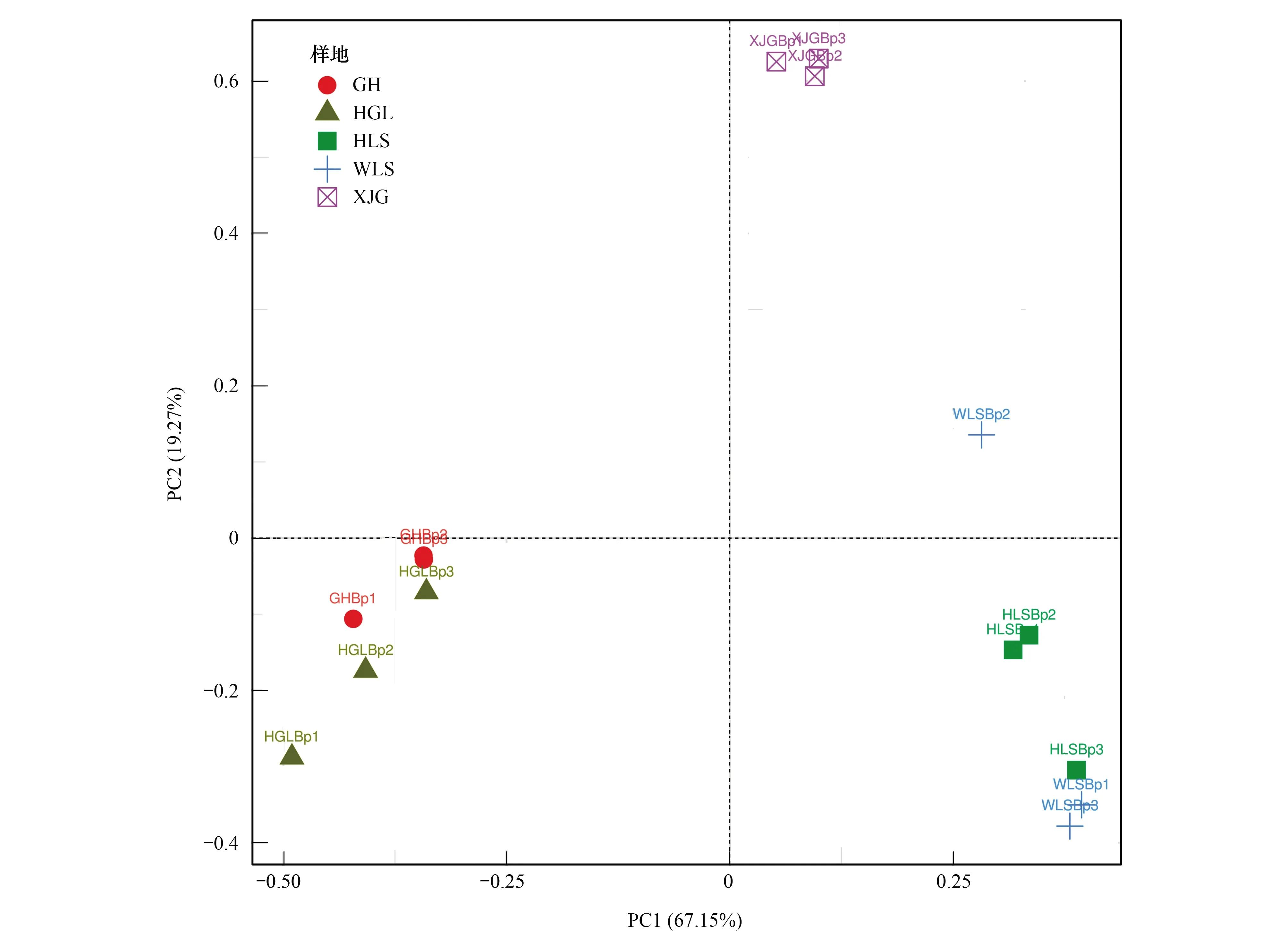
图5 内蒙古白桦根围土壤外生菌根真菌群落主成分分析(PCA)Fig.5 PCA analysis of Betula platyphylla root-associated ECM fungal OTUs in Inner Mongolia
2.5 土壤理化性质对白桦外生菌根真菌群落结构的影响
采用RDA法和Pearson相关性分析法分析了土壤理化性质对白桦外生菌根真菌多样性及群落结构的影响(表3,表4,表5,图6)。结果表明,所有因子共解释了外生菌根真菌群落变异的88.9%(表3),其中pH值、总氮、土壤含水量和速效钾对外生菌根真菌的分布均有极显著影响,pH值对外生菌根真菌多样性及群落结构变化的解释度最高,为34.3%,其次为总氮、土壤含水量和速效钾,解释度分别为25.1%、16.8%和5.4%。

图6 白桦外生菌根真菌群落结构(属水平)与生态环境因子的冗余分析(RDA)Fig.6 RDA analysis between eo-environmental factors and ectomycorrhizal fungal community structure on generic level of Betula platyphylla

表3 生态环境因子对内蒙古白桦外生菌根真菌群落组成的db-RDA分析Table 3 Results for db-RDA testing effects of eco-environmental factors on the composition of ectomycorrhizal fungal communities
土壤理化性质对白桦外生菌根真菌优势属的影响的分析表明(表4),土壤pH值与年平均温度呈极显著正相关,与年平均降水量呈极显著负相关,与有效磷和有机质含量呈显著负相关(表5);与相对丰度最高的红菇属和Piloderma呈极显著负相关,与蜡壳耳属和一个未识别属的相对丰度呈极显著正相关;与粉孢牛肝菌属和革菌属呈显著正相关。总氮和速效钾呈极显著正相关(表5),且二者均与丝膜菌属、锁瑚菌属、辐片包属、蜡伞属呈极显著或显著正相关,与空团菌属呈显著负相关。土壤含水量与土壤有机质和有效磷呈极显著正相关,与年平均温度呈显著负相关;与Piloderma呈极显著正相关,与丝盖伞属、空团菌属和鹅膏菌属呈极显著或显著负相关。

表4 内蒙古白桦外生菌根真菌属水平群落结构与生态环境因子的相关性分析Table 4 Correlation analysis between eco-environmental factors and ectomycorrhizal fungal community on generic level of Betula platyphylla in Inner Mongolia

表5 生态环境因子间的Pearson相关性分析Table 5 Pearson correlation coefficients between eco-environmental factors
3 讨论
3.1 内蒙古白桦根围土壤外生菌根真菌群落结构
内蒙古白桦根围土壤中共获得261个外生菌根真菌OTUs,隶属于2门、4纲、11目、29科、50属,表明白桦根围有相当丰富的外生菌根真菌群落,这与我们提出的假设相符。外生菌根真菌中,绝大部分为担子菌门(Basidiomycota)真菌,相对丰度占93.5%;其余为子囊菌门(Ascomycota)真菌,相对丰度占6.5%。子囊菌门和担子菌门真菌是土壤中的主要分解群落[23—24],担子菌门真菌营腐生或寄生,分解木质纤维素的能力较强[24—25]。研究表明,一些担子菌门外生菌根真菌可利用氧化酶将叶片凋落物中的有机养分无机化,进而将养分转化为植物可利用的形式[6,26—27];还有些外生菌根真菌可以产生胞外酶,例如纤维素酶、半纤维素酶和多酚氧化酶,促进植物凋落物成分的降解[28—29]。子囊菌门真菌大多为腐生菌,可以分解难降解性有机质,如木质素和角质素,在森林生态系统养分循环中起着重要作用[30]。土壤中的腐生微生物分解林下植被凋落物为土壤提供了养分,这些养分又为真菌的生长繁殖提供了营养,营养元素在真菌与林下植被之间形成循环。研究表明土壤生物多样性与多种生态系统功能(养分循环、分解、植物生产,以及降低潜在致病性等)表现出显著的正相关关系[31]。因此,白桦根围丰富的外生菌根真菌群落在维持森林生态系统稳定和养分循环中发挥着重要作用。
本研究中5个样地的共有属仅有3个,分别为红菇属、蜡壳耳属和丝膜菌属,这3个属也是内蒙古地区白桦根围土壤中相对丰度最高的3个属,3个属的丰度之和占所有优势外生菌根真菌的63.72%。5个样地东西相距约2000km,在气候、地理、土壤等方面均有显著差异,说明这3个属的真菌生境适应性广。这与其他研究者的结论一致,他们认为红菇属和丝膜菌属真菌广泛分布在温带地区,能和多种乔木或灌木共生[33—34],是白桦的优势外生菌根真菌[20],甚至有报道说这2个属的相对丰度呈线性相关[35]。研究表明,丝膜菌属真菌可分泌大量的过氧化物酶[36],在降解白桦林下枯枝落叶时可能发挥了重要作用。据报道,蜡壳耳属也广泛分布在各种森林生态系统中,几乎没有宿主特异性[37]。研究表明,空团菌属真菌生境范围非常广泛,没有明显的宿主特异性,被认为是全球森林生态系统中的优势菌,而且在恶劣条件下常为优势菌根真菌[38]。本研究中空团菌属也是白桦的优势外生菌根真菌,在HGL样地的相对丰度显著高于其它4个样地,而HGL样地的土壤含水量显著低于其它4个样地,分析结果也表明空团菌属的相对丰度与土壤含水量呈极显著负相关(表4)。空团菌属在干旱条件下能成为优势菌的原因可能是由于该属真菌与宿主植物形成外生菌根的菌套和哈蒂氏网结构致密,菌丝套外层细胞的细胞壁较厚,这种结构可使菌丝体和菌根在干旱情况下存活,同时可以减少干旱对宿主植物的影响[39]。
本研究中,白桦根围外生菌根真菌群落结构随采样地的不同而出现动态变化,5个采样点在外生菌根真菌优势属的组成上存在显著差异,表明5个样地的真菌群落结构有所差异,而且部分优势属的相对丰度在不同样地间存在显著差异(表2),白桦的3个绝对优势外生菌根真菌属中,蜡壳耳属真菌是内蒙古西部(HLS和WLS)的优势菌,丝膜菌属真菌是内蒙古中部(XJG)的优势菌,而内蒙古东部(HGL和GH)的优势菌则为红菇属。另外有些属仅出现在某一样地,如粉褶蕈属仅出现在HLS,辐片包属仅出现在XJG,而粉孢牛肝菌属仅在HLS和WLS出现。上述研究结果与我们提出的假设一致,不同采样点的优势外生菌根真菌有所不同,其他学者也认为特定环境中有一群相对丰度较高的真菌[11]。这是由于本研究中的5个样点在地理距离上有较大跨越,各地的生态环境因子差异显著,而大量研究均表明外生菌根真菌群落结构受多种环境因素的共同影响[1—3]。另外,也和不同样地外生菌根真菌所处的微环境不同有关,本研究中采样地的建群种虽然都是白桦,但由于林下伴生灌木及草本不同,外生菌根真菌可利用的凋落物资源的复杂程度不同[40],导致其群落结构有一定差异。
3.2 白桦根围外生菌根真菌群落结构的驱动因素
土壤微生物群落是一个动态变化的自组织系统,其群落结构和多样性受多种环境因素的共同影响,如植被因素、气候因素、环境因素和土壤因素等。本研究中,所有因子共解释了外生菌根真菌群落变异的88.9%,其中pH值、总氮、土壤含水量和速效钾对外生菌根真菌的分布均有极显著影响,pH值对外生菌根真菌多样性及群落结构变化的解释度最高,其次为总氮、土壤含水量和速效钾,表明土壤因子在形成外生菌根真菌群落结构中发挥了重要作用,也印证了我们提出的假设。
研究表明,在全球范围内pH值是影响土壤微生物多样性的重要因素[14—15,17,26,31]。本研究在较大尺度范围内对白桦根围外生菌根真菌群落结构的分析也支持了上述结论。内蒙古东西跨越约2400km,样地内土壤pH值有明显的变化趋势,由最西部的HLS的碱性土壤(pH=7.93)逐渐过渡为根河的酸性土壤(pH=4.13)。外生菌根真菌群落对pH 的变化也表现出了相应的响应,相对丰度最高的红菇属和优势真菌Piloderma均与pH呈极显著负相关,相对丰度其次的蜡壳耳属和优势真菌粉孢牛肝菌属、革菌属与pH呈极显著或显著正相关。另外,土壤pH值与年平均温度呈极显著正相关,与年平均降水量、有效磷、土壤有机质含量呈极显著或显著负相关。研究表明,这些因子均对外生菌根真菌群落结构有影响[41]。本研究中,pH对外生菌根真菌的物种多样性及丰富度有显著影响,这可能是由于外生菌根真菌在与宿主共生过程中产生了大量的有机酸,降低了土壤pH值,改变了环境因素(如养分有效性、有机碳)和林下植被结构,进而影响了外生菌根真菌群落结构[42]。
大量研究表明,土壤氮含量对外生菌根真菌群落结构产生显著影响[43],本研究结果也支持了上述结论,土壤氮含量是影响白桦外生菌根真菌群落结构的重要因子,与相对丰度最高的红菇属的相对丰度呈显著负相关。研究表明,红菇属对土壤氮水平高度敏感[44],与本研究结果一致。土壤氮含量可能是通过影响地上植被的多样性和优势度进而对土壤微生物群落结构产生影响[43]。在全球范围内土壤含水量是影响土壤微生物丰度的另一个重要因素[17,26,31]。空团菌属被认为是干旱条件下森林生态系统的主要外生菌根真菌[45],本研究结果也充分证明了这一观点,5个样地中HGL的土壤含水量最低,而该样地内空团菌属的相对丰度显著高于其它4个样地。本研究样地在经度上有较大跨越,各采样点的土壤水分条件差异显著,因此各采样点的外生菌根真菌的群落组成有显著差异。土壤含水量可能通过影响土壤中的各类化学过程和生物过程,进而影响土壤水中的化学离子含量,从而对土壤的pH值产生影响。
在大空间尺度上温度是森林土壤中微生物多样性最重要的调控因素[16]。研究表明,年均温和年降水量是外生菌根真菌群落的重要驱动因子[41]。而本研究中,虽然年均温和年降水量在5个样地间均有显著差异,但对外生菌根真菌群落结构并没有显著影响。可能的原因是,采样时间均为夏季,是一年中温度最高的季节,而几个采样点的年降水量也主要集中在这个季节,因此适宜的温度和充足的降水量并没有形成微生物生长繁殖的制约因素。这也与其他研究者的结论相符,即在不同的地理尺度上,土壤微生物多样性变化的关键驱动因子有所不同,即表现出一定的尺度依赖性[1—3]。
本研究中,基于RDA和SPSS相关性分析,土壤因子对外生菌根真菌群落结构有显著影响。近年来,环境因子对外生菌根真菌群落结构的影响有大量的报道[31,34,44]。众所周知,常见的真菌类群在适宜的土壤养分、含水量条件下生长良好[46],如某些真菌的相对丰度随pH值的增加而降低,而有些则呈现相反的趋势[15];相似地,某些真菌类群随营养物质的增加而增加,而有些则受到了抑制[30,44]。这些结果表明,不同的真菌类群常有不同的生态位。总之,本研究结果表明生态环境因子对外生菌根真菌群落结构有显著影响。大部分的外生菌根真菌与生态环境因子有显著相关性,体现了真菌可以作为森林状态和环境条件的地下指示物种的价值[47],同时也说明了外生菌根真菌的生态特异性。因此,确定菌根真菌的全球分布特征并确定控制这种分布的因素是了解森林生态系统目前和未来功能的必要条件[26]。
4 结论
内蒙古白桦根围土壤外生菌根真菌隶属于2门、4纲、11目、29科、50属,绝大部分为担子菌门真菌(相对丰度93.5%),子囊菌门占6.5%。红菇属、蜡壳耳属和丝膜菌属是白桦的优势外生菌根真菌,也是5个样地仅有的3个共有属。外生菌根真菌群落结构受土壤理化性质的显著影响,其中pH值、总氮、土壤含水量和速效钾对外生菌根真菌的分布均有极显著影响。大部分的外生菌根真菌属与土壤理化性质有显著相关性,体现了外生菌根真菌可以作为生态环境条件的地下指示物种的潜在价值。研究结果有助于揭示跨气候带土壤微生物群落演替对环境条件变化的响应机制,为了解森林生态系统中土壤微生物群落构建特征及预测未来环境变化的影响提供科学依据。

