富氢盐水对咪喹莫特诱导小鼠银屑病的抑制作用
陈军, 秦树存, 何磊*
1.承德医学院附属医院,河北 承德 067000;
2.山东第一医科大学(山东省医学科学院)泰山氢生物医学研究院,山东 泰安 271000
银屑病是一种慢性炎症性复发性疾病,银屑病患者存在脂类、脱氧核糖核酸以及蛋白质的严重氧化损伤。严重影响患者的工作和生活质量,增加了患者及社会的经济负担。银屑病的发病机制可能与炎性因子增多有关,伴随血浆氧化相关因子的改变。参与银屑病免疫反应的细胞主要涉及T淋巴细胞、类树突样细胞、巨噬细胞等。其中类树突样细胞或Th17细胞识别表皮抗原产生促炎因子、激活巨噬细胞分泌肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)和白介素-23(interleukin-23,IL-23),从而显著增强银屑病的炎症状态。细胞因子、趋化因子在各种免疫细胞之间起到联接枢纽作用,许多细胞因子在银屑病的皮损或外周血中显著升高,是银屑病发生发展的重要调节因子,如TNF-α、IL-1、IL-6和IL-17等[1]。氧化应激是活性氧生成远超过机体抗氧化功能时的一种病理表现。
氢气具有抗氧化、抗炎症和抗凋亡的特性。并且无论在人群试验还是在动物实验中,都未产生明显不良反应,因此被广泛应用于多种疾病的研究和应用中。许多研究显示通过吸入氢气、注射或饮用饱和氢气溶液可以改善多种疾病,如在自身免疫系统、心脑血管系统、呼吸系统、代谢性疾病和肿瘤等众多的疾病中均表现出良好的改善作用[2]。氢气对于疾病的治疗和改善的作用机理十分复杂,对其研究目前仍处于初级阶段,其中抗炎、抗氧化只能部分解释氢分子的保护作用。因此深入探究氢分子的作用机制仍然是目前氢分子生物学研究的重要课题。近年来氢也被广泛应用于多种皮肤病的研究中,且富氢水在皮肤疾病治疗领域有着良好的应用和发展前景。最新的研究表明富氢水对于银屑病,具有一定的治疗和改善作用[3],但是其作用机制尚不清楚。因此本研究拟采用咪喹莫特诱导的BALB/C小鼠银屑病模型,通过苏木素染色、实时定量PCR、目标病灶银屑病严重程度评分(target lesionpsoriasis severity score,TLPSS)、皮损组织学病理学评分(Baker score)、酶联免疫检测法(enzyme-linked immuno sorbent assay,ELISA)、硫代巴比妥酸反应物质(thiobarbituric acid reactive substance assay,TBARS)等方法,探究富氢盐水对银屑病持续性的炎症反应以及氧化应激反应的影响,旨在阐述富氢盐水对银屑病小鼠的调节作用及分子机制,以期为治疗银屑病提供新的理论依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 健康SPF级雄性8~12周的BALB/C小鼠,每组6只。许可证号:SYXK(京)2016-0006,医学实验动物合格证书编号:11400700294421。实验期间小鼠饲养于山东第一医科大学动脉粥样硬化研究所实验动物中心标准动物房,12 h昼夜交替,室温24±2℃,空气湿度50%±10%,小鼠均可自由进水进食。实验前动物先适应性饲养1周。所有实验均获得山东第一医科大学实验动物保护委员会批准。动物实验步骤按照《山东第一医科大学实验动物护理与使用指南》进行。
1.1.2 主要试剂与仪器 5%咪喹莫特乳膏(imiquimod cream,IMQ)购自四川明欣药业有限公司;LM系列氢气发生器购自济南格润实验仪器有限公司。
1.2 方法
1.2.1 银屑病小鼠模型制备[4]BALB/C小鼠20只,随机分为富氢盐水组和生理盐水组,每组各10只,两组间小鼠体质量差异无统计学意义(P>0.05)。腹腔注射富氢盐水和生理盐水7 d后,背部给予5%的咪喹莫特乳膏的同时,继续给予富氢盐水及生理盐水腹腔注射7 d。通过腹腔注射4%水合氯醛(0.1 mL·kg-1)麻醉两组小鼠后,将其背部约2 cm×2 cm毛发剃除后给予5%咪喹莫特62.5 mg·d-1,每天1次外涂。实验结束后,颈椎脱臼法处死小鼠。取背部约1 cm×1 cm大小皮肤组织,4%多聚甲醛固定,按常规制成蜡块,切片,HE染色,另外,部分背侧皮肤在液氮中速冻,使用前在-80℃下保存。
1.2.2 富氢盐水的制备 常温常压下,将500 mL生理盐水,抽出200 mL生理盐水的同时抽出全部气体,LM系列氢气发生器制备氢气,将氢气充入其中,直至水中含氢气805µmol·L-1,达到饱和状态。
1.2.3 组织学评估 采用改良TLPSS对动物的疾病临床参数进行独立评分,其中包括评分、红斑、厚度在0~4分的累积评分,其中4分代表最严重程度。将上述3种不同的评估结果相加,总得分为0~12分。总体来说,0代表无改变,1~4分别代表0~25%,25%~50%,50%~75%,75%~100%[5]。所有样本均按Baker评分标准进行Munro脓肿、表皮延长、角化不全、角化过度、乳头上部变薄、棘层肥厚、缺乏颗粒层、真皮乳头毛细血管扩张、淋巴细胞浸润[6]。石蜡切片(5µm)用抗增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)抗体(Santa Cruz公司)染色。显微镜(奥林巴斯)采集图像。
1.2.4 炎症指标的表达 实时定量荧光PCR(real-time quantitative PCR,qRT-PCR)在用光谱学进行质量检查之后,使用TRIZOL(Invitrogen公司)分离背部皮肤中的总细胞RNA。随后用QuantScript RT试剂盒(天根生物技术有限公司)进行逆转录酶反应,将分离到的mRNA转化为cDNA。使用SYBR-green PCR主混合试剂盒(天根生物技术有限公司)进行qRT-PCR,GAPDH作为对照。表1列出了qRT-PCR中使用的所有引物。采用Rotor-gene Q software version 1.7(Qiagen公司)进行数据分析。2-ΔΔCt法检测mRNA表达。采用ELISA试剂盒(Blue gene公司)测定血浆及组织中IL-1、IL-6、IL-17A和TNF-α水平。数据以平均数±标准差表示。

表1 qRT-PCR引物Table 1 Primers used for qRT-PCR
1.2.5 氧化应激指标的表达 根据试剂盒说明书(南京建成生物工程研究所),采用硫代巴比妥酸反应物质(thiobarbituric acid reactive substance assay,TBARS)测定血浆丙二醛(malondialdehyde,MDA)水平[7]。测定血浆氧磷酶-1(plasma paraoxonase-1,PON-1))的活性[8]。
1.2.6 数据分析 实验数据采用SPSS 23.0进行统计分析。本研究在两组的比较中应用了Student'st检验,在异常分布数据中使用了非参数Mann-WhitneyU检验(双尾),P<0.05为差异具有统计学意义。
2 结果与分析
2.1 咪喹莫特诱导的银屑病小鼠的临床及组织病理学表现
如图1所示咪喹莫特诱导的两组小鼠的临床表现均符合银屑病的临床表现,且富氢盐水组小鼠的背部皮肤红斑、增生和鳞屑表现比盐水组小鼠更少;富氢盐水组小鼠的TLPSS评分低于生理盐水组小鼠。HE染色显示,两组的H&E切片显示表皮增厚,大量炎症细胞浸润,均符合银屑病的病理表现。富氢盐水组小鼠的组织病理学改变较生理盐水组小鼠减轻(图2)。与生理盐水组小鼠相比,富氢盐水组小鼠的组织病理学评分更低。结果提示富氢盐水可以改善银屑病的临床和组织学表现。
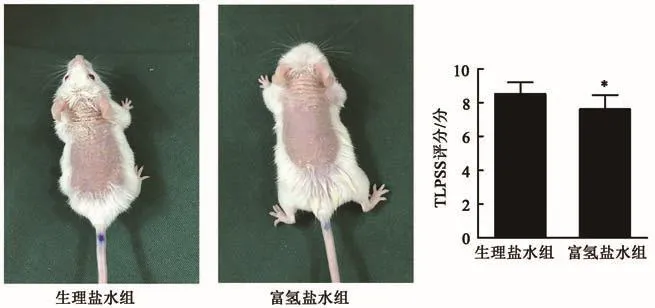
图1 咪喹莫特诱导的银屑病小鼠背部皮肤的临床表现及评分Fig.1 Clinical manifestations and scores of imiquimod-induced psoriasis in mice

图2 咪喹莫特诱导的银屑病小鼠背部皮肤组织病理学评分Fig.2 Histopathological and score of the back skin in imiquimod-induced psoriasis mice
2.2 咪喹莫特诱导的银屑病小鼠的炎症因子的表达
本研究检测了皮肤组织中炎症因子的水平,包括IL-1β、IL-6、IL-17A和TNF-α以评估咪喹莫特介导的皮肤炎症。富氢盐水组小鼠血浆中IL-1β、IL-6和IL-17A的表达(图3),以及皮肤组织中IL-1β、IL-6、IL-17A和TNF-α的表达均低于生理盐水组小鼠(P<0.05)。与生理盐水组小鼠相比,富氢盐水组小鼠的IL-1β、IL-6和IL-17A mRNA水平下降(图4)。然而,与生理盐水组小鼠相比,富氢盐水组小鼠中血浆TNF-α(图3)及其mRNA(图4)水平均低表达,但差异无统计学意义(P>0.05,图3)。结果提示富氢盐水可以减轻银屑病的炎症反应。
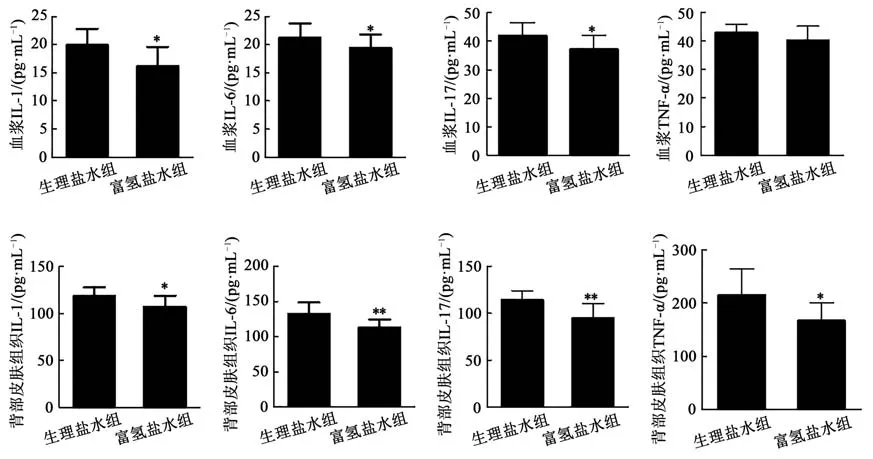
图3 咪喹莫特诱导的小鼠皮肤组织和血浆中细胞因子的表达Fig.3 Cytokine expression in the plasma and skin of psoriasis mice induced by imiquimod
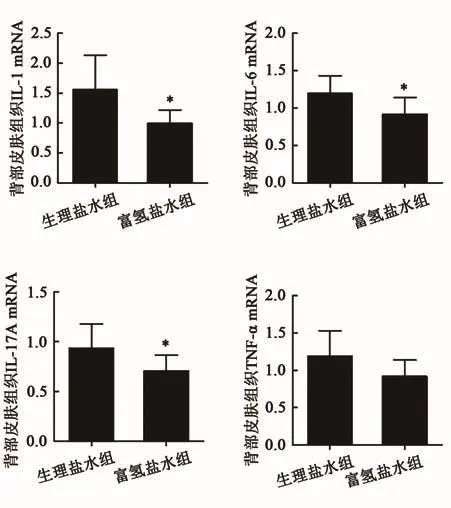
图4 咪喹莫特诱导的小鼠背部皮肤细胞因子mRNA的表达Fig.4 Cytokine mRNA expression in the back skin of psoriasis mice induced by imiquimod
2.3 咪喹莫特诱导的银屑病小鼠氧化应激的评估
本研究检测了咪喹莫特诱导的小鼠血浆氧化指标MDA水平以及PON-1的活性,以评估咪喹莫特诱导的银屑病小鼠的氧化程度。富氢盐水组MDA水平低于生理盐水组,而富氢盐水组PON-1活性高于生理盐水组(P<0.05,图5)。结果提示富氢盐水可以减轻银屑病的氧化应激反应。
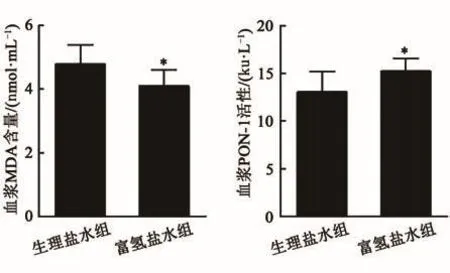
图5 咪喹莫特诱导的小鼠氧化应激因子的表达Fig.5 Oxidative stress factor expression in the back skin of psoriasis mice induced by imiquimod
3 讨论
银屑病是一种慢性炎症性皮肤病,不仅累及皮肤,还与脂代谢异常、心脑血管疾病成为共患病。氧化应激和炎症在银屑病的发生和发展中起着关键作用,这一点也已经得到了一些研究的证实[9],同时可以认为抗氧化和抗炎症也是临床治疗银屑病的重要靶点。尽管常规药物对银屑病患者有利,但各种耐药和副作用增加了治疗的难度。因此,临床一直在寻求更好的治疗银屑病的方法。氢分子具有抗氧化、抗炎症和抗凋亡的特性,同时又无明显不良反应,已经被探索为许多疾病的理想治疗工具。比如可以改善2型糖尿病、慢性肝炎、急性氧化应激、脑中枢的缺血再灌注损伤等[10-12]。最新的研究表明富氢水对于银屑病及银屑病关节炎[13]、烧伤所致的面部色素沉着、放射性皮肤损伤、褥疮以及高原皮肤病均有较好的治疗效果[14-16]。同时在动物实验中,对于大鼠的紫外线B辐射、糖尿病大鼠皮肤创面、犬皮肤伤口愈合、大鼠颚区皮肤创伤、特应性皮炎中也取得了积极的治疗效果[17-18]。
早在2015年日本学者就已经评估了氢气对银屑病相关关节炎和皮肤病变的改善作用[3]。研究表明给予静脉滴注、口服富氢水或吸入氢气,均可以使银屑病的严重程度评分下降,且降低炎症因子IL-6和TNF-α的水平。复旦大学附属华山医院研究表明每周进行两次氢水浴,每次10~15 min,8周后,可以显著改善银屑病患者的皮损严重程度指数,同时可以缓解瘙痒症状[13],从临床的角度证实了富氢水对于银屑病的治疗作用,但是尚无富氢水在银屑病小鼠模型中的相关研究。
银屑病作为慢性炎症性免疫性疾病,炎症反应贯穿银屑病的发生全程。众多的炎症因子在银屑病患者或银屑病小鼠模型的局部皮肤及血液中呈现出TNF-α、IL-1、IL-6、IL-17A、IL-17F等细胞因子的高表达[19]。咪喹莫特是TLR7/TLR8的配体,作为一种免疫和炎症反应的激活剂,其诱导的银屑病小鼠模型已被广泛应用于银屑病的研究。与银屑病的发病机制类似,咪喹莫特介导的银屑病小鼠模型是基于IL-23/IL-17轴的。IL-23可以通过刺激银屑病病灶内生成大量的角质形成细胞和树突状细胞,进而活化Th17细胞,从而诱导Th17细胞分泌大量的炎症因子IL-17A、IL-17F和IL-22[20],IL-17A又可以募集中性粒细胞到银屑病的皮损组织中[21],IL-6既可以增强中性粒细胞募集,也可以增强角质形成细胞异常增殖[22]。在银屑病早期,树突状细胞可以产生TNF-α,而角质细胞又产生IL-1β和TNF-α来激活树突细胞[23]。IL-6和IL-1β则联合驱动CD4+细胞向Th17细胞亚型[24]分化。咪喹莫特可以通过刺激树突细胞产生TNF-α、IL-6、IL-17A、IL-1这些细胞因子,从而导致角质形成细胞的过度增殖,进而阻碍角质形成细胞的分化[25]。这些炎症因子也同样参与了咪喹莫特诱导的银屑病小鼠模型的发生、发展。因此,本研究对这些细胞因子进行了检测,发现在咪喹莫特诱导的银屑病小鼠模型中,与生理盐水组相比,富氢盐水组病变组织中TNF-α、IL-1、IL-6、IL-17表达及血浆中组织中IL-1、IL-6、IL-17水平明显下降,且富氢盐水组小鼠皮肤组织中炎症因子IL-1、IL-6、IL-17 mRNA水平明显低于生理盐水小鼠。与之前的人群试验结果中炎症因子的表达具有一致性[3]。研究结果表明富氢盐水可以降低银屑病的炎症反应。
氧化应激为细胞活性氧(reactive oxygen species,ROS)的生成和抗氧化防御机制的失衡,会导致皮肤脂质的氧化损伤和屏障蛋白完整性的破坏[26]。氧化代谢产物的增加以及机体抗氧化能力的下降在银屑病中起到重要作用[27]。早期和活动期的银屑病皮疹主要表现为渗透到表皮内的多核白细胞激活导致NADPH氧化酶和蛋白水解酶产生ROS。氧化应激反应中的ROS在银屑病中发挥关键作用[28]。通过观察丙二醛(MDA)及对氧磷酶(PON-1)活性的方法检测活性氧的水平,我们的前期研究表明,寻常型银屑病患者血浆MDA表达显著升高[26]。银屑病患者血浆PON-1活性降低且与银屑病患者的皮损面积及严重程度指数(psoriasis area and severity index,PASI)评分呈负相关[30]。研究证实了氢气的抗氧化作用,通过静脉注射给予氢气生理盐水,发现急性肾脏缺血再灌注动物血浆中的MDA水平明显降低,证明了富氢盐溶液能够通过对抗氧化应激减轻肾脏缺血再灌注引起的氧化损伤[31]。与其他抗氧化剂相比,氢气分子具有由于分子量小、穿透性强、可直接分散到细胞甚至细胞器中的特点。我们发现富氢盐水组的MDA水平明显低于生理盐水组,而富氢盐水组PON-1的活性远高于生理盐水组。结果表明富氢盐水可以通过抗氧化作用改善银屑病的氧化应激反应。
本研究结果表明,富氢盐水明显改善了咪喹莫特诱导的银屑病小鼠的临床及病理表现,这可能与降低了银屑病的炎症反应和氧化指标有关。由于本研究样本量较小,潜在的重要变化可能会被忽略,因此,本实验还存在一定的局限性。另外,本研究只选择了一种给氢方式,未来可以比较不同途径和方法给予氢对银屑病的影响。综上,体外补氢可能是未来治疗和辅助改善银屑病病理表现的一种潜在方法。

