无籽刺梨渣膳食纤维的羧甲基化改性及性质
苏靖程,李 晗,范方宇
(西南林业大学生命科学学院,云南昆明 650224)
无籽刺梨(Rosa sterilis)为蔷薇科蔷薇属落叶灌木植物,具有重要的药用价值与食用价值,含丰富的黄酮、维生素C、超氧化物歧化酶等营养物质[1-2]。但无籽刺梨加工过程会产生40%~50%的果渣,大部分果渣被当作废弃物丢弃,造成严重的资源浪费和环境污染,如何利用无籽刺梨残渣是无籽刺梨加工产业的一项重要课题。无籽刺梨残渣中的膳食纤维(Dietary Fiber,DF)含量高,在食品和医药领域具有很好的应用价值,可降低机体低密度脂蛋白胆固醇含量[3]。高活性DF 更活跃,在功能性质方面有更好的应用,摄入高活性DF 对肥胖症、高血压、高血脂等疾病有预防和治疗作用[4]。目前传统方法提取的DF 活性不高,因此本文采用化学改性中的羧甲基化修饰增强DF 活性,以提高膳食纤维生物活性使其应用范围更广,其中,化学改性引入基团修饰DF 结构,改善DF 性能,以及能提高生物活性的优点使其成为研究热点。羧甲基化修饰是将DF 置于碱性环境发生溶胀,再与一氯乙酸发生醚化反应,将羧甲基基团引入DF 的一种分子修饰方法,该法能有效改善DF的生物活性[5]。
不同比例的可溶/不溶性膳食纤维也优于单独成分,如曾荣妹等[6]报道了刺梨中SDF 含量约为IDF的1/2。而研究普遍认为,可溶性膳食纤维(Soluble Dietary Fiber,SDF)与不溶性膳食纤维(Insoluble Dietary Fiber,IDF)混合后,SDF/IDF 比值接近1:2的总膳食纤维(Total Dietary Fiber,TDF)可作为良好的功能性食品添加剂使用。化学改性DF 在原有基础上各项性质均有提高,混合后的羧甲基膳食纤维预期可以获得良好的性能,目前尚未见此方面的研究。
基于此,本研究以无籽刺梨残渣为原料制备了羧甲基化可溶性膳食纤维(Carboxymethylation Soluble Dietary Fiber,CSDF)和羧甲基化不溶性膳食纤维(Carboxymethylation Insoluble Dietary Fiber,CIDF),并将CSDF 与CIDF 按照不同比例混合,研究改性前后与改性后不同混合比例性能差异,旨在为无籽刺梨渣膳食纤维功能化提供参考依据。
1 材料与方法
1.1 材料与仪器
无籽刺梨 产自云南昆明阿子营;无水乙醇、亚硝酸钠 天津市致远化学试剂有限公司;氢氧化钠、冰醋酸、盐酸、硫酸 云南杨林工业开发区汕滇药业有限公司;葡萄糖 天津市鼎盛鑫化工有限公司;以上试剂均为分析纯。
UV-2600 型紫外可见分光光度计 日本岛津仪器有限公司;5804R 型台式冷冻离心机 德国艾本德股份公司;Brookfield 型旋转式黏度计 美国博勒菲公司;TM-3000 型扫描电镜 日本日立高新技术公司;IR Prestige-21 型傅立叶变换红外光谱仪 日本岛津仪器公司;200F3 型差示扫描量热仪 德国耐驰仪器制造有限公司。
1.2 实验方法
1.2.1 无籽刺梨渣膳食纤维制备 参考李晗等[7]方法制备无籽刺梨可溶性膳食纤维(Rosa sterilisSoluble Dietary Fiber,RSDF)和无籽刺梨不溶性膳食纤维(Rosa sterilisInsoluble Dietary Fiber,RIDF)。
1.2.2 无籽刺梨渣膳食纤维羧甲基化改性条件 参照文献[8]制备羧甲基化无籽刺梨可溶/不溶性膳食纤维,略有修改。其中CSDF 羧甲基化改性工艺条件:乙醇浓度55%、NaOH 浓度15%、碱化时间80 min、一氯乙酸浓度10%、醚化温度60 ℃、醚化时间2.5 h,其取代度为0.60±0.02;CIDF 羧甲基化改性工艺条件:乙醇浓度35%、NaOH 浓度20%、碱化时间60 min、一氯乙酸浓度25%、醚化温度80 ℃、醚化时间2.5 h,取代度为0.53±0.02。
1.2.3 羧甲基取代度测定 参照江连洲等[9]方法测定。称取0.300 g 羧甲基化样品于150 mL 锥形瓶,加入2 mol/L 的HCl 溶液50 mL,37 ℃、120 r/min振荡3 h 后过滤。70%甲醇溶液洗涤至无Cl-离子(滴加AgNO3检测滤液)。将样品溶于50 mL 0.5 mol/L的NaOH 溶液,沸水浴至溶液变透明,加入两滴酚酞(10 g/L)为指示剂后,立即用0.1 mol/L HCl 标准溶液滴定剩余NaOH,红色刚好褪去为滴定终点,按式(1)和式(2)计算羧甲基取代度:

式中:DS为样品羧甲基取代度;X 为每克羧甲基膳食纤维所需HCl 摩尔数;CNaOH为NaOH 溶液浓度,0.5 mol/L;VNaOH为NaOH 溶液体积,50 mL;CHCl为HCl 溶液浓度,0.1 mol/L;VHCl为滴定用HCl溶液体积,mL。
1.2.4 理化性质测定 对RSDF、RIDF、CSDF、CIDF、RTDF1/2、 CTDF1/1、 CTDF1/2、 CTDF1/3、 CTDF1/4、CTDF1/5理化性质及结构表征进行测定和对比分析。其中RTDF1/2指可溶性膳食纤维与不溶性膳食纤维的混合物,CTDF1/2为羧甲基化可溶/不溶性膳食纤维的混合物,下标为两者的比例1:2。
1.2.4.1 膨胀力 参照Rodríguez-Gutiérre 等[10]方法测定。取0.300 g(m1)样品于10 mL 量筒中,读取体积V1,加入8 mL 蒸馏水,振荡均匀,室温静置12 h,读取样品自由膨胀体积V2。按公式(3)计算膨胀力。

1.2.4.2 持水力/持油力 参照Zhang 等[11]方法测定。取0.300 g(m1)样品于50 mL 离心管中,加入8 mL蒸馏水/植物油,振荡,室温静置12 h,5000 r/min 离心10 min,弃上清液/上层油,称取剩余残渣质量(m2)。按式(4)计算持水力/持油力。

1.2.4.3 溶解性 参照Cheng 等[12]方法测定。取0.300 g(m1)样品于100 mL 烧杯中,加入30 mL 蒸馏水,搅拌,75 ℃水浴1 h,5500 r/min 离心15 min,收集上清液,105 ℃烘箱干燥至恒重,称取残留物质量(m3)。按式(5)计算溶解性。

1.2.4.4 黏度 称取一定量样品,配制质量分数2%的悬浊液,1500 r/min,25 ℃搅拌1 h 后用旋转式黏度计测定黏度。
1.2.4.5 吸湿性 参照龚卫华等[13]方法测定。将一定量的干燥样品置于恒重的称量皿中,称重(m4),放入温度25 ℃、相对湿度75%的恒温培养箱中,每隔1 h 对样品(m5)进行称重。按公式(6)计算吸湿率。

参照陶建明等[14]方法,对样品吸湿率进行二项式回归拟合得吸湿方程式(7)。对方程进行一阶求导得吸湿速率方程式(8)。初始吸湿速率r(0)=b;r=0 时达到吸湿平衡,由式(8)得吸湿平衡时间,由式(7)得最大平衡吸湿率。

式中:W 为吸湿率,%;t 为时间,h;r 为t 时刻的吸湿速率,g/h;a、b、c 为吸湿常数。
1.2.4.6 阳离子交换力 参照齐慧等[15]方法测定。称取0.500 g(m)样品于150 mL 锥形瓶中,加入0.1 mol/L的HCl 溶液20 mL,混匀,4 ℃环境静置过夜。用0.2 mol/L 的NaOH 溶液(V3)滴定,同时做试剂空白(V0)。记录滴定时溶液pH 随NaOH 溶液体积消耗产生的变化,作VNaOH–pH 关系图。按式(9)计算阳离子交换力。

1.2.4.7 亚硝酸盐吸附力 参照GB 5009.33-2016《食品中亚硝酸盐与硝酸盐的测定》中分光光度法测定,略有修改。称取0.400 g 样品于150 mL 锥形瓶中,加入200 μg/mL 的NaNO2溶液50 mL。以1 mol/L的HCl 和0.1 mol/L 的NaOH 分 别 调pH 至2.0 和7.0(模拟胃环境与小肠环境),混匀。37 ℃、120 r/min振荡吸附120 min,过滤。取0.1 mL 滤液于具塞刻度试管中,加入1 mL 的0.4%对氨基苯磺酸溶液,混匀,静置5 min 后加入0.2%的盐酸萘乙二胺溶液0.5 mL,加蒸馏水至刻度,混匀,静置15 min。波长538 nm 处测吸光度,由标准曲线y=0.0278x+0.0021,R2=0.9997,吸光值为纵坐标,NO2-含量(mg)为横坐标计算NO2-含量,按式(10)计算NO2-吸附力[12]。

1.2.4.8 葡萄糖吸附力 采用蒽酮比色法[16]测定。称取0.500 g 样品于150 mL 锥形瓶中,加入1 mg/mL的葡萄糖溶液50 mL,混匀。37 ℃、120 r/min 振荡吸附6 h,过滤。取0.1 mL 滤液于具塞刻度试管中,加蒸馏水至2 mL,混匀后加入6 mL 蒽酮-硫酸溶液(0.100 g 蒽酮用80%硫酸溶解,并定容至100 mL棕色瓶),混匀,沸水浴15 min,冷却至室温。波长625 nm 处测定吸光度,由标准曲线y=0.0052x–0.0101,R2=0.9998。吸光值为纵坐标,葡萄糖含量(mg)为横坐标计算得滤液中葡萄糖含量。按公式(11)计算葡萄糖吸附力。

1.2.5 结构表征
1.2.5.1 傅里叶红外光谱(Fourier Transform Infrared,FTIR)分析 采用溴化钾压片法[9],扫描范围4000~500 cm-1。
1.2.5.2 扫描电镜(Scanning Electron Microscopy,SEM)分析 采用扫描电镜对样品的显微结构进行分析,用5000 倍放大的15.0 kV 加速电压对样品进行检测。
1.2.5.3 差示扫描量热法(Differential Scanning Calorimetry,DSC)分析 参考龚卫华等[13]方法,称取5~10 mg 样品于铝制坩埚中,以空坩埚为空白对照,扫描温度范围35~250 °C,升温速度10 °C/min,氮气流速20 mL/min。
1.3 数据处理
每组试验重复3次,结果以(平均值±标准差)表示。采用软件SPSS 20.0 进行Tukey 显著性检验,软件Origin 2018 作图。
2 结果与分析
2.1 羧甲基化无籽刺梨渣膳食纤维性质
由表1可知,CSDF 的膨胀力、持水力、持油力较改性前分别显著提高了8.15、4.74、0.69 倍(P<0.05),CIDF 则分别显著提高了14.64、4.75、0.82 倍(P<0.05)。与Park 等[17]报道相符,这与羧甲基亲水功能有关,膨胀力、持水力、持油力的提高可改善膳食纤维功能性质。RSDF、CSDF 溶解性无显著性差别(P>0.05),因为改性前溶解性已经很高,羧甲基化对溶解性无影响;RIDF 羧甲基化后溶解性提高了1.25 倍(P<0.05),与这是由于羧甲基化过程中,不溶性的部分多糖通过醚化作用,亲水性得到改善,提高了溶解性[11,18]。随CSDF/CIDF 混合比例增加,CTDF膨胀力、持水力、持油力均为先增大后减小。CTDF1/2膨胀力、持水力最高,但与CTDF1/3相比仅高了3.48%(P>0.05)、5.89%(P<0.05)。持油力越高,其油脂、胆固醇、胆酸盐吸附力越好,表中CTDF1/4持油力最高,为4.85±0.14 g/g,但与CTDF1/3相差不大(P>0.05);与CTDF1/3相比时溶解性和黏度均下降。要使膳食纤维的功能特性得到综合利用,CSDF/CIDF 混合比例为1:2、1:3 时效果较好。
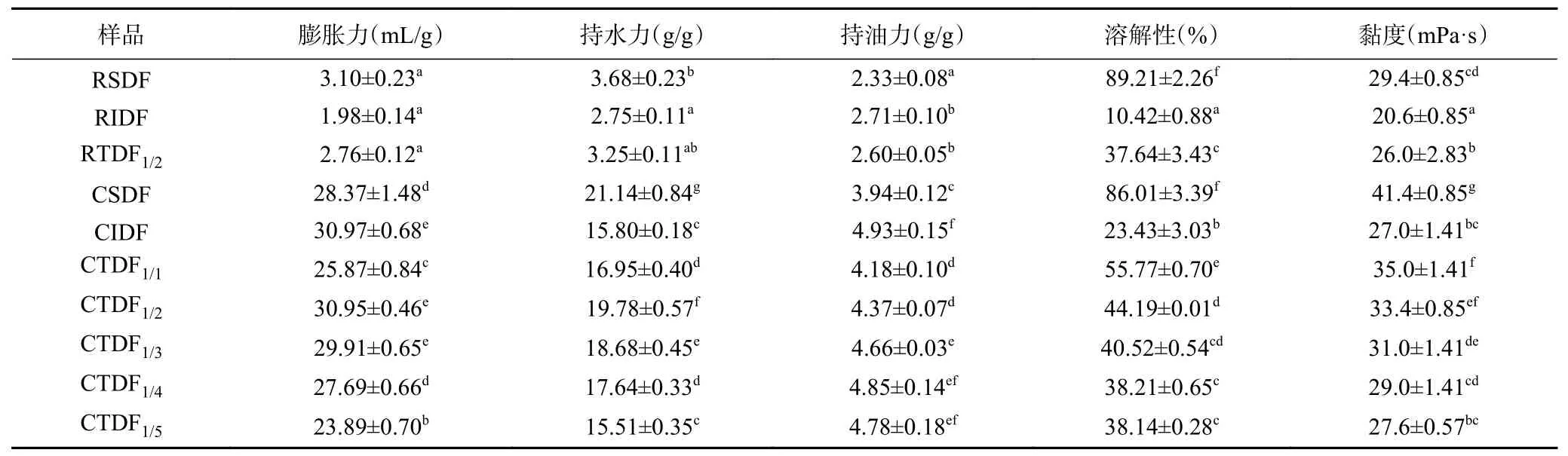
表1 无籽刺梨渣膳食纤维改性前后的性质Table 1 Properties of Rosa sterilis pomace dietary fiber before and after carboxymethylation modification
2.2 羧甲基化无籽刺梨渣膳食纤维吸湿性
图1、表2 分别为无籽刺梨渣膳食纤维改性前后的吸湿曲线和吸湿特性。图1 可见,随时间增加,改性前后的膳食纤维吸湿率均呈先增加后趋于平衡,吸湿速率则随时间增加逐渐减小。图1(a)中经羧甲基化改性后的CSDF、CIDF 吸湿率均得到不同程度的提高。这是因羧甲基化过程引入了亲水基团,样品更容易与空气中的水分子结合,增大了吸湿率[19]。
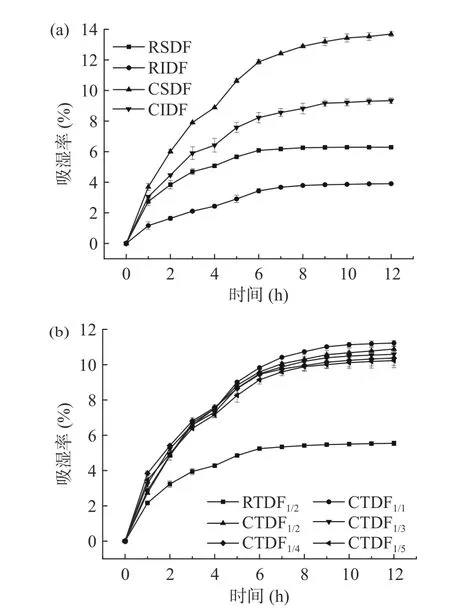
图1 无籽刺梨渣膳食纤维改性前后的吸湿率Fig.1 Hygroscopic curve of Rosa sterilis pomace dietary fiber before and after carboxymethylation modification
表2可知,CSDF、CIDF 初始吸湿速率分别为2.58、1.77 g/h,较RSDF、RIDF 分别提高了1 倍、1.39倍。根据陶建明等[14]报道,吸湿率能直接影响膳食纤维在环境中的吸潮性能,对功能性质及存放时间造成影响。CTDF 初始吸湿速率、吸湿平衡时间和最大吸湿率随CSDF/CIDF 比例增加而逐渐减小。与CTDF1/1相比,CSDF/CIDF 比例1:2~1:5 时,最大吸湿率分别降低了3.43%、5.36%、7.03%、8.70%。表明吸湿率与CSDF 含量有关。CSDF 含量减少,能与水分子结合的极性基团数量减少,导致吸湿率下降。

表2 无籽刺梨渣膳食纤维改性前后的吸湿特性Table 2 Hygroscopic properties of Rosa sterilis pomace dietary fiber before and after carboxymethylation modification
2.3 羧甲基化无籽刺梨渣膳食纤维阳离子交换性质
图2为VNaOH–pH 关系图,图3 为无籽刺梨渣膳食纤维改性前后阳离子交换力。图2(a)中,pH 达到12 后,变化趋于平衡。此时CSDF、CIDF 阳离子交换力分别为1.00、0.79 mmol/g,较改性前分别提高了0.25 倍、0.98 倍。Zhang 等[11]研究发现,羧基和羟基酚基是影响阳离子交换力的主要官能团,能与Na+、K+、Ca2+等发生可逆交换,起到降血压的作用。膳食纤维具有较强的阳离子交换功能,能与肠道中的Na+和K+进行交换,促进其从尿液和粪便中排出,从而降低血液中的Na+/K+,产生降血压效果。因此,羧甲基含量增加,CSDF、CIDF 的阳离子交换力增强,降血压能力得以提高。
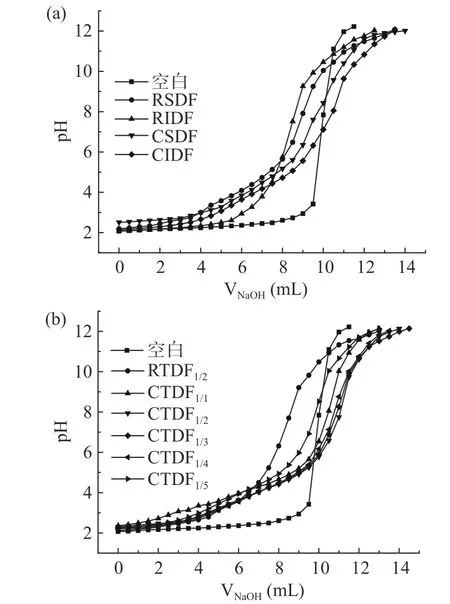
图2 无籽刺梨渣膳食纤维改性前后的阳离子交换力VNaOH–pH 关系图Fig.2 VNaOH – pH relationship between cation exchange capacity of Rosa sterilis pomace dietary fiber before and after carboxymethylation modification
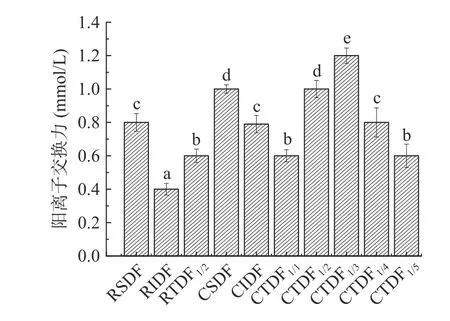
图3 无籽刺梨渣膳食纤维改性前后的阳离子交换力Fig.3 Cation exchange capacity of Rosa sterilis pomace dietary fiber before and after carboxymethylation modification
图2与图3 可见,随NaOH 体积增加,CSDF、CIDF、CTDF1/1~1/5的pH 上升速度分别低于RSDF、RIDF、RTDF1/2。CSDF/CIDF 混合比例增加至1:3时,阳离子交换力最大,为1.20 mmol/g,比CTDF1/2高了20%。表明CSDF/CIDF 混合比例1:3 时,阳离子交换力最好。
2.4 羧甲基化无籽刺梨渣膳食纤维亚硝酸盐吸附性
图4为无籽刺梨渣膳食纤维改性前后的NO2-吸附力。据Song 等[20]报道,膳食纤维的摄入能吸附人体内NO2-,防止过量NO2-损伤人体机能。图4可见,模拟胃肠环境中,CSDF、CIDF 的NO2-吸附力均增强。CSDF、CIDF 在胃中的NO2-吸附力分别为22.33±0.13、20.31±0.12 mg/g,较改性前分别显著提高了11.09%、12.27%(P<0.05);CSDF、CIDF 在肠中的NO2-吸附力分别为8.03±0.14、7.28±0.14 mg/g,较改性前分别显著提高了56.84%、68.52%(P<0.05),肠环境NO2-吸附力低于胃,这与Zheng 等[21]的研究结果类似。这是因肠环境中pH 高于胃环境,膳食纤维表面负电荷密度更多,与NO2-排斥反应增大。改性后的膳食纤维较改性前具有结构蓬松,孔隙更大和更多的羧甲基基团[12],该结构特点增强了CSDF、CIDF 与NO2-之间的作用,提高对NO2-吸附量。图4(b)可见,随CSDF/CIDF 混合比例增加至1:3,胃肠环境中CTDF 对NO2-的吸附力增加;比例高于1:3 后,吸附力显著下降(P<0.05)。CTDF1/3的NO2-吸附力最高(P<0.05),胃中为23.62±0.15 mg/g,肠中为10.08±0.22 mg/g。表明CSDF/CIDF 混合比例1:3时,对NO2-吸附力最好。
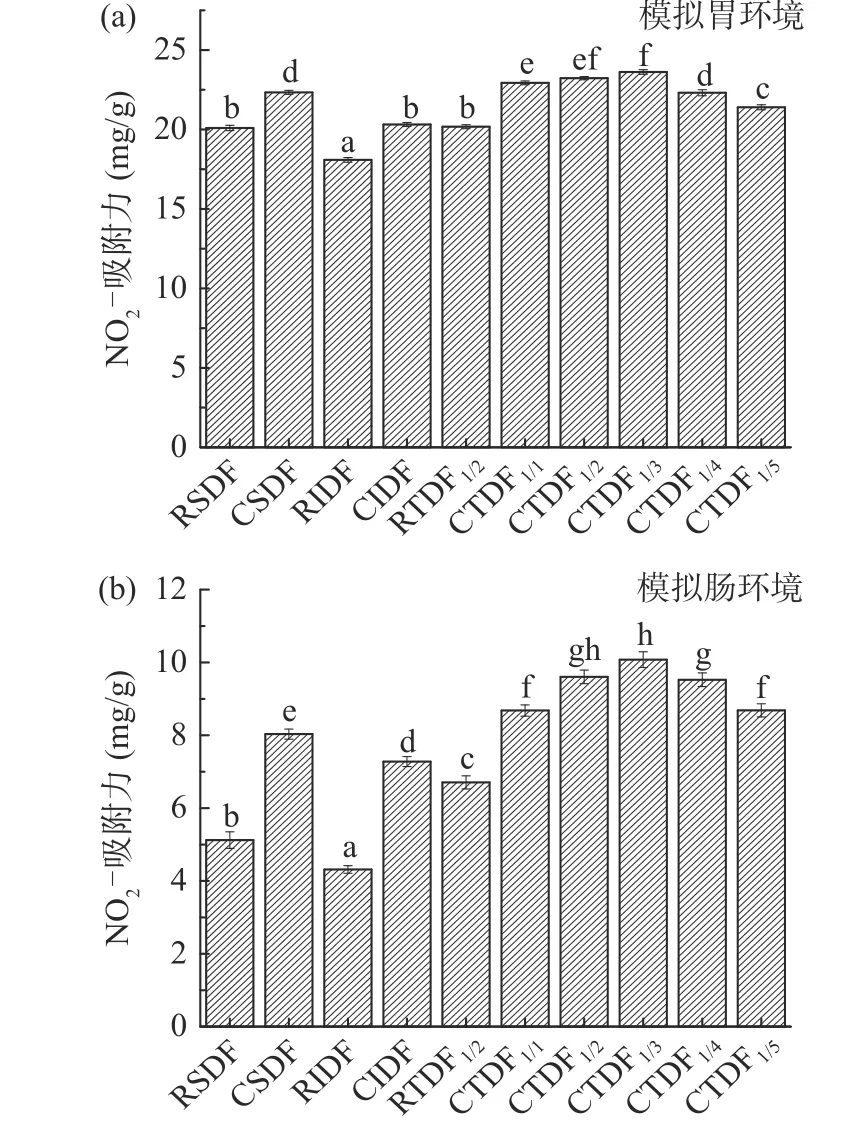
图4 无籽刺梨渣膳食纤维改性前后的亚硝酸盐吸附力Fig.4 Nitrite adsorption capacity of Rosa sterilis pomace dietary fiber before and after carboxymethylation modification
2.5 羧甲基化无籽刺梨渣膳食纤维葡萄糖吸附性
图5为无籽刺梨渣膳食纤维改性前后的葡萄糖吸附力比较。据Luo 等[22]报道,膳食纤维对葡萄糖的吸附可有效控制餐后体内血糖水平,间接调控机体脂质代谢过程,对预防和辅助治疗糖尿病具有一定作用。据林良美[16]研究,SDF 与水溶后形成黏膜,延缓小肠对食物中营养成分的吸收速率从而有效降低餐后血糖;IDF 则利用其特殊的网状结构吸附葡萄糖,降低葡萄糖被小肠消化吸收的速度,达到降低血糖的目的,但效果不及SDF;而TDF 中包括了SDF 和IDF所具备的功能力,因而CTDF1/3的吸附葡萄糖的能力最好。图5 可见,CSDF、CIDF 葡萄糖吸附力较改性前显著提高(P<0.05),几种混合比例的CTDF 吸附力均显著高于RTDF1/2(P<0.05)。表明羧甲基的引入增强了膳食纤维对葡萄糖吸附力。此外,随CSDF/CIDF 混合比例增加至1:3,葡萄糖吸附力显著增加(P<0.05),为52.54±0.51 mg/g;其次是CTDF1/2,为47.59±0.80 mg/g,较CTDF1/3显著降低了9.42%(P<0.05)。混合比例不同,样品结构有差异,对吸附力的影响也不同。CSDF/CIDF 混合比例1:3 时,葡萄糖吸附力最好。

图5 无籽刺梨渣膳食纤维改性前后的葡萄糖吸附力Fig.5 Glucose adsorption capacity of Rosa sterilis pomace dietary fiber before and after carboxymethylation modification
2.6 FTIR 分析
图6为无籽刺梨渣膳食纤维改性前后的红外光谱图。图6(a)可见,3426 cm-1处表现出较宽的拉伸强烈特征峰,与N-H 或O-H 的伸缩振动有关[23],CSDF、CIDF 在3426 cm-1处峰的强度分别高于RSDF、RIDF,表明CSDF 和CIDF 中-OH 含量更多。2921 cm-1处是由C-H 伸缩振动引起的吸收峰,RIDF、CIDF 在此处的峰强分别略高于RSDF、CSDF,这是因为RIDF、CIDF 中含有较多木质素、纤维素[24]。1614 cm-1附近为羧甲基中C=O 的非对称振动吸收峰,1415 cm-1处为C=O 的对称振动吸收峰,1323 cm-1处为O-H的面内变角振动吸收峰[25]。这几个峰是羧甲基的特征吸收峰,图6(a)中,CSDF、CIDF 在这几个峰的强度明显增大,表明羧甲基基团被成功引入,CSDF、CIDF 羧甲基化成功。图6(b)可见,CSDF/CIDF混合比例不同,羧甲基特征吸收峰强度也有所不同。1614 cm-1处峰强度大小为CTDF1/2>CTDF1/3>CTDF1/4>CTDF1/1>CTDF1/5,表明了混合膳食纤维羧甲基取代度的大小。

图6 无籽刺梨渣膳食纤维改性前后的红外光谱图Fig.6 Infrared spectra of Rosa sterilis pomace dietary fiber before and after carboxymethylation modification
2.7 SEM 分析
图7(a)、图7(b)、图7(e)可见,RSDF、RIDF、RTDF1/2结构紧密,表面较为平整,呈块状分布,颗粒较少。而CSDF、CIDF 经羧甲基化改性后,其形态结构发生变化,结构变疏松,孔隙变大;表面粗糙且观察到有大量褶皱和片状物质。羧甲基引入CSDF、CIDF 内部的碱化过程中,纤维素和半纤维素被破坏,引起表观形态发生的变化[26]。图7(e)~图7(j)可见,CSDF/CIDF混合比例1:2~1:4 时,CTDF 表面的褶皱、孔洞和片状物质更多,结构完整性被破坏,物质本身孔隙增加,表面积增大,利于吸附,对样品活性和性能产生积极影响[27]。
2.8 DSC 分析
图8(a)可见,经羧甲基化改性的膳食纤维贮藏稳定性更好。CSDF 热溶解温度较RSDF 提高了3.52%,为147 ℃;CIDF 热溶解温度较RIDF 提高了51.43%,为159 ℃,表明羧甲基的引入提高了热稳定性。这是因为CSDF、CIDF 中游离的羟基被羧甲基取代[23],引入羧甲基基团,内部结构发生改变,这与DSC 分析结果相符。图8(b)可见,RTDF1/2、CTDF1/2的热溶解温度分别为123 和140 ℃,CTDF1/2比RTDF1/2提高了13.82%。此外,CSDF/CIDF 混合比例为1:1~1:3 时,CTDF 热溶解温度随混合比例的增加逐渐升高;混合比例1:3 时,CTDF1/3热溶解温度达到最高,为145 ℃。与CTDF1/3相比,CTDF1/4和CTDF1/5热溶解温度分别降低了12.41%、16.55%。推测这是因CSDF、CIDF 本身组成结构不同,CSDF 包括了羧甲基化后果胶、寡糖、可溶性半纤维素等物质,CIDF包括羧甲基后的纤维素、半纤维素和木质素等物质,所以各自发挥的功能存在差异,CSDF/CIDF 按不同比例混合时,对两者产生的协同作用有一定影响,随着CIDF 量的增加,CSDF 占比逐渐减小,致使热溶解温度在CSDF/CIDF 比例高于1:3 后降低,该现象说明CTDF1/3热稳定性最强,贮藏稳定性及应用范围更好。

图8 无籽刺梨渣膳食纤维改性前后的DSC 曲线Fig.8 DSC curves of Rosa sterilis pomace dietary fiber before and after carboxymethylation modification
3 结论
通过羧甲基法对RSDF 与RIDF 改性,研究改性前后及CTDF 以1:1~1:5 混合比例的性质,主要结论如下:
a.对比改性前,CSDF、CIDF 膨胀力、持水力、持油力、溶解性、黏度、吸湿性均显著提高(P<0.05)。改性后CSDF、CIDF 阳离子交换力提高了1.25 倍、1.98 倍。CSDF、CIDF 对NO2-的吸附力在胃中显著提高了11.09%、12.27%(P<0.05);在肠环境中对NO2-的吸附力较改性前显著提高了56.84%、68.52%(P<0.05)。CSDF、CIDF 葡萄糖吸附力较改性前显著提高了65.28%、115.55%(P<0.05)。由FTIR 分析可知CSDF、CIDF 羧甲基化成功,COO—基团被成功引入;SEM 分析可见,羧甲基化后,改性后两种膳食纤维均呈现多孔结构、表面粗糙;由DSC可知CSDF、CIDF 热稳定性进一步提高。综上,羧甲基化改性能有效改善膳食纤维的理化性质与功能特性。
b.由CTDF 混合比例的研究可知,混合比例1:3时发挥的功能作用更好。此时,CTDF1/3取代度为0.53±0.02,吸湿率为10.77%。CTDF1/3阳离子交换力和葡萄糖吸附力均最高(P<0.05)。CTDF1/3的NO2-吸附力在胃环境与肠环境中皆为最高(P<0.05)。由FTIR 分析可知,CTDF1/3在红外光谱中羧甲基特征峰最为明显,SEM 分析可见,CTDF1/3结构疏松多孔,有利于吸附的进行,由DSC可知CTDF1/3热溶解温度最高,为145 °C,具有较好的热稳定性。综上,要综合发挥改性后混合膳食纤维的功能作用,CSDF/CIDF 混合比例1:3 时CTDF 功能作用能得到最大程度的发挥和利用。

