血清CYP2R1对核苷类似物/IFN-α治疗CHB疗效的预测价值
王元英
(儋州市中医医院药剂科,海南省儋州市 571700)
慢性乙型肝炎(chronic hepatitis B,CHB)由乙型肝炎病毒(hepatitis B virus,HBV)感染引起,影响全球约2.57亿人口[1]。核苷类似物(nucleoside analogues,NAs)规范治疗后未获得病毒学或血清学应答或耐药及复发患者需调整治疗策略[2-3],这类CHB患者再采用聚乙二醇干扰素-α(pegylated interferon,PEG-IFN-α)序贯治疗能提高乙型肝炎表面抗原(hepatitis B surface antigen,HBsAg)转阴率,但部分患者仍出现IFN-α应答不佳的现象[4]。维生素D在细胞色素P450家族2亚家族R成员1(cytochrome P450 family 2 subfamily R member 1,CYP2R1)的催化下进行25羟化生成具有生物活性的25-羟维生素D3[25(OH)D3],血清25(OH)D3水平与HBV DNA含量高度负相关[5]。本文探讨血清CYP2R1水平对NAs/IFN-α治疗CHB患者疗效的预测价值。
1 资料和方法
1.1 一般资料
选取2019年1月—2021年1月接受经NAs治疗的78例CHB患者为CHB组(n=78)。纳入标准: ①符合《慢性乙型肝炎防治指南》(2019年版)[6]中CHB相关诊断和NAs治疗标准;②年龄18~60岁;③首次接受IFN-α治疗,既往接受NAs治疗1年以上;④符合PEG-IFN-α用药指征[7]:NAs治疗后病毒学应答不佳或耐药,或达到满意终点后复发者;⑤无内分泌系统疾病;⑥签署知情同意书。排除标准:①合并自身免疫性肝炎、酒精性肝病、非酒精性脂肪肝者;②入组前半年内使用过皮质类固醇或免疫调节剂者;③IFN-α注射禁忌者;④合并其他恶性肿瘤,心、肺、肾功能严重障碍者;⑤妊娠或哺乳期妇女。另选取同期本院体检中心40例健康志愿者为对照组。收集研究对象性别、年龄、BMI、肝功能等临床资料,两组基线资料比较见表1。本研究获得本院伦理委员会批准。

表1 CHB组与对照组基线资料比较
1.2 治疗方法
CHB组给予Peg-IFN-α-a(上海罗氏制药有限公司,每支180 mg/0.5 mL),皮下注射,1支/周,共48周。入组后前8周联合恩替卡韦(中美上海施贵宝制药有限公司,0.5 mg/片)口服,1片/次,1次/天,入组后前8周服药。
1.3 CYP2R1检测
分别于IFN-α治疗0、4、12、24、36、48周时,采集患者空腹静脉血,置于EDTA抗凝采血管中。对照组于体检时采集血液样本。抗凝血5 mL离心收集上层血浆,酶联免疫吸附试验检测血清CYP2R1水平,严格按照试剂盒(美国Abcam公司产品)进行操作。MultiskanTMFC酶标仪(美国Thermo公司产品)测定450 nm处的光密度值,根据标准曲线计算血清CYP2R1水平。
1.4 病毒学应答的检测
于IFN-α治疗前采用RT-PCR法检测血清HBV DNA,试剂盒购自中山大学达安基因股份有限公司。病毒学应答是指血清HBV DNA转为阴性。治疗48周时,将CHB组发生病毒学应答的48例患者纳入应答组,其余30例患者纳入非应答组。
1.5 其他实验室指标检测
采用罗氏COBAS MIRA化学分析仪(罗氏公司产品)检测肝功能血清天门冬氨酸氨基转移酶(aspartate aminotransferase,AST)、谷丙转氨酶(alanine transaminase,ALT)、总胆红素(total bilirubin,TBIL)。分别于IFN-α治疗0、48周时,采用化学发光免疫分析法检测HBsAb、HBsAg、HBeAb、HBeAg及HBcAb,试剂盒购自美国雅培公司。采用DxH800血细胞分析仪(美国贝克曼库尔特有限公司产品)检测患者采用酶联免疫吸附法检测血清25(OH)D3水平,试剂盒购自上海西格生物科技有限公司。血小板计数(platelet count,PLT)、白细胞计数(white blood cell count,WBC)等血常规指标。
1.6 统计学方法
采用SPSS 24.0统计学软件分析数据,计量资料两两比较采用t检验,计数资料采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 两组治疗前CYP2R1水平比较
入组时CHB组IFN-α治疗前血清CYP2R1低于对照组(P<0.05;表1)。
2.2 应答组与非应答组不同治疗时间CYP2R1水平比较
IFN-α治疗0、4、36、48周时应答组与非应答组CYP2R1表达水平差异无统计学意义(P>0.05),治疗12、24周时应答组CYP2R1表达水平高于非应答组(P<0.05;表2)。

表2 应答组与非应答组不同治疗时间CYP2R1表达水平比较 单位:ng/L
2.3 应答组与非应答组基线资料比较
入组时应答组IFN-α治疗前AST、ALT及25(OH)D3高于非应答组,WBC和HBV DNA载量低于非应答组(P<0.05;表3)。

表3 应答组与非应答组基线资料比较
2.4 IFN-α抗病毒疗效的多因素Logistic回归分析
以不同治疗时间CYP2R1、IFN-α治疗前AST、ALT、HBV DNA载量及25(OH)D3为自变量(均赋值为连续变量),以病毒应答为因变量(应答赋值为0,非应答赋值为1),进行Logistic回归分析,结果显示IFN-α治疗前HBV DNA载量、25(OH)D3及治疗12、24周时CYP2R1是影响IFN-α抗病毒疗效的独立危险因素(P<0.05;表4)。
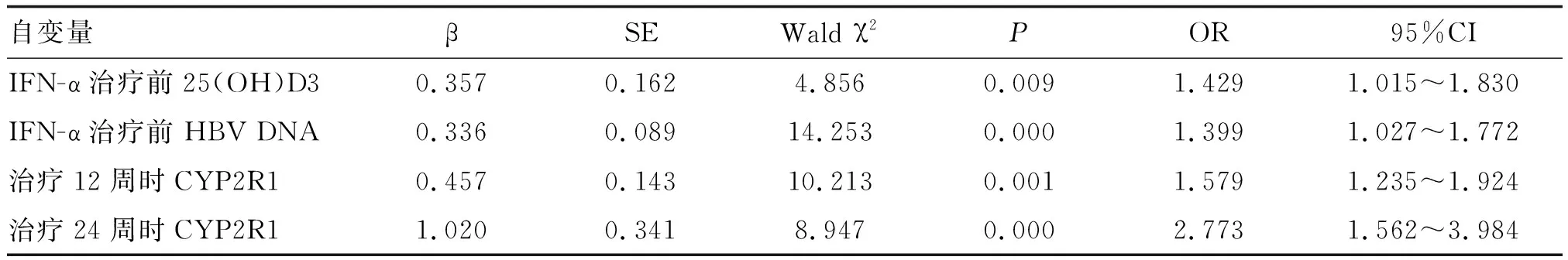
表4 影响IFN-α抗病毒疗效的多因素Logistic回归分析
2.5 治疗12、24周时血清CYP2R1水平对IFN-α抗病毒疗效的预测价值
治疗12周时血清CYP2R1预测IFN-α抗病毒疗效的AUC(95%CI)为0.673(0.540~0.805),最佳截断值为2.52 ng/L,灵敏度为60.42%,特异度为70.00%;治疗24周时血清CYP2R1预测IFN-α抗病毒疗效的AUC(95%CI)为0.774(0.667~0.881),最佳截断值为2.95 ng/L,灵敏度为72.92%,特异度为83.33%;24周较12周血清CYP2R1预测抗病毒疗效效能升高(Z=7.127,P<0.05;图1)。
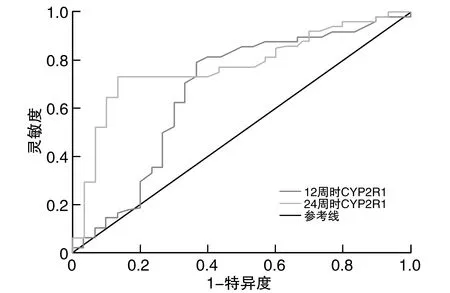
图1 CYP2R1水平对IFN-α抗病毒疗效的ROC曲线
3 讨 论
NAs通过阻断反转录来抑制HBV增殖,停止给药很可能会导致病毒反弹,从而导致肝炎的重新激活,需长期服用,但长期服用易产生耐药突变[7]。IFN-α以非特异性的方式诱导干扰素刺激基因表达,直接或间接发挥抗病毒活性[8]。CHB患者接受IFN-α治疗HBeAg血清学转换和HBsAg血清清除率更高,且疗程有限[9]。在接受NAs长期治疗的CHB患者中选择有望达到停药标准的患者,给予IFN-α治疗有利于其获得更高的应答率和HBsAg消失率。
本研究发现,CHB组IFN-α治疗前血清CYP2R1低于健康组,表明NAs经治患者25(OH)D3合成可能受阻。应答组治疗12、24周CYP2R1表达水平高于非应答组,表明血清高CYP2R1表达水平与CHB患者高应答率相关。Logistic分析表明IFN-α治疗12、24周时CYP2R1是影响IFN-α抗病毒疗效的独立危险因素,提示CYP2R1可能是一个潜在的预测抗病毒疗效的标志物。治疗24周时血清CYP2R1预测IFN-α抗病毒疗效的AUC灵敏度和特异度均较12周时升高,提示治疗24周时血清CYP2R1水平对IFN-α的应答情况预测价值更高。
应答组IFN-α治疗前AST、ALT、HBV DNA载量及25(OH)D3可能与IFN-α抗病毒疗效相关。CYP2R1在维生素D代谢中起主导作用。25(OH)D3水平与HBV DNA水平密切相关,推测其参与HBV抗病毒治疗过程[10]。本研究中CYP2R1水平对IFN-α治疗病毒应答的预测效能较高,推测其可能通过调控维生素D的代谢发挥影响抗病毒效果的作用。IFN-α通过刺激免疫细胞活化激活细胞免疫应答,加速HBV清除和HBeAg转阴[11]。血清ALT是反映肝损伤常用指标,血清高ALT的CHB患者细胞免疫功能得到强化,导致HBV易于清除。低基线HBV DNA对IFN-α有更高的应答率,这可能是因为低基线HBV DNA表明肝脏的炎性水平较低,病程较早,治疗效果好[12]。
综上,NAs/IFN-α治疗过程中应答与非应答CHB患者CYP2R1水平存在差异,CYP2R1可作为判断NAs经治CHB患者IFN-α抗病毒疗效敏感指标。对长期接受NAs治疗的CHB患者停药后再接受IFN-α治疗具有一定的参考价值。