针康法对慢性脑低灌注大鼠海马形态结构及GAP-43蛋白的影响
冉茂花,赵小娟,王 璐,李 季,张 立,3△
(1.黑龙江中医药大学,黑龙江 哈尔滨 150040;2.南昌大学抚州医学院,江西 抚州 344000;3.黑龙江省中医药科学院,黑龙江 哈尔滨 150036)
慢性脑低灌注(CCH)是指全脑组织长时间处于缺血缺氧状态,进而出现渐进性、持久性的神经功能和认知功能障碍[1]。CCH是血管性认知障碍(VCI)的主要原因[2]。海马是认知领域的关键区域,其突触的生成、数目和功能被认为是极其重要的神经生理基础。GAP-43是一种控制F-肌动蛋白动态的主要生长锥蛋白,在神经连接、突触形成和轴突再生中起着关键作用,是发育神经再生的标志[3]。研究发现[1-2],脑部血流长期灌注不足会引起控制学习、记忆功能的海马神经元缺血,进而导致神经元、突触损伤和细胞凋亡。前期研究[4-6]在神经元细胞凋亡、自噬和脑白质损伤等层面证实针康法可有效改善CCH所致的认知功能减退。本实验通过观察针康法对慢性低灌注大鼠学习与记忆能力和GAP-43的影响,并探讨相关机制,以期指导VCI的临床治疗。
1 材料与方法
1.1 实验动物及分组
选用济南朋悦实验动物繁育有限公司SPF级别的SD成年雄性大鼠[许可证书编号为:SCXK(鲁)2019-0003],年龄9周左右,体质量为170~220 g。适应性喂养5 d,利用跑台训练和Morris水迷宫实验(Morris water maze, MWM)剔除有视觉障碍、体弱和运动力差以及少数不配合游泳(潜水)的SD大鼠后,随机选用60只入组,编号(1~60)称重按照选随机数字法把大鼠分为假手术组(n=12)和手术组。其中手术组采用双侧颈总动脉结扎(2-VO)制备慢性低灌注模型。造模成功后随机分为模型组、针刺组、康复组和针康组,每组12只(n=12)。
1.2 主要仪器和试剂
1.2.1 仪器 ZH-PT型动物实验跑台(安徽正华生物仪器设备有限公司);Morris水迷宫摄像机SSC-G218(日本索尼公司);HM340E切片机[塞默尔世尔(上海)仪器有限公司];透射电子显微镜(日立H-7650);WB系统(美国BIO-RAD公司)。
1.2.2 试剂 4 %多聚甲醛溶液(雷根生物);HE染色试剂盒(碧云天生物科技有限公司);GAP-43抗体(美国Cell Signaltng Technology公司)。
1.3 动物造模
1.3.1 慢性低灌注模型制备 配置10 %水合氯醛麻醉药物,称量体质量后,进行腹腔注射麻醉(0.35 mL/100 g)。待其麻醉后仰卧于鼠板上,固定四肢,颈项部备皮,碘伏消毒后剪切约1.3 cm左右的开口,钝性分离皮下组织,暴露一侧颈总动脉(Common carotid arte-ry,CCA),用4.0结扎线永久性结扎颈总动脉的近端与远端,并用手术剪从中间剪断,同样方法操作另一侧,逐层缝合、消毒[7]。
假手术组操作:同样采用制备手术组的方法步骤,将准备好的大鼠颈项部进行剃毛备皮,但只需找出CCA并仔细分离,不需结扎和剪断,直接进行组织和皮肤的缝合。
1.3.2 造模成功标准 具备慢性低灌注模型的大鼠表现出两眼球向内侧压低、瞳孔和眼裂均缩小、对外部刺激反应缓慢迟缓、伤害警觉性和抵抗力降低,即霍纳氏综合征[8]。
1.4 实验步骤及干预方法
1.4.1 实验步骤 大鼠适应性喂养5 d后,采用动物实验跑台训练和MWM筛选出实验对象。建模前5 d做MWM行为学测验,之后开始制备模型,建模后第28 d为模型成功时间。在治疗开始前进行MWM测验,之后进行28 d的治疗,治疗结束后做MWM行为学测验,测验完成后取脑,分离海马组织备用,用于HE染色和GAP-43蛋白检测。
1.4.2 假手术组、模型组 不进行任何干预,正常饲养即可。
1.4.3 针刺组 成模后开始为期4周的头穴丛刺干预,参考大鼠穴位图谱[9],选用0.25 mm×25 mm针灸针,固定大鼠颈部和前肢后,取百会穴及其左、右各旁开2 mm处向前顶方向进针,捻针1 min,2 h后取针,将大鼠归笼进行正常饲养,1次/d。
1.4.4 康复组 采用实验跑台训练,按照试验方案调好参数值(训练坡度:0 °;训练速度:1~3 d为8 m/min,4~6 d为10 m/min,6 d之后为12 m/min),然后将大鼠放置跑道上训练30 min,1次/d。
1.4.5 针康组 先进行头针治疗,捻针1 min后,将带有头针的大鼠放置跑道上开始训练,30 min后取出大鼠,再留针1.5 h后取针,1次/d,具体操作方法同针刺组和康复组。
1.5 标本取材及处理方法
随机选取6只大鼠进行麻醉,具体方法参照造模麻醉。待大鼠麻醉后,将其置于冰盒上快速取脑,剥离出海马体,入冻存管封盖,并快速置入约-200 ℃液氮中冷冻,5 min后取出存放于-80 ℃的冰箱中。剩余6只行心内灌注取脑术,麻醉后在其腹部膈肌下开胸,用止血钳翻夹起膈肌,使心脏全部露出来,将大鼠右心耳剪开一小口,同时立即将注射针头刺入左心室并固定,先快速的注射生理盐水(0.9%),观察其肝脏和肺叶变白以及灌注流出来的水变清澈时,再改注射4 %多聚甲醛(PFA)溶液。随后切开大鼠颈部,剔除脑颅骨,分离海马,4 %多聚甲醛固定,4 ℃固定48 h备用。
1.6 指标检测
1.6.1 Morris行为学测验(MWM) 装置中注入大量水(温度约23 ℃),同时可加入食品级黑色素,便于摄像头追踪大鼠的活动轨迹。在正式开始做MWM的前1 d,先让大鼠适应性游泳,可以使其适应游泳环境,还可以剔除无法入本实验的大鼠。治疗4周后,各组大鼠分别进行MWM。
定位航行实验(place navigation):将大鼠随机从4个不同的象限放入水中,记录大鼠在1 min内找到圆形平台并上平台所需要的时间(即逃避潜伏期)。需注意在平台上停留的时间超过5 s才为有效,在1 min内找不到圆形平台的大鼠,可以认为干预指引其上平台并暂时停留数秒,其逃避潜伏期应计为60 s。每天测4次,取4次的均数为当天大鼠的逃避潜伏期。
空间探索实验(spatial probe test):第5天将水下1 cm处的圆形平台取出,观察大鼠1 min内越过原平台位置的次数。过原平台位置的频次越高,表明记忆程度越高。
1.6.2 HE染色 将海马组织经梯度乙醇脱水,二甲苯透明,石蜡渗透、包埋后,切成厚度约4 μm的石蜡切片,石蜡切片脱蜡至水,苏木精染核10 min,自来水洗,盐酸酒精(1%)分化1 min,氨水(0.6%)酒精返蓝,伊红染细胞质3 min,水洗脱水透明后中性树胶封片。
1.6.3 Western blot检测 取出冻存管中的海马组织,剪碎,RIPA裂解液冰上裂解,在低温(4 ℃)高速(12 000 rpm)的离心机中离心10 min,取上清液当作总蛋白液,BCA法测蛋白浓度,SDS-PAGE凝胶电泳,转膜,5 %脱脂奶粉封闭,一抗4 ℃孵育过夜,TBST溶液清洗5 min,共4次,二抗室温0.5 h,入TBST清洗5 min,共4次,ECL显影,采用A1phaEase FC软件设备,观察目标条带并分析光密度值。
1.7 统计学处理
2 结果
2.1 各组大鼠认知功能比较
Mrioss水迷宫检测大鼠行为学变化,与假手术组相比,模型组逃避潜伏期显著延长,寻找原始平台次数明显降低,差异有统计学意义(P<0.05);与模型组相比,各治疗组大鼠逃避潜伏期显著缩短,寻找原始平台次数显著增加,差异有统计学意义(P<0.05);与针刺组和康复组比较,针康组逃避潜伏期显著缩短,寻找原始平台次数显著增加,差异有统计学意义(P<0.05)。见表1~2。

表1 各组大鼠于造模前、治疗前和治疗后的逃避潜伏期比较

表2 各组大鼠于造模前、治疗前和治疗后的穿越平台次数比较
2.2 各组大鼠海马形态结构变化
假手术组大鼠海马神经元细胞及突触间排列密集且有序、数量众多、种类繁多和结构完整,神经元丢失不明显,各细胞器内未见明显受损,细胞胞浆清晰透亮、核圆而大、仁清晰、突触细胞结构完整和边缘清晰。相较于假手术组,模型组大鼠细胞和突触间布列稀疏、量少且结构不完整,神经元严重丢失,细胞和突触结构萎缩、形态不规整且呈多角形或梭形、核膜边界模糊,胞质内发生水肿、核固缩和仁不清。与针刺组、康复组相比,针康组大鼠形态学结构、海马突触细胞数量以及神经元丢失情况改善更为明显。见图1~2。
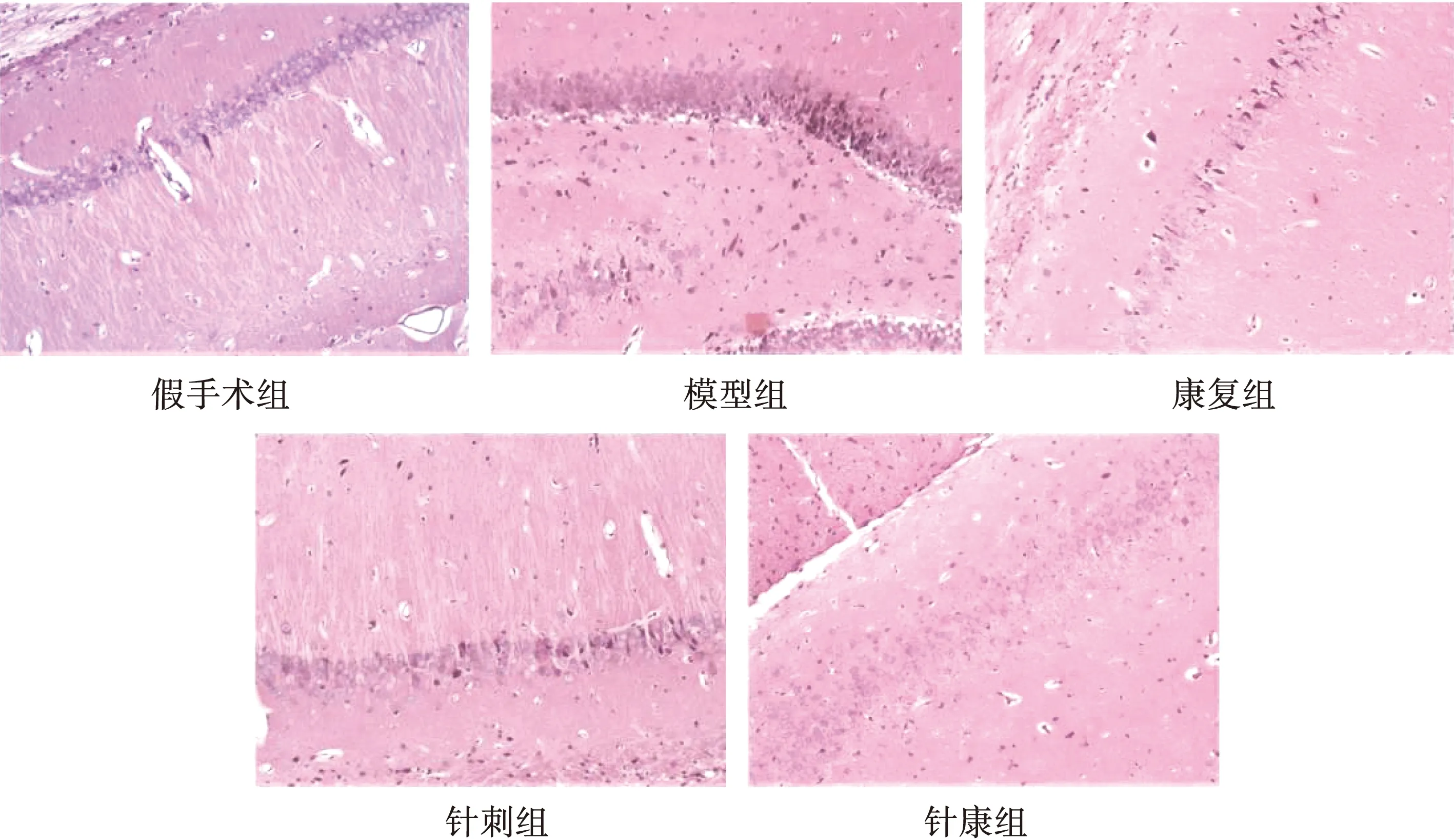
图1 各组大鼠HE染色结果(100×)
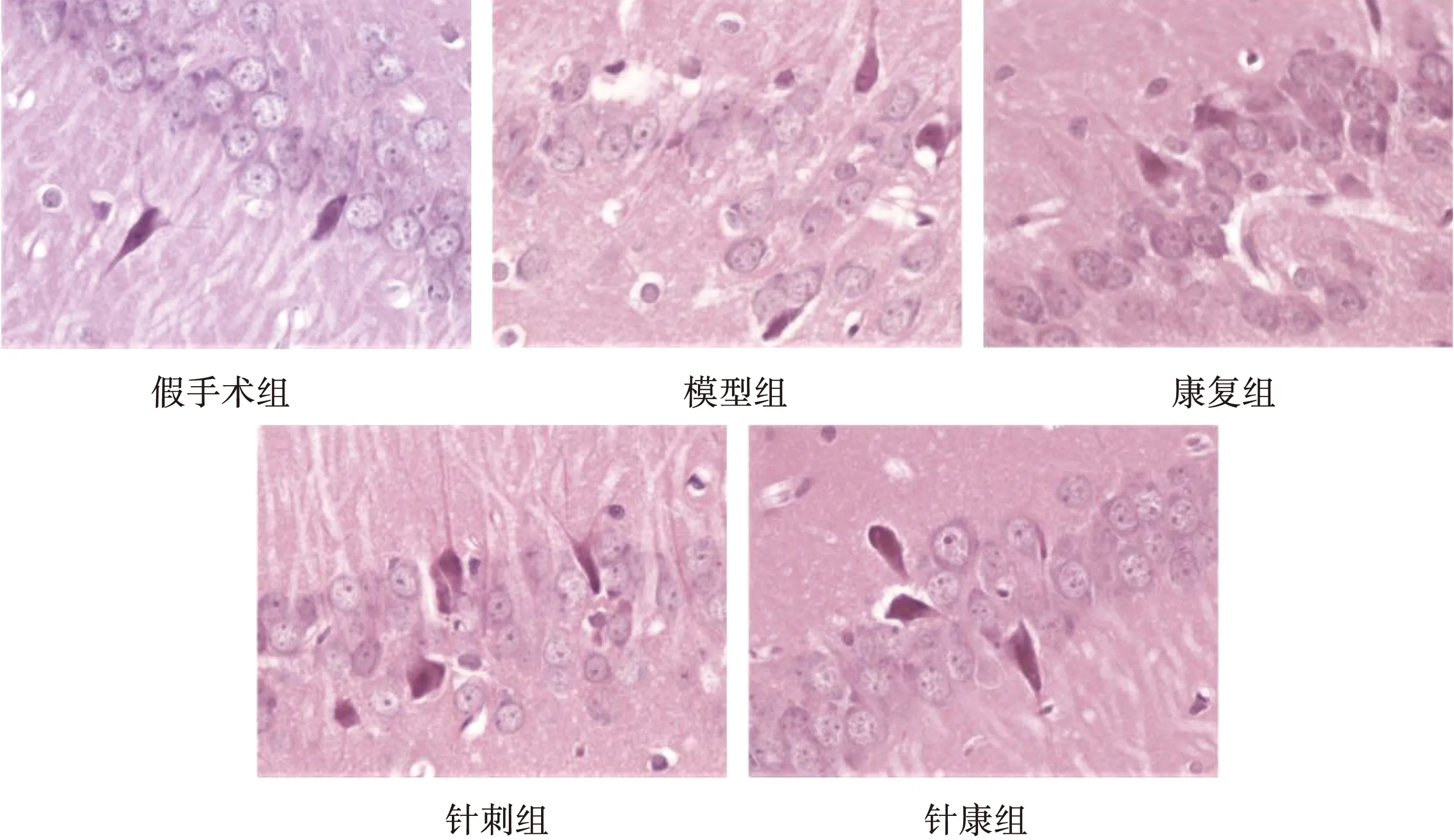
图2 各组大鼠HE染色结果(400×)
2.3 各组大鼠海马区GAP-43蛋白表达结果
相较于假手术组,模型组GAP-43蛋白表达水平下调,差异有统计学意义(P<0.05);相较于模型组,针刺组、康复组和针康组的GAP-43蛋白表达水平均上调,差异有统计学意义(P<0.05);相较于针刺组和康复组,针康组GAP-43蛋白的表达水平显著上调,差异有统计学意义(P<0.05)。见图3、表3。
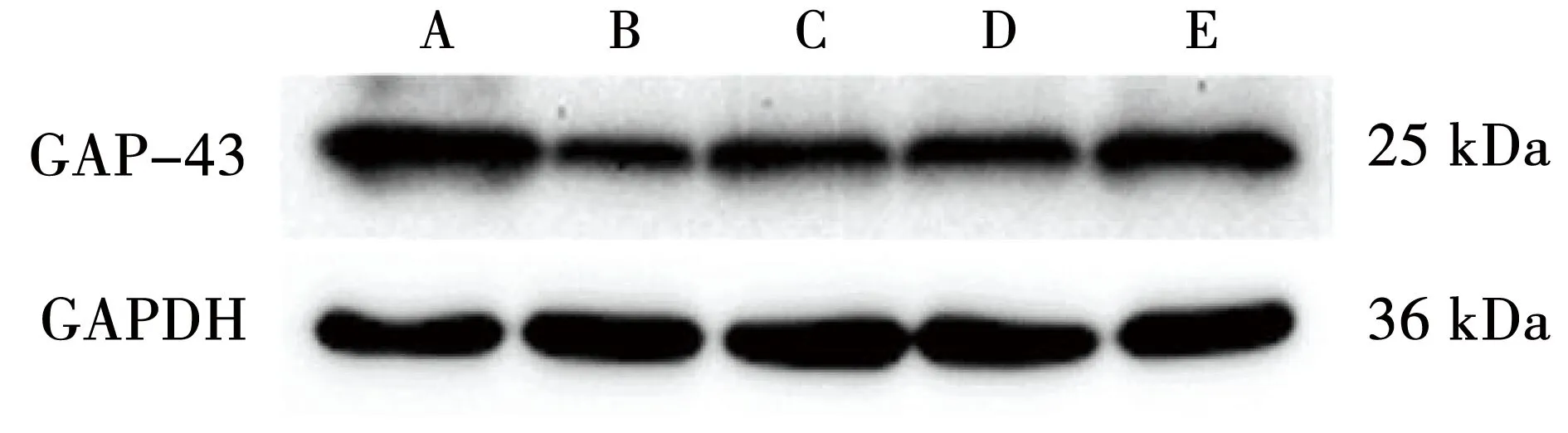
注:A-假手术组;B-模型组;C-康复组;D-针刺组;E-针康组。

表3 GAP-43蛋白表达量变化比较
3 讨论
慢性低灌注是指脑组织出现血流不足或灌注缺陷为特征的持续性病理状态,可引起脑代谢紊乱,表现为白质损伤和认知功能减退。研究表明[10],持续的脑血流供应对维持大脑结构和功能的完整性至关重要,在神经血管层面,持续的脑实质供血对神经元活动、血脑屏障功能和免疫细胞监测等基本功能是必不可少的。有证据表明[11],由血管疾病导致的慢性脑低灌注可能在VCI的病理生理学中起关键作用。CCH导致脑组织缺血和缺氧,从而激活一系列病理反应,包括细胞生物能损伤和离子失衡、神经炎症、氧化应激、兴奋毒性和钙超载等,致使神经元死亡,最终导致学习、智力、思维、推理、语言和执行能力下降[10]。海马区是参与学习能力、空间记忆能力等高度相关的大脑区域,而海马对脑缺血缺氧的状态异常敏感[12],缺血引起海马结构和功能病理性破坏,这是VCI发生的关键。突触活动参与神经细胞信号传递、记忆形成和维持细胞存活,被称为获得性神经保护。海马突触可塑性受损后可引发认知缺陷。GAP-43参与调节海马神经元发育的多个方面,包括诱导轴突发芽、损伤后再生,促进神经突的形成、延伸以及帮助突触的形成、重建[13]。研究表明[14],GAP-43是CCH后海马突触可塑性的重要标记物。
本实验选用2-VO是用于慢性低灌注研究最常用的动物模型[15],造模成功后大鼠可出现低灌注状态,在多项行为测试(如MWM、八臂迷宫测试、T迷宫和新物体识别试验等)中表现为认知记忆受损,且无明显运动功能障碍。这种造模方式常用于探索从CCH到认知下降事件序列中的细胞和分子机制,并用于寻找神经退行性疾病中潜在的神经保护策略。
有研究发现[16],在VCI发展过程中海马萎缩程度为11.6%。海马神经元容量的减少降低了它与其他脑区的连通性,导致突触传递存在缺陷。而海马和新皮质中的突触丧失是公认的血管性痴呆早期事件和认知功能障碍的主要原因。因此,靶向调节海马突触活动和可塑性是改善CCH后认知障碍的新方向。GAP-43是轴突和突触前膜终末的主要成分,作为突触功能障碍或丧失的生物标志物,在神经发育和轴突再生中促进神经元功能恢复。在神经元损伤后,轴突向正确目标生长和形成突触连接十分重要。研究表明[3],GAP-43在老年痴呆症、帕金森病和肌萎缩侧索硬化症等众多疾病中参与调控,帮助保护存活的神经元使其重新建立突触连接。人体大脑发育过程中,随着轴突完成对其靶区的神经支配,GAP-43在大多数脑区下调,但它们在学习和记忆相关的重要区域(如新皮质和海马区等部位)仍保持高表达[17]。因此,GAP-43是一个研究慢性低灌注造成认知功能下降病理机制的重要靶点。
虽然大量证据已经确定了临床前血管疾病与VCI相关的风险因素[1-2],但这些风险因素导致VCI病理,进而产生认知障碍的机制未完全确定,加之阿尔茨海默病和血管性痴呆病理重叠导致的诊断不确定性,治疗此疾病的能力非常有限。除了控制血管风险因素(如高血压和糖尿病)的标准措施外,只有少量胆碱酯酶抑制剂在临床上被证明是有效的[18],但这些药物也只能适度改善认知功能,而不能改善整体预后。在这种情况下,迫切需要发现和完善旨在预防VCI发作、改善其进展或两者兼有的新疗法。
近年来,针刺作为干预方法在认知障碍治疗中的作用越来越明显,对针刺治疗血管性痴呆的机制研究也越来越深入。针刺被广泛用于 VCI的治疗,改善VCI患者记忆功能的机制涉及改善脑局部血液循环,抑制凋亡相关基因表达,调节海马胆碱能系统,调控海马区自噬功能,调节清除自由基能力和抗氧化能力等[19]。朱氏等[20]发现针刺可减少或延迟海马神经元丢失和死亡、改善神经元可塑性和树突结构及改善神经元线粒体病理性损伤。Yao等通过研究[21],认为靳三针治疗通过患者脑血流状态的改善、防止神经细胞凋亡等途径来调节患者的神经电生理,从而降低认知功能的损害。康复训练是临床辅助治疗血管性痴呆的常规手段,包括认知康复训练、日常生活能力、记忆力、言语与运动功能训练等针对患者的综合训练方式。动物实验研究发现[22],康复训练可以增加脑血流量,提高氧利用率,并上调促进突触可塑性和神经元存活相关的分子靶标的基因表达,改善学习记忆能力。丛刺和康复同时同步进行作为本实验的干预方法,双向调节,可达到整体康复的效果。实验结果显示,针康组大鼠逃避潜伏期缩短,穿台次数增加,大鼠学习记忆能力得到提高。HE染色结果显示,针康组大鼠海马细胞间排列较密集齐整,细胞和突触结构较完整,突触细胞数量及神经元的丢失缓解。海马区GAP-43蛋白表达显示,针康组GAP-43蛋白的表达水平显著上调,上调幅度高于针刺组和康复组。
综上,针康法可以有效提高慢性脑低灌注大鼠学习记忆功能,减少海马神经元细胞损伤,提高生长相关蛋白-43表达水平。针康法调节突触可塑性、保护神经、突触结构和功能完整的途径可能为恢复CCH所致学习记忆等能力受损提供新思路。

