电针干预JNK通路调控2型糖尿病大鼠骨骼肌IRS-1磷酸化的机制研究
杨 灿,曹昺焱,张广德
(中国中医科学院西苑医院,北京 100091)
2型糖尿病以慢性血糖升高为主要特征。研究表明,我国20岁以上的人群患有糖尿病的人数占总人口的9.7%[1]。由于2型糖尿病可增加冠状动脉粥样硬化性心脏病的发病风险[2],研究该病的中医治疗具有较大的社会和经济意义。
课题组前期研究中发现,电针可降低2型糖尿病大鼠空腹血糖(Fasting blood glucose,FBG),改善胰岛素抵抗,其机制可能与调控胰岛素受体底物1(Insulin receptor substrate-1,IRS-1)磷酸化水平有关[3]。本研究旨在对电针调控2型糖尿病大鼠骨骼肌IRS-1丝氨酸磷酸化的机制进行深入的研究,从电针下调c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)通路活性、抑制IRS-1丝氨酸磷酸化和促进胰岛素信号通路转导的角度对电针的干预机理进行解释。
1 实验材料
1.1 实验动物
实验动物为18只(2月龄)SPF(Specific Pathogen Free)级ZDF(Zucker Diabetic Fatty)大鼠和8只同月龄的ZL(Zucker Lean)大鼠,体质量(150±10)g。全部动物购自北京维通利华公司[SCXK(京)2016-0006]。动物于23 ℃、相对湿度60%的通风环境中,于12 h昼夜循环光照的条件下饲养。全部动物于1周适应性饲养后开始以Purina #5008饲料喂养6周,诱导造模。饲养期间如无特殊需要,动物自由饮食水。
1.2 仪器和试剂
离心机:Legend micr017r(Thermo公司);针灸针(LOT 212161123,北京中研太和医疗器械有限公司);罗氏ACCU-CHEK 血糖仪(LOT 10129770,罗氏血糖健康医护公司);罗氏血糖试纸(LOT 24685431,罗氏血糖健康医护公司);蛋白磷酸酶抑制剂混合物(LOT 01392/60333,普利莱公司);IRS-1及phospho-IRS-1 ser307抗体(#2381,cell signaling公司);Phospho-SAPK/JNK(thr183/tyr185)Antibody(#4668,Cell Signaling公司)。
2 实验方法
2.1 模型评估
全部动物以Purina #5008饲料喂养6周后,禁食过夜,以罗氏血糖仪和试纸检测空腹血糖。以空腹血糖>11.1 mmol/L为成模标准。全部18只ZDF大鼠均符合成模标准。
2.2 动物分组
8只ZL大鼠作为空白组。18只成模ZDF大鼠按诱导喂养6周后的空腹血糖随机分为模型组和电针组。
2.3 干预方法
2.3.1 空白组及模型组 不干预。
2.3.2 电针组 将动物固定于可伸出四肢的棉布鼠套中静置5 min,待动物适应后,以0.22 mm×13 mm针灸针针刺双侧“后三里” “三阴交” “脾俞” “胃脘下俞”,并连通电针仪(电针阳极连接于“脾俞”,阴极连同侧“三阴交”形成回路,双侧均接通电针)。电针参数:连续波,频率15 Hz,电流输出强度2 mA,留针20 min,每日1次,6次/周(周一至周六),6周。取穴位置和针刺深度:“后三里”取大鼠后肢腓骨小头下方5 mm处,直刺4~6 mm;“三阴交”取大鼠后肢内踝尖直上10 mm处,直刺4 mm;“脾俞”取大鼠第11胸椎棘突下旁开7 mm处,向后正中线斜刺4 mm;“胃脘下俞”取大鼠第8胸椎棘突下旁开7 mm处,向后正中线斜刺4 mm[4-6]。
2.4 指标检测
2.4.1 空腹血糖 于末次干预结束当天,全部动物禁食过夜,次日早8:00以罗氏血糖仪检测空腹血糖。
2.4.2 空腹胰岛素 动物检测空腹血糖后,按45 mg/kg的药量比腹腔注射2%的戊巴比妥钠溶液麻醉,腹主动脉取血致死。大鼠血液于室温环境静置30 min后,于4 ℃条件下以3 000 r/min速度离心15 min分离血清。以放射免疫法检测空腹胰岛素含量,检测过程委托北京华英生物技术研究所完成。1只电针组大鼠于干预过程中死亡,1只空白组大鼠因取材过程中溶血,未能准确检测出空腹胰岛素含量。
2.4.3 胰岛素抵抗指数 HOMA-IR=空腹血糖×空腹胰岛素/22.5。
2.4.4 骨骼肌p-JNK及p-IRS-1 Ser307蛋白表达 动物取血致死后,迅速于冰浴环境下取同部位股四头肌100 mg,加入1 mL混合蛋白磷酸酶抑制剂混合物的裂解液匀浆。将匀浆液于冰上静置30 min(每5 min涡旋振荡1次),在4 ℃环境下以10 000 r/min速度离心15 min,取上清液配平、煮沸变性后,上样(检测p-IRS-1 Ser307时用6%分离胶,检测p-JNK及GAPDH内参时用10%分离胶),以80 V、60 min为条件电泳;以100 V、90 min为条件将蛋白湿转至0.45 μm孔径的PVDF膜上,以加入5%脱脂奶粉的TBST室温封闭90 min后,一抗孵育过夜。次日经洗膜、二抗孵育后,使用Ecl发光液于暗室曝光。
数据处理:以Image-Pro Plus6.0软件计算条带IOD(Integrated option density,总灰度值)作为表达量。以GAPDH和IRS-1为内参,计算p-JNK及p-IRS-1 Ser307的相对表达量。本检测重复3次,以平均值进行统计分析。
2.5 统计学处理
3 结果
3.1 电针对2型糖尿病大鼠空腹血糖的调控作用
经过低频电针干预,模型组与电针组大鼠空腹血糖仍显著高于空白组,差异具有统计学意义(P<0.01);但与模型组比较,电针组大鼠空腹血糖有显著下降,差异具有统计学意义(P<0.05)。提示低频电针“后三里” “三阴交” “脾俞” “胃脘下俞”穴组可显著下调2型糖尿病模型大鼠空腹血糖。见表1。

表1 电针对2型糖尿病大鼠空腹血糖的调控作用
3.2 电针对2型糖尿病大鼠胰岛素抵抗的调控作用
低频电针干预可显著降低2型糖尿病模型大鼠激增的HOMA-IR,差异具有统计学意义(P<0.05),但无法将该指标降低到与空白组动物无差异的程度。模型组与电针组的HOMA-IR仍显著高于空白组,差异具有统计学意义(P<0.01)。见表2。

表2 电针对2型糖尿病大鼠胰岛素抵抗指数的调控作用
3.3 电针对2型糖尿病大鼠骨骼肌p-JNK(thr183/tyr185)蛋白表达的调控
2型糖尿病大鼠骨骼肌p-JNK(thr183/tyr185)含量较空白组显著增高,差异具有统计学意义(P<0.01),JNK通路异常活跃。低频电针干预可显著降低模型动物骨骼肌p-JNK(thr183/tyr185)蛋白表达,差异具有统计学意义(P<0.01),对JNK通路有明显的抑制作用。见表3、图1。

表3 电针对骨骼肌p-JNK(thr183/tyr185)蛋白表达的调控作用
3.4 电针对2型糖尿病大鼠骨骼肌p-IRS-1 Ser307蛋白表达的调控
2型糖尿病大鼠骨骼肌p-IRS-1 Ser307蛋白表达较空白组显著增高,差异具有统计学意义(P<0.05);模型动物骨骼肌IRS-1丝氨酸磷酸化异常活跃。电针可显著下调大鼠骨骼肌p-IRS-1 Ser307蛋白表达,差异具有统计学意义(P<0.05),抑制骨骼肌中异常活跃的IRS-1丝氨酸磷酸化。见表4、图1。

表4 电针对骨骼肌p-IRS-1 Ser307蛋白表达的调控作用
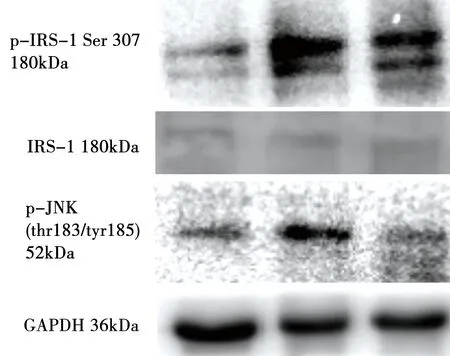
图1 2型糖尿病大鼠骨骼肌JNK通路指标的Western blot检测结果
4 讨论
4.1 从脾论治取穴符合2型糖尿病胰岛素抵抗的特性
2型糖尿病以胰岛素分泌不足和肝、脂肪、骨骼肌等胰岛素靶器官对胰岛素敏感性下降(胰岛素抵抗)为机制。其中,胰岛素抵抗是发病的主要原因[7]。在胰岛素的各类靶细胞中,骨骼肌摄取血循环中约80%的葡萄糖,是胰岛素抵抗的主要发生场所。由于脾主四肢肌肉,中医多从脾论治2型糖尿病。如《灵枢·五味》所言:“谷始入于胃,其精微者,先出于胃之两焦,以溉五藏,别出两行,营卫之道。”水谷精微出于胃,由脾输布,成为营卫二气。营行脉中,卫行脉外,二者共同濡养四肢百骸、筋骨肌肉。脾的功能健全,则精微物质得以敷布全身、肌肉丰满和动作有力。在病理状态下,如《素问·太阴阳明论》篇言:“帝曰:脾病而四支不用,何也?岐伯曰:四支皆禀气于胃,而不得至经,必因于脾,乃得禀也。今脾病不能为胃行其津液,四支不得禀水谷气,气日以衰,脉道不利,筋骨肌肉皆无气以生,故不用焉”。脾失健运,水谷精微生化不足或不能运达濡养四肢,可见四肢乏力、倦怠疲乏等症状。这种病理变化也对应2型糖尿病患者由于骨骼肌胰岛素抵抗,在胰岛素刺激下不能有效地摄取葡萄糖,导致外周血循环中血糖过高,而肌肉却因缺乏葡萄糖摄取而易疲乏无力。故取与脾密切相关的足三里、三阴交、脾俞和胃脘下俞,可以调理脾气,促进其运化功能,改善胰岛素抵抗状态,降低血糖。
笔者通过前期研究发现,以“脾俞” “后三里”等与脾相关的穴位对T2DM模型大鼠进行电针干预,能有效降低空腹血糖[8-9],同时改善总胆固醇、血清甘油三酯和低密度脂蛋白[10]等指标,且显著改善胰岛素抵抗指数和胰岛素敏感指数[11]。近年来有研究者通过回顾既往以针灸疗法治疗2型糖尿病的文献发现,诸多医家均采用了从脾胃论治2型糖尿病的观点:2001年—2011年的79篇与针灸疗法治疗2型糖尿病相关的文献中,单穴使用频次从高到低依次为:三阴交、足三里、脾俞、肾俞和胃脘下俞[11]。这与课题组前期研究结果相契合。
4.2 胰岛素信号通路与骨骼肌胰岛素抵抗
由于葡萄糖不能通过自由扩散的形式进入骨骼肌细胞,骨骼肌对葡萄糖的摄取主要经过胰岛素信号刺激,最终激活葡萄糖转运蛋白4(Glucose transporter 4,GLUT4)实现,使骨骼肌在胰岛素信号的刺激下摄取葡萄糖。因此,电针调控骨骼肌胰岛素抵抗的起效机制应与其对胰岛素信号通路的调控有关。
其通路机制为:经外周血运输来的胰岛素与骨骼肌细胞膜上的胰岛素受体(Insulin Receptor,InR)结合,激活InR,进而催化IRS活性[12]。IRS-1和IRS-2两种亚型在信号传导中起主要作用,骨骼肌以IRS-1为主。IRS-1有多个磷酸化位点。IRS-1酪氨酸磷酸化会为含有SH2结构域的蛋白(其中就包括磷脂酰肌醇3-激酶(Phosphatidylinositol 3-kinase,PI3K))提供特异性对接位点。PI3K可以通过PI3K-Akt 通路激活GLUT4,使其从囊泡移位至细胞膜[13-14],发挥生物活性。即IRS-1的酪氨酸磷酸化会对胰岛素信号通路起促进作用。
IRS-1同时还存在丝氨酸和苏氨酸的磷酸化位点,且IRS-1的酪氨酸磷酸化与丝/苏氨酸磷酸化之间存在竞争关系。因此,IRS-1的胰岛素抵抗常伴随IRS-1 的酪氨酸磷酸化水平降低或丝/苏氨酸磷酸化水平异常增高。研究表明多种T2DM致病因素如糖毒性、脂毒性、氧化应激和炎症反应等都可以通过损害IRS-1酪氨酸磷酸化或促进IRS-1丝/苏氨酸磷酸化竞争性地抑制酪氨酸磷酸化,阻碍胰岛素信号向下游PI3K-Akt-GLUT4通路传递,造成胰岛素抵抗[15]。研究证实T2DM患者存在IRS表达及酪氨酸磷酸化水平降低[16];多种实验表明不同治疗方法都可有效提升骨骼肌中IRS酪氨酸磷酸化水平,从而改善胰岛素抵抗[17-18]。
4.3 JNK影响IRS-1磷酸化的机制
目前研究表明,细胞内JNK通路的活化可以促进IRS-1丝氨酸磷酸化。研究[19]证实:各种上游因子诱导的JNK信号通路活化,能够介导IRS-1丝氨酸位点发生磷酸化,使IRS-1的酪氨酸磷酸化位点活性受到抑制;而p-JNK的缺乏可以有效抑制胰岛素抵抗和胰岛B细胞功能障碍[20]。在进行高糖高脂饲料喂养诱导的肥胖小鼠模型的肝、肌肉和脂肪等胰岛素的靶器官中,JNK的含量和活性均显著提升;而在敲除JNK1基因后,动物的肥胖和胰岛素抵抗状态均可得到显著的改善[21]。这种作用据推测是通过抑制JNK下游的IRS-1丝氨酸磷酸化实现的[22]。在高糖浓度下培养INS-1细胞,其p-JNK及p-IRS-Ser-270丝氨酸磷酸化水平显著增加,加入JNK抑制剂后,JNK磷酸化被抑制,IRS丝氨酸磷酸化水平降低,INS-1细胞活性改善,凋亡减少,表明JNK磷酸化对IRS-1介导的胰岛素信号传导存在负反馈作用,抑制JNK磷酸化可有效保护胰岛细胞,改善胰岛素抵抗[23]。早期的细胞实验发现,胰岛素无法在缺少IRS-1的细胞中刺激JNK,其激活途径可能与PI3K的激活及Ras-MEK1/2-ERK1/2 级联有关,IRS-1仅与激活后的JNK结合,在Ser307磷酸化中起主要作用,从而减少酪氨酸磷酸化,形成胰岛素信号传导反馈抑制[24]。而JNK的激活并不会因为胰岛素抵抗的发展而降低,是因为PI3K/AKT通路受酪氨酸磷酸化降低的影响下调,而MAPK通路不受影响甚至代偿性上调。随后有研究发现,IRS-1残基307的突变能够阻止JNK1磷酸化,但不能阻止小鼠产生胰岛素抵抗,只有多个位点发生突变时才能改善,说明JNK1可能与IRS-1的多个位点相结合共同作用[25]。
5 总结
本研究中,低频电针“后三里” “三阴交” “脾俞” “胃脘下俞”穴组可以降低2型糖尿病模型动物血糖,改善胰岛素抵抗,并可降低骨骼肌p-JNK(thr183/tyr185)和p-IRS-1 ser307水平。因此得出结论:电针可以通过降低骨骼肌JNK通路活性,抑制其介导的IRS-1丝氨酸磷酸化,控制IRS-1丝氨酸磷酸化对酪氨酸磷酸化的竞争性抑制,从而促进胰岛素信号通路转导,上调骨骼肌摄取葡萄糖的能力,改善胰岛素抵抗,降低血糖。

