不同产地桔梗皂苷生物合成与土壤元素关系的研究
孙雨默,程 林*,韩 梅*,杨利民
不同产地桔梗皂苷生物合成与土壤元素关系的研究
孙雨默1, 2,程 林1, 2*,韩 梅1, 2*,杨利民1, 2
1. 吉林农业大学中药材学院,吉林 长春 130118 2. 省部共建生态恢复与生态系统管理国家重点实验室,吉林 长春 130118
研究桔梗皂苷积累与土壤元素的关系,从基因表达水平明确不同产地桔梗皂苷含量差异的原因,为桔梗药材的科学种植提供理论依据。利用HPLC法和香草醛-冰醋酸比色法测定不同产地桔梗韧皮部和木质部的桔梗皂苷D和桔梗总皂苷含量,实时荧光定量PCR测定6种关键酶基因的表达量,利用原子吸收法、比色法等方法测定土壤元素含量,用Pearson相关性分析法分析土壤元素与桔梗皂苷及其关键酶基因表达量的关系。河南洛阳产桔梗根中的桔梗皂苷D和桔梗总皂苷含量显著高于其他产地,桔梗韧皮部和木质部的桔梗皂苷含量和关键酶基因表达量存在较大差异;相关性分析表明,土壤中Cu、Ca和Zn含量对桔梗皂苷的合成起主要作用,甲羟戊酸焦P酸脱羧酶基因、法尼基焦P酸合酶基因和异戊烯基焦P酸异构酶基因是桔梗皂苷合成过程中的主要关键酶基因,土壤元素对桔梗关键酶基因具有一定的调控作用。土壤元素通过调控关键酶基因进而影响桔梗皂苷的合成,其中土壤中Zn含量起主要作用。
桔梗;桔梗皂苷D;桔梗总皂苷;基因表达;土壤元素;甲羟戊酸焦P酸脱羧酶;法尼基焦P酸合酶;异戊烯基焦P酸异构酶
桔梗(Jacq.) A. DC. 为桔梗科多年生草本植物,有宣肺、祛痰、利咽、排脓等功效[1]。主要分布于东北、华北、华东、华中及西南地区,桔梗皂苷D是桔梗中主要质控成分[2]。研究发现,不同产地桔梗皂苷含量差异较大[3-5]。
生态环境是影响中药材质量形成的重要因素,生态环境主要指气候、土壤、地质等生态因子[6-9],其中土壤因子对植物的生长发育有较大影响,植物生长发育所需要的大部分营养均来自于土壤,杨月等[10]研究发现土壤无机元素通过影响三七药材中无机元素含量影响三七药材品质;王升等[11]研究发现黄芩对各元素的吸收能力受产地的影响较大,黄芩对无机元素的吸收与各产地根际土壤无机元素有一定关联性;因此研究土壤元素对桔梗皂苷的合成具有重要意义。
除生态因素外,遗传因素对中药材质量的形成也具有重要作用,目前已有研究发现了桔梗皂苷的合成通路及其合成过程中的关键酶基因[12-14],主要包括:3-羟基-3-甲基戊二酸单酰辅酶A还原酶基因(3-hydroxy-3-methyglutaryl coenzyne-A reductase gene,)[15-16];乙酰辅酶A酰基转移酶基因(acetyl-CoA acetyltransferase gene,)[17];甲羟戊酸焦P酸脱羧酶基因(mevalonate pyrophosphate decarboxylase gene,)[18];异戊烯基焦P酸异构酶基因(isopentenyl diphosphate isomerase gene,)[19-20];法尼基焦P酸合酶基因(farnesyl pyrophosphate synthase gene,)[21];鲨烯合成酶基因(squalene synthase gene,)等[22-23]。虽然已经发现了桔梗皂苷合成过程中的关键酶基因,但是其作用机制尚不明晰,关于生态环境对桔梗皂苷合成过程中关键酶基因的影响也未见报道。
本研究以11个产地桔梗及其土壤为材料,测定了不同产地桔梗韧皮部和木质部的桔梗皂苷D和桔梗总皂苷含量及其6种关键酶基因的相对表达量和土壤元素含量,并对桔梗皂苷含量与关键酶基因表达量和土壤元素进行了Pearson相关性分析,以期找到不同产地桔梗皂苷含量不同的主要影响因素,为桔梗的合理栽培提供理论依据。
1 材料与器材
1.1 材料
桔梗样品为本课题组于2017年和2018年9~10月份采集,共11个不同产地,主要分布于吉林省、河南、河北、山西、内蒙古。所有样品由杨利民教授鉴定为桔梗(Jacq.) A. DC.的根,样地信息见表1。此次采样采用5点采样法,并用环刀采集土壤3份。
1.2 主要试剂
对照品桔梗皂苷D(批号A0217AS)、香草醛(批号A0219AS)购于大连美伦生物技术有限公司,质量分数>98%;多糖多酚植物总RNA提取试剂盒生产自北京庄盟国际生物基因科技有限公司,Bioteke Super RT Kit cDNA合成试剂盒购于北京百泰克生物技术有限公司,TB GreenTMPremin Ex TaqTM荧光染料购于TaKaRa公司等。
1.3 主要仪器
Agilent1260型高效液相色谱仪(美国Agilent公司),AUY220型电子天平(日本岛津公司),电热恒温水浴锅(北京市光明医疗仪器有限公司),Mx3000P型荧光定量PCR仪(美国Aligent公司),NanoDrop 2000型核酸/蛋白定量仪(美国Thermo公司),MDF-382E型超低温冰箱(日本SANYO公司),SIM-F140型制冰机(日本SANYO公司)。

表1 样地信息
2 方法
2.1 桔梗总皂苷含量的测定
2.1.1 供试品溶液的制备 取桔梗粉末2 g(过筛60目),精密称定,精密加入50%甲醇50 mL,称定质量,超声处理(功率250 W、频率40 kHz)30 min,放冷,滤过,再称定质量,用50%甲醇补足减失的质量,摇匀,超声,滤过,定容至25 mL量瓶。
2.1.2 标准曲线的绘制 将香草醛对照品梯度稀释溶液在576 nm波长处比色测定各对照品稀释液吸光度()值。以浓度为横坐标(),值为纵坐标(),绘制标准曲线=4.668−0.040 4,2=0.998 4。
2.1.3 总皂苷的测定 取待测液1 mL于锥形瓶中,放置烘箱内60 ℃挥干,加入5%(香草醛+冰醋酸)显色剂0.2 mL和0.8 mL高氯酸,70 ℃水浴加热15 min,快速拿出,冰浴3 min,室温放置5 min,加5 mL冰醋酸,使用紫外分光光度计576 nm处测得值,最后带入标准曲线,计算桔梗总皂苷含量。
2.2 桔梗皂苷D含量测定
2.2.1 对照品溶液的制备 取桔梗皂苷D对照品适量,精密称定,加甲醇制成0.5 mg/mL的溶液,即得。
2.2.2 供试品溶液的制备 同“2.1.1”项。
2.2.3 色谱条件 色谱柱:C18分析柱(250 mm×4.6 mm);流动相为乙腈(B)-P酸(A),梯度洗脱(0~20 min,4% A;20~35 min,15%~23% A;35~55 min,23%~28% A;55~65 min,28%~40% A;65~80 min,40%~90% A);体积流量1.0 mL/min;柱温30 ℃;检测波长210 nm;进样量20 μL。
柴油机经过8h的磨合,Rz减少了,理论上其闭口间隙扩大了0.03mm,实际上对第一道环的闭口间隙进行检测,其间隙都在0.4mm以上,达到了(1)式计算所得的最小间隙标准。随着柴油机磨合的继续,平均磨损率会进一步降低,达到稳定期后,闭口间隙最后趋于稳定[6]。
2.2.4 标准曲线的建立 取桔梗皂苷D对照品溶液,依次稀释得到初始浓度分别为1/32、1/16、1/8、1/4、1/2、1/1的混合对照品溶液。按照上述色谱条件,依次进样20 µL,以峰面积为纵坐标(),溶液质量浓度为横坐标(),绘制标准曲线,结果线性关系良好,回归方程为=3.138 5−24.518,2=0.999 6。
2.2.5 方法学考察 精密度、稳定性、重复性及加样回收率试验考察符合要求,RSD均小于3%。
2.2.6 桔梗皂苷D含量测定 取“2.1.1”制备的供试样品,过0.45 µL微孔滤膜,按照上述色谱条件进样20 µL,将峰面积带入标曲,求得桔梗皂苷D含量。
2.3 土壤元素测定
土壤速效氮采用碱解扩散法,土壤速效P采用钼锑抗比色法,土壤金属元素如速效K、Fe、Cu、Zn、Mn、Ca和Me采用原子吸收法。具体操作参考《土壤农化分析》[24]。
2.4 关键酶基因表达量检测
2.4.1 桔梗根部总RNA的提取和cDNA的合成 取保存在−80 ℃冰箱中的不同产地桔梗韧皮部和木质部的鲜样50~100 mg置于干净的研钵中加入液氮充分研磨20~25 min,磨成细粉为止,之后的步骤参照多糖多酚植物总RNA提取试剂盒用核酸蛋白检测仪测定RNA浓度和纯度。之后,使用Bioteke Super RT Kit cDNA合成试剂盒将总RNA反转录合成cDNA,放入−20 ℃冰箱中保存备用。以上所有步骤均在冰上操作。
2.4.2 桔梗皂苷合成中关键酶基因表达量的测定 采用实时荧光定量PCR法,通过查阅文献,确定以为内参基因,选择了桔梗皂苷合成过程中的6种关键酶基因(、、、、)为目的基因,6种关键酶基因和内参基因的引物序列见表2,并以吉林松原产地的韧皮部基因表达量为对照,测定不同产地桔梗韧皮部和木质部关键酶基因表达量。反应体系:TB GreenTMPremin Ex TaqTM荧光染料10 μL,ddH2O 7 μL,引物各1 μL,cDNA 1 μL,共20 μL,每个反应重复3次。反应程序:94 ℃预变性30 s;45个循环(94 ℃变性5 s,55 ℃退火30 s,72 ℃延伸20 s)。

表2 基因引物序列
3 结果与分析
3.1 不同产地桔梗皂苷含量分析
分别利用香草醛-冰醋酸比色法和HPLC法测定了不同产地桔梗韧皮部和木质部的桔梗总皂苷和桔梗皂苷D含量,结果见图1,不同产地桔梗中桔梗皂苷含量差异较大,图1-A为不同产地桔梗总皂苷含量11批桔梗样品中,以河南洛阳(J3)、山西晋城(J4)和内蒙古赤峰(J6~J11)样地的桔梗总皂苷含量较高,质量分数在6%~9%,吉林长春(J1)和河北承德(J2)样地的桔梗总皂苷含量较低,分别为4.3%、3.2%;图1-B为不同产地桔梗韧皮部和木质部桔梗总皂苷含量,韧皮部的总皂苷含量显著高于木质部,韧皮部与木质部的质量比约为6∶1,所以桔梗根部的总皂苷主要来自于韧皮部;图1-C为不同产地桔梗皂苷D含量,《中国药典》2020年版规定桔梗皂苷D的含量为不小于0.1%,由图可知,除了河北承德(J2)样地的桔梗皂苷D质量分数为0.095%,未达到药典标准,其余产地桔梗皂苷D含量显著高于药典标准,以河南洛阳(J3)样地的桔梗皂苷D质量分数最高为0.153%,是《中国药典》规定的1.5倍;图1-D为桔梗韧皮部和木质部中桔梗皂苷D的含量,桔梗韧皮部的桔梗皂苷D质量分数均显著高于木质部,韧皮部的桔梗皂苷D质量分数是木质部的2.66~2.98倍,所以桔梗根部的桔梗皂苷D也主要来自于韧皮部。

不同字母表示经Duncan氏法检验差异显著(P<0.05),下同
3.2 不同产地桔梗土壤元素含量分析

图2 不同产地桔梗土壤元素含量()
3.3 不同产地桔梗土壤因子与桔梗皂苷相关性分析
采用SPSS19.0对不同产地桔梗土壤元素含量与桔梗皂苷含量进行Pearson相关性分析,由表3可知,桔梗木质部桔梗总皂苷含量与土壤Cu含量呈显著正相关(<0.05),说明桔梗木质部的桔梗总皂苷含量主要受土壤Cu含量的的影响较大;桔梗韧皮部的桔梗总皂苷含量与土壤Ca呈显著正相关(<0.05),桔梗根部桔梗总皂苷含量也与土壤Ca呈显著正相关(<0.05),可能因为桔梗根部的桔梗总皂苷主要来自于桔梗的韧皮部,且桔梗总皂苷的积累与土壤Ca密切相关;桔梗根部桔梗皂苷D含量与土壤Zn含量呈显著正相关(<0.05),说明桔梗根部桔梗皂苷D含量受土壤Zn含量影响较大。
3.4 桔梗皂苷合成过程中关键酶基因表达量
桔梗皂苷D是评价桔梗质量的关键因素,根据“3.1”项的研究,按照桔梗皂苷D含量高低将产地进行排序为河南洛阳>山西晋城>内蒙赤峰红山区>内蒙赤峰宁城>吉林长春>吉林松原>内蒙赤峰喀喇沁旗>内蒙赤峰巴林右旗>内蒙赤峰汐子镇>内蒙赤峰天义镇>河北承德,其中河北承德(J2)样地的桔梗皂苷D含量未达到药典标准。韧皮部的皂苷含量显著高于木质部,说明韧皮部是桔梗皂苷D储存的重要位置。桔梗韧皮部和木质部的关键酶基因表达量结果见图3,以基因为内参基因,吉林松原(J5)样地的桔梗皂苷含量相对于其他样地处于中等水平,因此以吉林松原(J5)样地桔梗的韧皮部的关键酶基因表达量为对照。从图3(A-F)中发现,不同产地的韧皮部和木质部的关键酶表达量表达模式不同,基因在木质部中的表达量均高于韧皮部,大部分样地的、、和基因在韧皮部的表达量高于木质部,然而未达到药典标准的河北承德(J2)样地,有5个基因(、、、、)在木质部的表达量高于韧皮部,可能是这些基因在其韧皮部的表达量较低,导致河北承德(J2)样地韧皮部桔梗皂苷D积累不足,未达到药典标准。同时,河北承德(J2)样地的基因在桔梗韧皮部的表达量显著高于木质部,而其他样地的桔梗韧皮部和木质部的表达量大致相同,这种不正常的表达,可能对皂苷的积累产生了抑制作用。

表3 土壤元素与桔梗皂苷含量的相关性分析
*相关性显著(<0.05);**相关性极显著(<0.01),下同
*Correlation is significant (< 0.05);**correlation is very significant (< 0.01), same as below

图3 桔梗皂苷合成的关键酶基因表达量()
3.5 桔梗皂苷含量与关键酶基因表达量的相关性分析
采用SPSS19.0对不同产地桔梗皂苷含量与关键酶基因表达量进行Pearson相关性分析见表4,木质部的桔梗总皂苷含量与、和基因呈显著负相关(<0.05),说明这3个基因在木质部中的过度表达对桔梗皂苷的合成产生了抑制作用,桔梗根部桔梗皂苷D含量与和基因呈显著正相关(<0.05),与基因呈极显著正相关(<0.01),说明、和基因的表达对桔梗根部桔梗皂苷D的合成起主要调控作用。
3.6 土壤因子与关键酶基因表达量的相关性分析
采用SPSS19.0对不同产地桔梗土壤元素与关键酶基因表达量进行Pearson相关性分析见表5,土壤碱解氮、速效P和速效Fe含量与基因的表达量呈极显著正相关(<0.01),土壤速效Mn含量与基因成显著正相关(<0.05)土壤说明土壤碱解氮、速效P、速效Fe和速效Mn含量对基因的表达有促进作用;土壤速效Zn和速效Mn含量与基因呈显著负相关(<0.05),说明土壤速效Zn和速效Mn含量对基因的表达有促进作用;其他土壤元素对关键酶基因表达量有一定的影响,但是相关性不显著,可能是生态因子相互作用,共同影响关键酶基因的表达量,需要进一步的研究。

表4 桔梗皂苷含量与关键酶基因的相关性
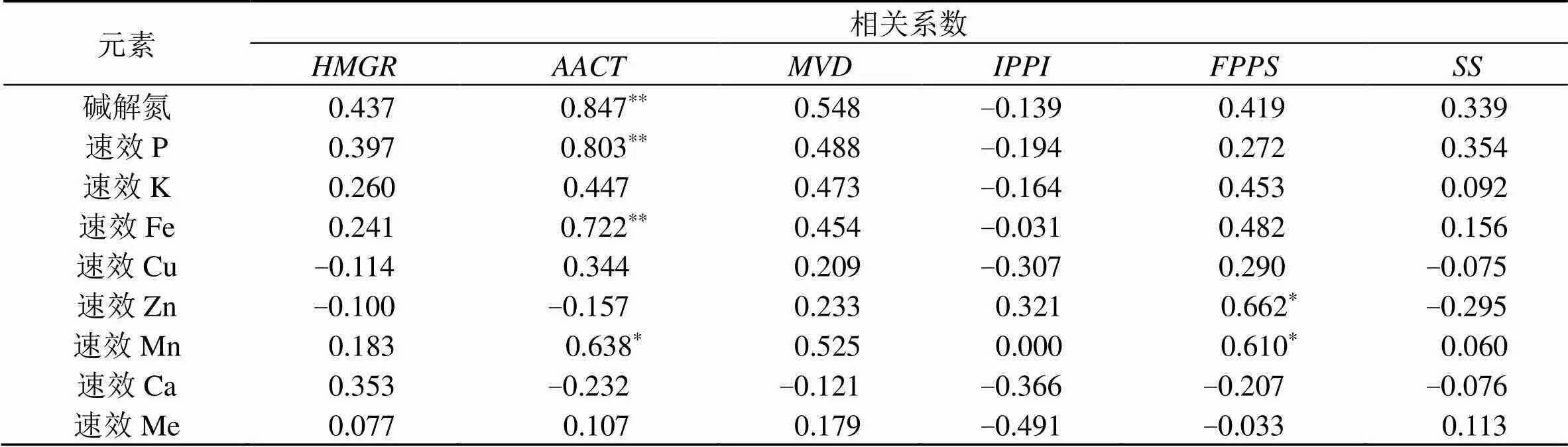
表5 土壤元素与关键酶基因的相关性
4 讨论
药用植物不同部位有效成分含量存在一定的差异,李小莹等[25]研究发现,鸡血藤木质部的黄酮类药效成分成分高于韧皮部;本研究发现,不同产地桔梗韧皮部的桔梗总皂苷和桔梗皂苷D含量均高于木质部;不同产地桔梗根中桔梗总皂苷和桔梗皂苷D含量存在较大差异,其中河南洛阳(J3)样地桔梗总皂苷和桔梗皂苷D含量最高,河北承德(J2)样地桔梗皂苷D含量最低,未达到药典标准,不同产地桔梗皂苷含量差异可能与土壤、温度、光照、降雨量等生态因子密切相关。
本实验分析了土壤元素对桔梗皂苷及其合成过程中的关键酶基因表达量的影响。植物生长发育需要大量的营养元素,这些元素大部分来自于土壤,土壤元素能够影响植物体内元素含量,进而影响植物次生代谢产物,Zhu等[26]研究发现当施P量高于20 kg/(P·ha)桔梗皂苷含量开始降低;刘岩等[27]研究发现,土壤中的无机元素含量影响黄芩对无机元素的吸收,土壤中的大量元素K,微量元素Fe和Mg能够促进黄芩中黄芩苷的合成,任平等[28]研究发现土壤元素微量元素Cu、Fe对景天三七活性成分含量影响较大。本研究发现,不同产地桔梗土壤元素含量差异较大,桔梗皂苷D含量最高的河南洛阳(J3)样地的土壤有效微量元素Fe、Cu、Zn和Mn含量处于极高水平,相关性分析发现,土壤中Cu和Ca含量能够分别促进桔梗木质部和韧皮部桔梗总皂苷的合成,土壤中Zn和Ca含量分别促进了桔梗根部桔梗皂苷D和桔梗总皂苷的合成,所以土壤元素中Cu、Zn和Ca的含量是造成不同产地桔梗皂苷含量不同的主要土壤因子。
中药材中的次生代谢产物与其合成过程中的关键酶基因密切相关,赵钰等[29]研究发现,、β-、-和-这4个基因柴胡皂苷含量有重要关联;本研究发现桔梗韧皮部的桔梗皂苷D和桔梗总皂苷含量均高于木质部,和基因在韧皮部的表达量明显高于木质部,这2个基因可能是导致桔梗皂苷在韧皮部和木质部差异较大的关键基因,、和基因在桔梗木质部的过量表达抑制了木质部的桔梗总皂苷皂苷的合成,、和与桔梗根部的桔梗皂苷D含量呈显著正相关(<0.05),在桔梗皂苷D的合成过程中起主要调控作用。
生态因子能够调控关键酶基因表达量进而影响皂苷含量[30],杨林林等[31]研究发现,生态因子与关键酶基因的表达共同调控了人参皂苷的合成,对人参皂苷的积累有重要影响;韦赫等[32]研究发现水分能够通过调控、、和基因影响黄芪皂苷含量;关于土壤中元素对药用植物关键酶基因表达量影响的研究较少,本研究发现桔梗皂苷的形成主要受土壤Cu、Zn和Ca影响最大,土壤中Zn含量与基因表达量呈显著正相关(<0.05),而基因是桔梗皂苷合成过程中起主要调控作用的关键酶基因之一,表明土壤Zn主要通过调控基因进而影响桔梗皂苷的合成。
利益冲突 所有作者均声明不存在利益冲突
[1] 中国科学院中国植物志编辑委员会. 中国植物志-第四十二卷, 第一分册 [M]. 北京: 科学出版社, 1993: 23.
[2] 中国药典[S]. 一部: 2020: 289.
[3] 李喜凤, 杜云锋, 谢新年, 等. 不同产地桔梗药材HPLC指纹图谱及桔梗皂苷D含量测定研究 [J]. 中成药, 2010, 32(4): 529-532.
[4] 曾静凯, 郭青. 不同产地桔梗性状、浸出物、桔梗皂苷D含量及HPLC指纹图谱比较 [J]. 中国实验方剂学杂志, 2017, 23(24): 62-70.
[5] 谭玲玲, 侯晓敏, 胡正海. 不同产地桔梗药材中桔梗总皂苷和桔梗皂苷D的测定 [J]. 中草药, 2015, 46(11): 1682-1684.
[6] 杨利民, 张永刚, 林红梅, 等. 中药材质量形成理论与控制技术研究进展 [J]. 吉林农业大学学报, 2012, 34(2): 119-124, 129.
[7] 林红梅. 生态因子对人参皂苷含量及其生物合成关键酶基因表达的影响 [D]. 长春: 吉林农业大学, 2016.
[8] 焦晓林, 高微微. 环境因子对药用植物三萜皂苷合成影响的研究进展 [J]. 中草药, 2011, 42(2): 398-402.
[9] 杨林林. 不同生长时期人参皂苷合成及其关键酶基因表达对生态因子的响应 [D]. 长春: 吉林农业大学, 2017.
[10] 杨月, 陈艳姣, 张爱琛, 等. 土壤无机元素含量与三七药材品质的关系 [J]. 中国实验方剂学杂志, 2018, 24(13): 47-53.
[11] 王升, 赵曼茜, 郭兰萍, 等. 不同产地黄芩中无机元素含量及其与根际土壤无机元素的关系 [J]. 生态学报, 2014, 34(16): 4734-4745.
[12] Ma C H, Gao Z J, Zhang J J,. Candidate genes involved in the biosynthesis of triterpenoid saponins ingrandiflorum identified by transcriptome analysis [J]., 2016, 7: 673.
[13] 许晓双, 张福生, 秦雪梅. 三萜皂苷生物合成途径及关键酶的研究进展 [J]. 世界科学技术—中医药现代化, 2014, 16(11): 2440-2448.
[14] 杨鹤, 宋述尧, 许永华, 等. 人参三萜皂苷的研究进展及其生态学作用 [J]. 中草药, 2017, 48(8): 1692-1698.
[15] 张萍, 刘迪秋, 葛锋, 等. 三七3-羟基-3-甲基戊二酸单酰辅酶A还原酶基因的克隆和生物信息学分析 [J]. 中草药, 2014, 45(18): 2684-2690.
[16] Liu W J, Lv H Z, He L,. Cloning and bioinformatic analysis of HMGS and HMGR genes from[J]., 2016, 8(4): 344-351.
[17] 朱畇昊, 苏秀红, 董诚明, 等. 冬凌草AACT基因的克隆与表达分析 [J]. 中药材, 2016, 39(1): 37-41.
[18] 陈笛, 王鹏杰, 郑玉成, 等. 茉莉花MVD基因及其启动子的克隆与表达 [J]. 福建农林大学学报: 自然科学版, 2019, 48(3): 309-315.
[19] Tong Y R, Zhang M, Su P,. Cloning and functional characterization of an isopentenyl diphosphate isomerase gene from[J]., 2016, 63(6): 863-869.
[20] Berthelot K, Estevez Y, Deffieux A,. Isopentenyl diphosphate isomerase: A checkpoint to isoprenoid biosynthesis [J]., 2012, 94(8): 1621-1634.
[21] 张瑶瑶, 宋丽, 刘伟, 等. 香樟FPPS基因的克隆及生物信息学分析 [J]. 分子植物育种, 2018, 16(19): 6276-6281.
[22] 吴沂芸, 罗静, 王黎, 等. 橘核角鲨烯合成酶基因(ss)的克隆、分析及表达 [J]. 中药材, 2016, 39(2): 270-274.
[23] Su H L, Liu Y M, Xiao Y L,. Molecular and biochemical characterization of squalene synthase from[J]., 2017, 39(7): 1009-1018.
[24] 鲍士旦. 土壤农化分析 [M]. 3版. 北京: 中国农业出版社, 2000: 263.
[25] 李小莹, 林裕英, 陈丰连. 鸡血藤木质部、韧皮部黄酮类成分比较及药效成分分布规律研究 [J]. 中药材, 2017, 40(5): 1137-1140.
[26] Zhu L X, Liu D. Effects of different phosphorus applications on growth and platycodin content of Balloon Flower (grandiflorum) [J]., 2014, 178: 8-13.
[27] 刘岩, 李连泰, 计小清, 等. 土壤中无机元素对不同产地黄芩中无机元素和黄芩苷量的影响 [J]. 中草药, 2017, 48(6): 1225-1228.
[28] 任平, 付博, 刘晨, 等. 景天三七主要活性成分与土壤、气象因子的相关性 [J]. 生态环境学报, 2019, 28(5): 908-917.
[29] 赵钰, 杨林林, 韩梅, 等. 北柴胡不同部位柴胡皂苷含量与其关键酶基因表达量的相关性研究 [J]. 中草药, 2019, 50(10): 2433-2441.
[30] Cheng L, Han M, Yang L M,. Changes in the physiological characteristics and baicalin biosynthesis metabolism ofGeorgi under drought stress [J]., 2018, 122: 473-482.
[31] 杨林林, 张涛, 杨利民, 等. 生态因子对人参皂苷合成及其关键酶基因表达的影响 [J]. 中草药, 2017, 48(20): 4296-4305.
[32] 韦赫, 程林, 吴培, 等. 黄芪皂苷生物合成对短期水分变化的响应 [J]. 中国中药杂志, 2019, 44(3): 441-447.
Effects of soil elements on platycodin biosynthesis process infrom different habitats
SUN Yu-mo1, 2, CHENG Lin1, 2, HAN Mei1, 2, YANG Li-min1, 2
1. College of Chinese materials, Jilin Agricultural University, Changchun 130118, China 2. State Key Laboratory of Ecological Recovery and Ecosystem Management, Changchun 130118, China
To explore the relationship between platycodin accumulation and soil elements, to identify the reasons for the the content difference ofbetween different origins from the gene expression level, and to provide a theoretical basis for the scientific cultivation of.The content of platycodin D and total platycodin in phloem and xylem from different habitats were determined by HPLC and vanilla aldehyde-glacial acetic acid colorimetric, the expression of key enzyme genes were determined by real-time quantitative PCR,thecontent of soil elements were determined byAtomic Absorption Method. And the relationship between soil elements and the expression levels of platycodin and its key enzyme genes was analyzed by Pearson correlation analysis.The content of platycodin D and total platycodin from Luoyang, Henan, was significantly higher than those of other habitats; Platycodin content and expression of key enzyme genes in phloem and xylem ofwere quite different; Contents of Cu, Ca and Zn in soil play a major role in the synthesis of platycodin, mevalonate pyrophosphate decarboxylase gene (), farnesyl pyrophosphate synthase gene () and isopentenyl diphosphate isomerase gene () genes were the main key enzyme genes in the synthesis of platycodin; Soil elements had a certain regulatory effect on the expression of key enzyme genes.Soil elements affect the synthesis of platycodin by regulating key enzyme genes, with Zn content in the soil playing a major role.
(Jacq.) A.DC.; platycodin D; total platycodin; gene expression; soil elements; mevalonate pyrophosphate decarboxylase; farnesyl pyrophosphate synthase; isopentenyl diphosphate isomerase
R286.2
A
0253 - 2670(2022)15 - 4844 - 09
10.7501/j.issn.0253-2670.2022.15.028
2021-12-06
国家中药材产业技术体系项目(CARS-21)
孙雨默(1994—),女,硕士研究生,研究方向为生态学。E-mail: 454091276@qq.com
通信作者:程 林(1988—),男,博士,研究方向为药用植物次生代谢生态调控研究。E-mail: idream9999@126.com
韩 梅(1964—),女,教授,博士生导师,研究方向为资源植物生态与质量调控研究。E-mail: hanmei77@sohu.com
[责任编辑 时圣明]