白木香转录因子AsNAC2的克隆及表达分析
张玉秀,刘培卫*,吕菲菲,杨 云,徐艳红,高志晖,魏建和, *
• 药材与资源•
白木香转录因子AsNAC2的克隆及表达分析
张玉秀1,刘培卫1*,吕菲菲1,杨 云1,徐艳红2,高志晖2,魏建和1, 2*
1. 中国医学科学院 北京协和医学院药用植物研究所海南分所海南省南药资源保护与开发重点实验室 国家中医药管理局沉香可持续利用重点研究室,海南 海口 570311 2. 中国医学科学院 北京协和医学院药用植物研究所 中草药物质基础与资源利用教育部重点实验室 濒危药材繁育国家工程实验室,北京 100193
对珍稀南药沉香基原植物白木香AsNAC2转录因子进行分子克隆,并对其进行生物信息学和表达模式分析。以白木香茎的总RNA反转录的cDNA为模板,采用PCR技术获取基因编码序列(coding sequence,CDS)全长;利用生物信息学软件预测蛋白的理化性质、结构域和亚细胞定位等特性;运用DNAMAN8.0和MEGA6.0等软件分别进行多序列比对和进化关系分析;利用qRT-PCR技术检测基因在不同组织和伤害胁迫下的表达特性。克隆获得基因(GenBank注册号MT130201),开放阅读框(open reading frame,ORF)全长864 bp,编码1条由287个氨基酸组成的弱酸性的稳定的亲水性蛋白,该蛋白定位在细胞核中,不存在跨膜结构域。序列比对和系统进化树分析显示,AsNAC2蛋白N端具有典型的NAM结构域,与锦葵目中的可可、哥伦比亚锦葵和榴莲NAC 2-like蛋白亲缘关系近,属于NAC转录因子家族中的ATAF亚组。qRT-PCR结果显示,基因主要在健康白木香的根和茎中表达,全断干伤害可显著诱导茎中基因表达量的上调,在2 h达到峰值,此后缓慢下降,至48 h基本恢复正常。首次在白木香中克隆和鉴定了基因,该基因易受伤害诱导表达,且在伤害早期相对应。
白木香;转录因子;NAC;克隆;表达分析
沉香为珍稀南药,具有行气止痛、温中止呕、纳气平喘等功效[1],同时也是名贵的天然香料,是高级香水中不可或缺的定香剂[2]。白木香(Lour.) Gilg为瑞香科沉香属植物,是国产药用沉香法定的唯一来源物种[1]。健康的白木香不能形成沉香,只有在伤害胁迫下才能够在伤口周围产生倍半萜和色酮等沉香类物质[3-5]。为了获得沉香,沉香属植物受到了无节制滥砍滥伐,加之生态环境破坏日益加剧,造成沉香属野生植物资源已濒临灭绝,包括白木香在内的所有沉香属及拟沉香属均被列入了《濒危野生动植物种国际贸易公约》附录II[6]。全面解析沉香形成机制,不断创新高效的结香技术成为解决沉香资源问题的关键[4, 7]。项目组早期揭示出“伤害诱导白木香防御反应形成沉香”机制,解析了伤害→内源伤害信号分子→转录因子→倍半萜合酶基因→倍半萜分子通路[7-11]。但该网络中仍有很多关键调控步骤有待进一步研究阐明。
课题组前期在研究“伤害诱导白木香防御反应形成沉香”的分子机制过程中,发现转录因子在沉香倍半萜物质的形成过程中起着重要的调控作用,如AsMYC2转录因子作为正调控子[11],而AsWRKY44转录因子作为负调控子[7],在茉莉酸信号途径中通过调控倍半萜合酶基因的表达参与沉香倍半萜物质的形成过程。NAC转录因子是植物特有、数量众多的转录因子家族之一[12-13]。已有研究表明,NAC转录因子参与植物生长发育和器官形态建成等许多方面[14]。此外,越来越多的研究证明,在植物的信号传导以及非生物损伤和胁迫应答过程中,NAC转录因子也起着激活或抑制应答的功能[12-13, 15]。方泽蘅等[16]的转录组数据表明NAC转录因子在白木香应答盐胁迫起到重要的调控作用。但白木香中NAC转录因子的克隆和功能的研究还未见报道。本实验依据前期的白木香转录组数据(未发表数据),首次对白木香中一个NAC转录因子进行克隆和鉴定,并对它进行组织表达特性和伤害处理下的表达特性分析,旨在为深入研究该基因在伤害诱导白木香结香过程中的生物学功能奠定基础。
1 材料
样品采自中国医学科学院药用植物研究所海南分所海口研发中心苗圃,经中国医学科学院药用植物研究所杨云副研究员鉴定为4年生健康白木香(Lour.) Gilg。2019年6月15日分别采集白木香的根、茎、叶、果肉和近成熟的种子并迅速置入液氮中,放入−80 ℃冰箱保存备用。
2 方法
2.1 RNA的提取及cDNA的合成
取0.1 g植物材料在液氮中研磨成粉末,采用EASYspin Plus植物RNA提取试剂盒(AidLab RN38,中国)提取总RNA,1%琼脂糖凝胶电泳确定RNA的完整性,分光光度计NanoDrop(Thermo Scientific,美国)测定RNA浓度和纯度。采用TransScript One-Step gDNA Removal and cDNA Synthesis Supermix试剂盒(TransGen AT311,中国)合成cDNA。
2.2 AsNAC2的克隆
根据转录组数据中CDS的全长序列(未发表数据),运用Primer Premier 5.0软件设计引物,上游为5’-ATGAAGGGAGGTGGAGCAG- AG-3’,下游为5’-TCAATATGGCTTCTGAAGG- TA-3’。以白木香的cDNA为模板,利用高保真性的TaKaRa LA酶进行PCR扩增。PCR体系:LA Tap 0.5 μL,LA Buffer 5 μL,dNTP 8 μL,上、下游引物各 1 μL,cDNA 1 μL,ddH2O 33.5 μL。PCR扩增程序:94 ℃、4 min;98 ℃、10 s,52 ℃、15 s,72 ℃、1 min,30个循环;最后72 ℃、10 min。扩增产物用1%琼脂糖凝胶电泳后,回收目的片段,连接到pSmart-HCKan-T载体上,连接产物转入大肠杆菌DH5α感受态细胞,蓝白斑筛选,挑取阳性克隆送广州艾基生物技术有限公司测序。
2.3 生物信息学分析
使用一系列生物信息学软件对基因的核酸序列及编码蛋白序列进行生物信息学分析。利用NCBI在线工具Conserved Domains对其结构域进行预测;在NCBI Reference proteins数据库中BLAST获得同源的NAC蛋白序列,运用DNAMAN8.0软件对AsNAC2及获得的氨基酸序列进行多重序列比对,利用MEGA 6.0软件构建NJ系统树(Bootstrap参数为1000)。蛋白的理化性质、亚细胞定位和跨膜结构预测分别采用ExPASy-ProtParatool(http://web.expasy.org/protparam),WoLFPSORT(https://wolfpsort.hgc.jp)和TMHMM(http:// www.cbs.dtu.dk/services/TMHMM)等在线工具完成。
2.4 白木香AsNAC2基因的表达分析
2.4.1 组织表达分析 选取白木香作为内参基因[17],根据上面获得的NAC基因的CDS序列设计荧光定量PCR引物(表1)。用罗氏实时荧光定量PCR仪(LightCycler96,瑞士)进行qRT-PCR。反应体系20 μL包括2XTop Green qPCR Supermix(TransGen AQ131,中国)10 μL,正反向引物各0.5 μL,cDNA模板1 μL,ddH2O 8 μL。每个组织重复3次。PCR程序为95 ℃、600 s;95 ℃、10 s,55 ℃、15 s,72 ℃、20 min,40个循环。利用2−△△Ct方法计算相对表达量。

表1 qRT-PCR所用的引物序列
2.4.2 伤害胁迫表达分析 将4年生的白木香茎直接锯断,处理1、2、6、12、24、48 h后,将距离伤口1 cm的茎段,迅速锯下,立即放入液氮中保存、标记,然后放入−80 ℃冰箱保存备用。参照组织表达分析进行qRT-PCR。
3 结果与分析
3.1 白木香AsNAC2基因的克隆及鉴定
以白木香RNA反转录成的cDNA为模板,PCR扩增得到了1条略小于1000 bp的条带(图1)。通过纯化、克隆和测序等技术,获得1条为864 bp开放阅读框,编码287个氨基酸(图2)。NCBI的Conserved Domains在线软件分析表明该蛋白N-端具有一个典型的NAM保守结构域,分布在11~134位氨基酸之间(图2)。
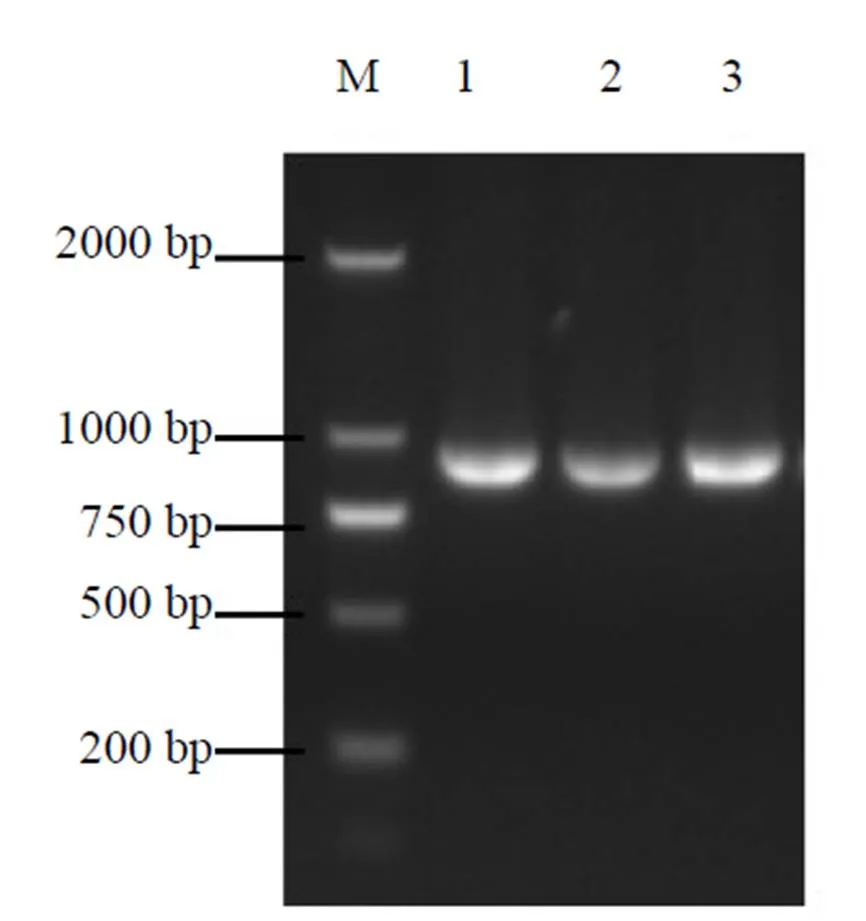
M-Marker 1~3-扩增产物
在NCBI Reference proteins数据库中BLAST搜索与AsNAC2同源的功能相对明确的NAC蛋白序列,用DNAMAN8.0将AsNAC2与获得的甜橙CsNAC2(NP_001275792.1)、大豆GmNAC2(NP_ 001341065.1)、棉花GhNAC2(NP_001314659.1)、麻疯树JcNAC2(NP_001295644.1)、甜瓜CmNAC2(NP_001284423.1)、拟南芥ANAC002(NP_171677.1)和ANAC102(NP_201184.2)的氨基酸序列进行多重比对。结果显示AsNAC2与其他植物NAC转录因子一样,-端氨基酸序列高度保守,并可进一步划分为A~E 5个保守的亚结构域(图2)。
3.2 AsNAC2蛋白的生物信息学分析
利用MEGA6.0软件的NJ方法构建AsNAC2蛋白与其他种植物的同源性高的NAC转录因子的系统进化树(图3)。植物的NAC转录因子可以分成2个大组,18个亚组[18],从系统进化树可以看出,AsNAC2与ATAF亚组中的拟南ANAC002/102和水稻OsNAC48/71转录因子聚在在一个分支上(图3),说明AsNAC2属于NAC转录因子ATAF亚组。
另外,可以从图中看出,AsNAC2与锦葵目锦葵科中的可可NAC 2-like(XP_007048529.2)和哥伦比亚锦葵NAC 2-like(XP_021274745.1)及同目木棉科中榴莲NAC 2-like(XP_022774837.1)分布在一个小支上(图3),说明同属于热带木本植物的这类NAC转录因子的进化关系最近。ExPASy在线工具分析显示,AsNAC2蛋白分子式为C1463H2214N396O429S14,相对分子质量为32.663,理论等电点为6.61,不稳定系数为33.80,属于稳定蛋白质,亲水性平均系数为−0.687,属亲水性蛋白。TargetP 5.0 Server分析显示AsNAC2不具有信号肽,为非分泌蛋白;WoLFPSORT亚细胞预测定位结果表明该蛋白定位在细胞核中。TMHMM工具分析显示,AsNAC2编码的蛋白不存在跨膜结构域,是非膜蛋白。

黑色表示氨基酸在这8个NAC序列中100%相同,红色表示相同率不小于75%,黄色表示相同率不小于50%

图3 AsNAC2和其他植物的同源NAC蛋白的系统进化树
3.3 白木香AsNAC2基因的表达模式分析
运用qRT-PCR技术检测基因在健康白木香不同组织中的表达情况(图4)。如图所示基因主要在根和茎中表达,在叶片中的表达量最低(图4)。为了研究此基因在伤害诱导白木香结香过程的作用,本实验进一步分析了白木香茎在全断干伤害后基因的表达模式(图5)。结果显示,在白木香茎受到全断干伤害后,基因的表达量显著增加,在2 h达到最高峰,约为对照(健康)的6.8倍。随后呈现缓慢的下降趋势,在48 h左右基本恢复正常(图5)。

图4 AsNAC2基因在健康白木香不同组织中的表达特征
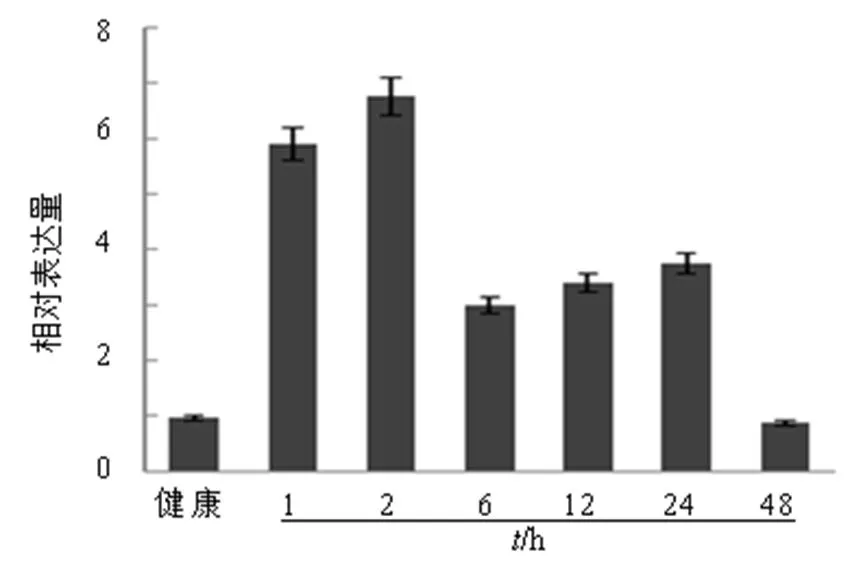
图5 机械伤害胁迫下白木香茎中AsNAC2基因的表达情况
4 讨论
本研究首次从白木香中克隆了基因。生物信息学分析表明,AsNAC2蛋白在N-端具有NAC转录因子特有的典型的NAM结构域,含有A、B、C、D和E 5个亚结构域,在C-端具有一个高度变异的转录激活区[18],而且和其他植物中已经报道的NAC蛋白具有较高的同源性及相类似的理化特性。由此推断,本研究中获得的AsNAC2属于NAC家族转录因子。
已有研究表明NAC转录因子在拟南芥木质组织的细胞壁加厚和杨树次生细胞壁的形成过程中起着重要的调控作用。例如拟南芥NAC转录因子VND7调控了导管次生壁的形成[19],SND1在纤维次生壁的加厚过程中起到了关键的调控作用[20],在拟南芥中过量表达杨树NAC转录因子PtrWND2B和PtrWND6B,能够恢复NST1和NST3双突变引起的维管束间纤维细胞次生壁缺陷的表型[21]。本研究发现,基因主要在白木香茎和根中表达,而其蛋白与热带木本植物可可和榴莲等NAC蛋白关系最近。另外Pascual等[22]认为NAC转录因子在木本植物的木材形成和应对胁迫过程中具有保守的调控机制。综上说明,AsNAC2转录因子可能与白木香木材细胞的形成有关。
Ooka等[18]根据水稻和拟南芥NAC结构域的氨基酸序列的相似性将NAC转录因子家族分为2个大组和18个亚组。同一亚组的NAC蛋白,不仅结构域的氨基酸序列相似性非常高,而且还通常具有相似生物学功能[23]。系统进化树表明,白木香AsNAC2蛋白属于ATAF亚组。拟南芥ATAF亚组中的ATAF1(ANAC002)转录因子正向调控了淀粉粒的降解[24]。白木香在受到伤害形成沉香的过程中,最明显的变化之一就是淀粉粒的消失[25]。本研究发现全断干法伤害后,基因的表达量显著上调。综上说明,AsNAC2转录因子可能与伤害诱导白木香淀粉粒降解有关。
本研究从白木香中克隆获得一个NAC转录因子AsNAC2,并发现该转录因子可能与白木香木材细胞的生长和伤害诱导淀粉粒的降解有关,丰富了“伤害诱导白木香防御反应形成沉香”的理论。目前课题组正对其进行亚细胞定位和转录活性分析,并预期通过转基因研究,进一步解析AsNAC2转录因子在白木香生长发育,尤其是伤害诱导白木香结香过程中的功能。
利益冲突 所有作者均声明不存在利益冲突
[1] 中国药典 [S]. 四部. 2020: 192.
[3] 张争, 杨云, 魏建和, 等. 白木香结香机制研究进展及其防御反应诱导结香假说 [J]. 中草药, 2010, 41(1): 156-159.
[4] 孙佩文, 唐小琳, 吕菲菲, 等. 白木香转录因子AsWRKY62的分子克隆、原核表达及特性分析 [J]. 中草药, 2019, 50(11): 2675-2682.
[5] 廖永翠, 章文春, 魏建和, 等. 白木香JAZ1基因全长cDNA克隆及其在愈伤组织中的伤害诱导表达分析 [J]. 中草药, 2019, 50(13): 3162-3168.
[6] CITES. Amendments to appendices I, II and III of cites [Z]. Proceedings of Thirteenth Meeting of the Conference of the Parties. Bangkok, Thailand: 2004: 2-14.
[7] Sun P W, Xu Y H, Yu C C,. AsWRKY44 represses the wound-induced sesquiterpene biosynthetic geneexpression in(Lour.) Gilg [J]., 2020, 71(3): 1128-1138
[8] Gao Z H, Wei J H. Molecular mechanism studies of terpenoid biosynthesis in Agarwood [M]. Berlin: Springer, 2016: 73-88.
[9] Xu Y H, Zhang Z, Wang M X,. Identification of genes related to agarwood formation: Transcriptome analysis of healthy and wounded tissues of[J]., 2013, 14: 227.
[10] Lv F F, Li S S, Feng J,. Hydrogen peroxide burst triggers accumulation of jasmonates and salicylic acid inducing sesquiterpene biosynthesis in wounded[J]., 2019, 234/235: 167-175.
[11] Xu Y H, Liao Y C, Lv F F,. Transcription factor AsMYC2controls the jasmonate-responsive expression of ASS1regulating sesquiterpene biosynthesis in(Lour.) Gilg [J]., 2017, 58(12): 2257.
[12] 李鹏, 黄耿青, 李学宝. 植物NAC转录因子 [J]. 植物生理学通讯, 2010, 46(3): 294-300.
[13] 周鸿慧, 黄红, 徐彬磊, 等. NAC转录因子在植物对生物和非生物胁迫响应中的功能 [J]. 植物生理学报, 2017, 53(8): 1372-1382.
[14] Souer E, van Houwelingen A, Kloos D,. The no apical meristem gene ofis required for pattern formation in embryos and flowers and is expressed at meristem and primordia boundaries [J]., 1996, 85(2): 159-170.
[15] Nakashima K, Takasaki H, Mizoi J,. NAC transcription factors in plant abiotic stress responses [J]., 2012, 1819(2): 97-103.
[16] 方泽蘅, 李文月, 马新业, 等. 盐胁迫下的3代白木香离体根的转录因子表达分析 [J]. 中草药, 2019, 50(10): 2442-2451.
[17] Gao Z H, Wei J H, Yang Y,. Selection and validation of reference genes for studying stress-related agarwood formation of[J]., 2012, 31(9): 1759-1768.
[18] Ooka H, Satoh K, Doi K,. Comprehensive analysis of NAC family genes inand[J]., 2003, 10(6): 239-247.
[19] Yamaguchi M, Kubo M, Fukuda H,. VASCULAR-RELATED NAC-DOMAIN7is involved in the differentiation of all types of xylem vessels inroots and shoots [J]., 2008, 55(4): 652-664.
[20] Zhong R Q, Demura T, Ye Z H. SND1, a NAC domain transcription factor, is a key regulator of secondary wall synthesis in fibers of[J]., 2006, 18(11): 3158-3170.
[21] Zhong R Q, Lee C H, Ye Z H. Functional characterization of poplar wood-associated NAC domain transcription factors [J]., 2009, 152(2): 1044-1055.
[22] Pascual M B, Dela T F, Cañas R A. NAC transcription factors in woody plants [A] // Cánovas F, Lüttge U, Matyssek R,.[M]., 2018: 23-29.
[23] 李伟, 韩蕾, 钱永强, 等. 植物NAC转录因子的种类、特征及功能 [J]. 应用与环境生物学报, 2011, 17(4): 596-606.
[24] Garapati P, Xue G P, Munné-Bosch S,. Transcription factor ATAF1inpromotes senescence by direct regulation of key chloroplast maintenance and senescence transcriptional cascades [J]., 2015, 168(3): 1122-1139.
[25] Liu P W, Zhang X, Yang Y,. Interxylary phloem and xylem rays are the structural foundation of agarwood resin formation in the stems of[J]., 2019, 33(2): 533-542.
Molecular cloning and expression characterization of a transcription factor AsNAC2 in
ZHANG Yu-xiu1, LIU Pei-wei1, LV Fei-fei1, YANG Yun1, XU Yan-hong2, GAO Zhi-hui2, WEI Jian-he1, 2
1. Hainan Provincial Key Laboratory of Resources Conservation and Development of Southern Medicine & Key Laboratory of State Administration of Traditional Chinese Medicine for Agarwood Sustainable Utilization, Hainan Branch of the Institute of Medicinal Plant Development, Chinese Academy of Medical Sciences and Peking Union Medical College, Haikou 570311, China 2. Key Laboratory of Bioactive Substances and Resources Utilization of Chinese Herbal Medicine, Ministry of Education & National Engineering Laboratory for Breeding of Endangered Medicinal Materials, Institute of Medicinal Plant Development, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100193, China
To molecular clone transcription factor ofencoding gene AsNAC2, a rare southern medicine sedum-based plant, in order to analyze its bioinformatics and expression pattern.The full length of the coding sequence (CDS) was obtained by PCR using total RNA reverse transcribed cDNA from the stems ofas the template; Bioinformatics software was used to predict the physicochemical properties, structural domains and subcellular localization of the protein; DNAMAN8.0 and MEGA6.0 were used to perform multiple sequence alignment and evolutionary relationship analysis, respectively. The expression characteristics ofgene under different tissues and injury stresses were examined by qRT-PCR.gene (GenBank accession MT130201) was cloned from; The full length of open reading frame (ORF) was 864 bp. Codification Code a weakly acidic, stable hydrophilic protein consisting of 287 amino acids, which was localized in the nucleus and no transmembrane structural domain existed. Sequence alignment and phylogenetic tree analysis showed that the-terminal AsNAC2 protein had a typical NAM structural domain and was closely related to,and,. NAC 2-like proteins in the mallow order, belonging to the ATAF subgroup of the NAC transcription factor family. qRT-PCR results showed that AsNAC2 gene was mainly expressed in the roots and stems of healthy, and whole-break dry injury significantly induced the up-regulation ofgene expression in the stems, reaching a peak at 2 h, and then slowly decreasing until 48 h when it basically returned to normal.The AsNAC2 gene was cloned and characterized fromfor the first time, which is susceptible to injury-induced expression and correspondingly early in the injury.
(Lour.) Gilg; transcription factor; NAC; cloning; expression analysis
of agarwood–perfumery in eastern Asia and the Asian neighbourhood [J]., 2013, 23(1): 103-125.
R286.12
A
0253 - 2670(2022)15 - 4807 - 06
10.7501/j.issn.0253-2670.2022.15.024
2021-12-06
国家重点研发计划项目(2018YFC1706400);海南省基础与应用基础研究计划(自然科学领域)高层次人才项目(2019RC343);国家自然科学基金青年基金项目(81703651);中国医学科学院医学与健康科技创新工程项目(2021-I2M-1-032)
张玉秀,女,助理研究员,研究方向为药用植物资源保护和开发。E-mail: scauzyx@163.com
通信作者:刘培卫,副研究员,研究方向为药用植物解剖与分子生物学。E-mail: brucelpw@aliyun.com
魏建和,研究员,博士生导师,研究方向为药用植物基因资源与分子育种及次生代谢产物调控研究。Tel: (010)57833016 E-mail: wjianh@263.net
[责任编辑 时圣明]