基于指纹图谱结合化学计量法对何首乌不同炮制品多指标成分分析
张 涛,张 青,易海燕,万 全,谢亚婷,黄 敏,康爱圆,陈明霞, 3*,陈华师,蔡仲希,张金莲*
基于指纹图谱结合化学计量法对何首乌不同炮制品多指标成分分析
张 涛1,张 青2,易海燕1,万 全1,谢亚婷1,黄 敏1,康爱圆1,陈明霞2, 3*,陈华师2,蔡仲希2,张金莲1*
1. 江西中医药大学药学院,江西 南昌 330004 2. 建昌帮药业有限公司,江西 抚州 344100 3. 北京斯利安药业有限公司,北京 100176
建立3个主产地何首乌、炆何首乌、制何首乌共30批样品的HPLC指纹图谱及多成分含量测定方法,结合化学计量法对其进行质量评价。采用HPLC建立何首乌及其炮制品的指纹图谱并进行6种成分的含量测定,通过层次聚类分析(clustering analysis,HCA)、主成分分析(principal component analysis,PCA)和正交偏最小二乘-判别分析(orthogonal partial least squares-discriminant analysis,OPLS-DA)评价不同批次何首乌的质量差异,找寻不同炮制品间质量差异性的主要成分。30批何首乌、炆何首乌、制何首乌的HPLC指纹图谱中有20个共有峰,指认了6个共有峰,峰面积占比均在75%以上。没食子酸(峰1)、二苯乙烯苷(峰8)、大黄素-8--葡萄糖苷(峰14)、大黄素甲醚-8--葡萄糖苷(峰16)、大黄素(峰19)、大黄素甲醚(峰20)质量分数分别在0.59~5.86、4.64~25.83、0.03~3.11、0.01~0.59、0.07~1.98、0.25~1.81 mg/g。方法学考察结果显示,各成分在线性关系良好(≥0.999 7),平均回收率为97.80%~101.51%。指纹图谱相似度结果显示,何首乌及其2种炮制品各自10批的相似度均在0.99以上,但不同类型炮制品的相似度降低。HCA可将3者聚为3类,PCA结果提取了3个主成分,OPLS-DA能有效地将3种饮片明显区分,并根据VIP>1的原则筛选出了6种主要差异成分,共指认了大黄素甲醚-8--葡萄糖苷、大黄素-8--葡萄糖苷、没食子酸、大黄素甲醚4种与何首乌炮制品质量相关性较强的化学成分。建立的何首乌及其炮制品HPLC指纹图谱结合化学计量法的方法简便准确,可为特色饮片炆何首乌的质量控制和品质评价提供参考依据。
何首乌;建昌帮炆法;药典法;HPLC;指纹图谱;多指标成分;化学模式识别;没食子酸;二苯乙烯苷;大黄素-8--葡萄糖苷;大黄素甲醚-8--葡萄糖苷;大黄素;大黄素甲醚;聚类分析;主成分分析;正交偏最小二乘-判别分析;质量控制;品质评价
何首乌为蓼科何首乌属植物何首乌Thunb.的干燥块根,主产于广东、贵州、云南等地,《本草求原》载“产德庆州者良”[1-3]。何首乌生品具有解毒、消痈、截疟、润肠通便等功效;炮制后性味、功效发生改变,可补肝肾,益精血,乌须发,强筋骨,化浊降脂,是古今医家常用的滋补良药。何首乌“生泻熟补”,可见炮制对其化学成分和药理作用产生显著的影响,但研究发现不同炮制方法使得何首乌化学成分变化和药效存在明显的差异[4-5]。
炆何首乌是江西“建昌帮”特色饮片之一,与炆地黄、炆黄精、炆远志收录于《江西省中药饮片炮制规范》2008年版[6]。《建昌帮中药炮制全书》[7]记载:“何首乌经炆制、蒸制能消除滑肠致泻作用、增强滋补之力,酒制能增强温补之力”。但目前炆何首乌化学成分和药理作用的相关研究甚少,炮制机制仍不明确。《中国药典》2020年版以二苯乙烯苷和游离蒽醌为制何首乌的质控指标,而《江西省中药饮片炮制规范》2008年版仅以二苯乙烯苷为质控指标,此要求不能较全面地体现特色饮片炆何首乌的有效性和专属性。
中药活性成分复杂多样,单个指标无法体现药物的整体质量。指纹图谱可在整体上对中药化学特征进行表征,结合化学计量法全面、系统的特点,而被广泛用于中药不同基原、不同炮制品及经典名方的质量评价研究[8-10]。前人已对不同产地的何首乌、制何首乌进行指纹图谱和含量测定研究,但未见炆何首乌等不同炮制品指纹图谱及多成分含量测定的比较研究[11-13]。故本研究在前期对炆何首乌等不同炮制品挥发性成分研究的基础上[14],通过HPLC指纹图谱、有效成分的含量测定与层次聚类分析(clustering analysis,HCA)、主成分分析(principal component analysis,PCA)和正交偏最小二乘-判别分析(orthogonal partial least squares- discriminant analysis,OPLS-DA)等化学计量模式识别法对3个主产地,共30批何首乌及其不同炮制品饮片进行质量分析研究,为多指标的复杂含量测定与指纹图谱相结合的方法评价何首乌不同炮制品质量提供有效的参考,同时也为其他中药的不同炮制品质量评价提供新思路。
1 仪器与材料
1.1 仪器
Milli QB型超纯水净化系统,美国Millipore公司;Waters 2695型高效液相色谱仪,美国Waters公司,Empower色谱工作站;KQ5200B型超声波清洗器,昆山市超声仪器有限公司;AE240型十万分之一电子天平,美国Mettle公司;OHAUS型万分之一分析天平,奥豪斯国际贸易(上海)有限公司。
1.2 试剂
没食子酸(批号CHB-M-037)、二苯乙烯苷(批号CHB210107)、大黄素(批号CHB201201)、大黄素甲醚(批号CHB201204)、大黄素-8--葡萄糖苷(批号CHB201203)、大黄素甲醚-8--葡萄糖苷(批号CHB201206)均购自成都克洛玛生物科技有限公司,质量分数均≥98%;水为屈臣氏蒸馏水;甲醇(批号63Y1706TE)、磷酸(批号H2020219)均为色谱纯,均购自美国ACS恩科化学公司。
1.3 材料
何首乌饮片、黑豆均来源于江西省建昌帮药业有限公司,经江西中医药大学中药资源教研室邓可众教授鉴定,分别为蓼科何首乌属植物何首乌Thunb.的干燥块根、豆科植物大豆(L.) Merr.的干燥成熟种子。炆何首乌、制何首乌分别按照《江西省中药饮片炮制规范》2008年版[2]和《中国药典》2020年版[1]相应规定加工制作而成,样品信息见表1。

表1 何首乌饮片产地及批号信息
2 方法与结果
2.1 炮制品的制备
2.1.1 炆何首乌 取净何首乌块,浸泡过夜至内无干心,与黑豆放入炆药罐内,加入40~50 ℃温水,上盖,移至围灶内,罐四周放置木炭和干糠(每100 kg何首乌,用木炭5 kg、干糠80 kg)点燃后炆24 h,至糠尽灰冷,取出;65 ℃烘箱干燥至七成干;再用剩余药汁和黄酒拌匀,待吸尽后,蒸6 h,停火密闭1夜,取出,置烘箱干燥至干。每100 kg何首乌,用黑豆10 kg、黄酒20 kg。
2.1.2 制何首乌 取何首乌块,照蒸法(《中国药典》通则0213),加入黑豆汁拌匀吸尽后,连续蒸制使饮片内外均呈棕褐色,取出,置65 ℃烘箱干燥至干。每100 kg何首乌,用黑豆10 kg。黑豆汁制法:取黑豆10 kg,加水适量,煮约4 h,熬汁约15 kg,豆渣再加水煮约3 h,熬汁约10 kg,合并得黑豆汁约25 kg。
2.2 溶液的制备
2.2.1 供试品溶液的制备 取何首乌及其炮制品过4号筛粉末0.5 g,精密称定,置具塞锥形瓶中,精密加入甲醇25 mL,密塞,称定质量,水浴回流1 h,放冷,用甲醇补足减失的质量,取续滤液,过0.22 μm微孔滤膜,即得何首乌及其炮制品供试品溶液。另取“2.1.2”项下黑豆汁,取续滤液,过0.22 μm微孔滤膜,即得黑豆汁供试品溶液。
2.2.2 对照品溶液的制备 精密称取没食子酸、二苯乙烯苷、大黄素、大黄素甲醚、大黄素-8--葡萄糖苷、大黄素甲醚-8--葡萄糖苷对照品适量,用纯甲醇溶解,制成含没食子酸5.6 μg/mL、二苯乙烯苷168.1 μg/mL、大黄素-8--葡萄糖苷73.9 μg/mL、大黄素甲醚-8--葡萄糖苷56.4 μg/mL、大黄素41.8 μg/mL、大黄素甲醚132.6 μg/mL的混合对照品溶液,备用。
2.3 色谱条件
Phenomenex C18色谱柱(250 mm×4.6 μm,5 μm);流动相为甲醇-0.1%磷酸水溶液,梯度洗脱:0~6 min,10%~18%甲醇;6~23 min,18%~48%甲醇;23~28 min,48%甲醇;28~44 min,48%~80%甲醇;44~46 min,80%~90%甲醇;46~60 min,90%甲醇;柱温30 ℃;体积流量1 mL/min;进样量10 µL;检测波长:280 nm(二苯乙烯苷、没食子酸)、254 nm(大黄素、大黄素甲醚、大黄素-8--葡萄糖苷、大黄素甲醚-8--葡萄糖苷)。
2.4 指纹图谱的构建
2.4.1 精密度试验 取何首乌样品(S1),按“2.2.1”项下方法制备供试品溶液,按“2.3”项下色谱条件连续进样6次,以8号峰(二苯乙烯苷)为参照峰,计算指纹图谱中各共有峰的相对保留时间和相对峰面积。结果显示各共有峰相对保留时间的RSD<0.93%,相对峰面积的RSD小于2.99%,表明仪器精密度良好。
2.4.2 稳定性试验 取何首乌样品(S1),按“2.2.1”项下方法制备供试品溶液,分别在制备后0、2、4、8、12、24 h按“2.3”项下色谱条件测定,以8号峰(二苯乙烯苷)为参照峰,结果显示各共有峰相对保留时间的RSD<0.48%,相对峰面积的RSD<2.67%,表明供试品溶液在24 h内稳定性良好。
2.4.3 重复性试验 取何首乌样品(S1),按“2.2.1”项下方法平行制备6份供试品溶液。按“2.3”项下色谱条件测定,以8号峰(二苯乙烯苷)为参照峰,结果显示,各共有峰相对保留时间的RSD<0.28%,相对峰面积的RSD<2.37%,表明该方法重复性良好。
2.4.4 HPLC指纹图谱的建立 将30批何首乌及其炮制品样品,按照“2.2.1”项下方法制备供试品溶液,按照“2.3”项下的色谱条件测定。将30批何首乌及其炮制品指纹图谱数据导入国家药典委员会《中药色谱指纹图谱相似度软件评价系统(2012版)》,以样品S1为参照图谱,采用中位数法,时间窗宽度为0.2 min,通过多点校正进行峰匹配,生成何首乌、炆何首乌、制何首乌的指纹图谱,结果见图1。结果30批样品共得到20个共有峰,经过与混合对照品溶液的色谱图比对,确定色谱峰1、8、14、16、19、20分别为没食子酸、二苯乙烯苷、大黄素-8--葡萄糖苷、大黄素甲醚-8--葡萄糖苷、大黄素、大黄素甲醚。此外,22号峰为炆何首乌独有,24、27号峰为何首乌独有,28号峰为制何首乌独有;21、23号峰为炆何首乌和制何首乌共有,25、26号峰为何首乌和制何首乌共有。对照指纹图谱、何首乌、炆何首乌、制何首乌及混合对照品溶液的色谱图见图2。
取黑豆样品,按“2.1.2”项下方法制备黑豆汁,按“2.2.1”项下方法制备供试品溶液,按“2.3”项下色谱条件进样,将所得色谱图与何首乌、炆何首乌、制何首乌相比较,结果发现4者有10个共有峰,见图3。

图1 30批何首乌、炆何首乌和制何首乌饮片HPLC指纹图谱
2.5 相似度分析
将何首乌及其炮制品的色谱数据导入《中药色谱指纹图谱相似度评价系统(2012版)》,分别计算各自10批及总30批样品的相似度,结果见表2。
结果可得,与对照指纹图谱(R)相比,何首乌、炆何首乌、制何首乌各10批的指纹图谱相似度均>0.99,说明同一饮片不同批次间整体质量较稳定;在总30批中,何首乌、炆何首乌、制何首乌的相似度分别为0.893~0.925、0.799~0.892、0.976~0.993,可见不同类型炮制品的相似度降低。
2.6 HCA
以30批何首乌、炆何首乌和制何首乌20个共有峰峰面积为变量,运用SPSS 21.0统计软件,采用组间联接法及皮尔逊相关性作为分类依据进行HCA,聚类结果见图4。当分类距离为5时,何首乌、炆何首乌和制何首乌各10批可自分为一类;当分类距离为10时,30批样品聚为2类,20批何首乌和制何首乌聚为一类,10批炆何首乌聚为一类,与相似度结果可相互佐证。

1-没食子酸 8-二苯乙烯苷 14-大黄素-8-O-葡萄糖苷 16-大黄素甲醚-8-O-葡萄糖苷 19-大黄素 20-大黄素甲醚
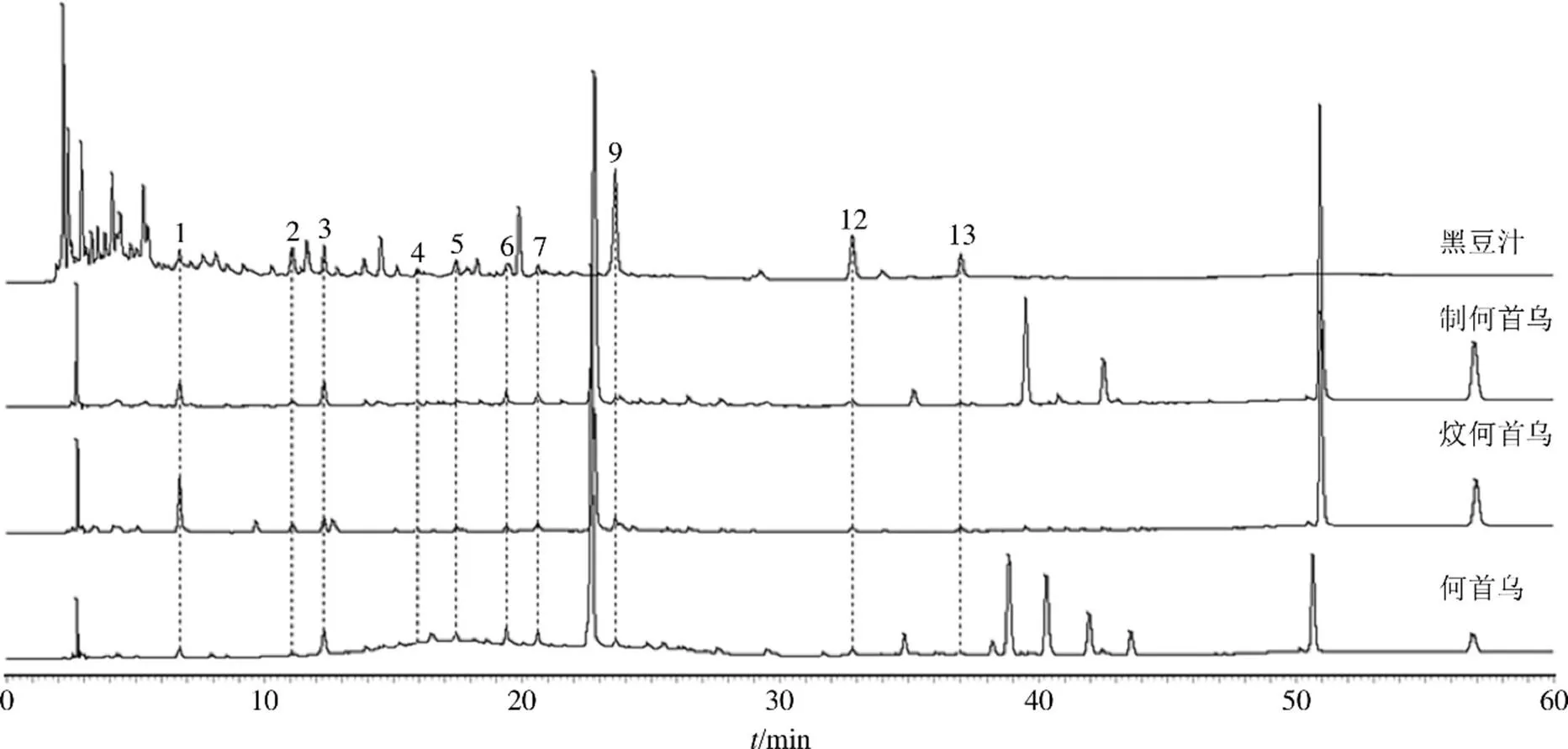
图3 黑豆汁与何首乌及其炮制品HPLC图谱
2.7 PCA
将3个产地共30批何首乌、炆何首乌、制何首乌饮片20个共有峰的相对峰面积导入SIMCA 14.1软件进行无监督模式的PCA分析,观察样品间自然聚集,结果见图5。根据PCA得分图,30批何首乌、炆何首乌和制何首乌各自聚集,可分为3类,说明何首乌炮制前后成分发生明显的改变且不同炮制方法对成分的影响显著不同;何首乌与制何首乌的点较接近,与炆何首乌相聚较远,与HCA结果一致。
2.8 OPLS-DA
在PCA的基础上,将30批何首乌、炆何首乌、制何首乌饮片共有峰峰面积导入SIMCA 14.1软件进行OPLS-DA,进一步分析不同产地何首乌及其炮制品饮片的差异性,样本得分矩阵见图6-A。该模型解释率参数2为0.964,预测能力参数2为0.954,表明建立的数学模型稳定且预测能力较强。从OPLS-DA得分图可得,何首乌、炆何首乌、制何首乌聚类效果较好,分为明显的3类,与HCA和PCA结果一致。根据变量重要性投影(VIP)值>1的原则,筛选差异组分,见图6-B。结果共找到了6个成分,VIP值大小排序依次为15、16(大黄素甲醚-8--葡萄糖苷)、14(大黄素-8--葡萄糖苷)、17、1(没食子酸)、20(大黄素甲醚)号峰是引起何首乌不同炮制品成分差异的主要标志性成分。

表2 30批何首乌、炆何首乌、制何首乌样品图谱相似度

图4 不同产地何首乌及其炮制品指纹图谱聚类分析树状图
2.9 多成分含量测定
2.9.1 线性关系考察 取“2.2.2”项下各对照品溶液适量,按倍数用甲醇稀释6次,得系列对照品溶液,按“2.3”项下色谱条件测定,进样量10 μL。以对照品质量浓度为横坐标(),以对照品峰面积为纵坐标()绘制标准曲线,进行线性回归,得到6种成分的回归方程及线性范围分别为没食子酸=329 971-12 674,=0.999 7,线性范围0.090~0.403 μg/mL;二苯乙烯苷=527 074-124 558,=0.999 7,线性范围1.424~6.408 μg/mL;大黄素- 8--葡萄糖苷=64 764+9284,=0.999 7,线性范围0.049~0.164 μg/mL;大黄素甲醚-8--葡萄糖苷=57 128-1 792.7,=0.999 7,线性范围0.035~0.157 μg/mL;大黄素=908 059-4 178.2,=0.999 9,线性范围0.210~0.994 μg/mL;大黄素甲醚=377 077-23 826,=0.999 8,线性范围0.224~1.008 μg/mL。

图5 不同产地何首乌及其炮制品指纹图谱PCA得分图

图6 不同产地何首乌及其炮制品指纹图谱OPLS-DA得分图(A)和VIP图(B)
2.9.2 精密度试验 精密吸取“2.2.2”项下对照品溶液10 μL,照上述“2.3”项下色谱条件进行分析,连续进样6次,记录各成分峰面积,结果没食子酸、二苯乙烯苷、大黄素-8--葡萄糖苷、大黄素甲醚-8--葡萄糖苷、大黄素、大黄素甲醚的RSD分别为2.11%、1.59%、0.23%、2.48%、0.15%、0.20%,表明仪器精密度良好。
2.9.3 稳定性试验 取何首乌药材(S1),按照“2.2.1”项下方法制备供试品溶液,照上述“2.3”项下色谱条件进行分析,分别于0、2、4、8、12、24 h进样,记录各成分峰面积,结果没食子酸、二苯乙烯苷、大黄素-8--葡萄糖苷、大黄素甲醚-8--葡萄糖苷、大黄素、大黄素甲醚的RSD分别为1.21%、0.40%、1.04%、2.36%、1.02%、1.87%,表明供试品溶液在24 h内稳定性良好。
2.9.4 重复性试验 取何首乌药材(S1),平行6份,按照“2.2.1”项下方法制备供试品溶液,照上述“2.3”项下色谱条件进行分析,记录各成分峰面积,结果没食子酸、二苯乙烯苷、大黄素-8--葡萄糖苷、大黄素甲醚-8--葡萄糖苷、大黄素、大黄素甲醚的质量分数均值依次分别为0.78、17.14、2.20、0.45、0.17、0.32 mg/g,RSD分别为2.45%、0.28%、1.05%、1.89%、0.48%、1.49%,表明本方法重复性良好。
2.9.5 加样回收率试验 精密称定已测定指标成分含量的何首乌药材样品粉末(S1),分别精密加入与样品中待测成分已知含量相当的0.5、1.0、1.5倍混合对照品溶液,每个梯度平行3份,按“2.2.1”项下制备供试品溶液,按“2.3”项下色谱条件进样测定,记录没食子酸、二苯乙烯苷、大黄素-8--葡萄糖苷、大黄素甲醚-8--葡萄糖苷、大黄素、大黄素甲醚峰面积,并计算平均加样回收率分别为100.92%、98.94%、101.51%、97.80%、100.11%、98.63%,RSD分别为1.77%、2.20%、2.03%、3.05%、2.70%、1.62%。
2.9.6 样品测定 取30批何首乌、炆何首乌、制何首乌药材按“2.2.1”项下方法制备供试品溶液,按“2.3”项下色谱条件进行测定,计算各成分含量(按干燥品计算),结果见表3。
2.9.7 成分分析 将何首乌、炆何首乌、制何首乌各10批的6个成分含量测定结果导入SPSS 21.0进行显著性分析,3者各成分的含测结果平均值和显著性见表4。
2.9.8 峰占比 将何首乌、炆何首乌、制何首乌各10批的6种成分峰面积相加,计算其所占总峰面积的比例,见表5。取6种成分在30批何首乌及其炮制品的峰面积均值,计算其所占总峰面积均值的比例,见表6。

表3 样品含量测定结果(n = 3)
“−”表示低于定量限
“−”below the limit of quantitation
3 讨论
3.1 样品提取方法与色谱条件考察
在前期研究中,本实验考察了以超纯水及25%、50%、75%、100%甲醇作为提取溶剂,超声、回流两种提取方式,30、40、50、60 min提取时间,1∶50、1∶30、1∶10物料比,以出峰个数、峰形、分离度、峰面积为考察依据,结果发现采用100%甲醇,回流提取60 min,料液比为1∶50的提取方法较优。在此基础上,考察了色谱条件,以甲醇-水、甲醇-0.1%磷酸水溶液、甲醇-0.1%甲酸水溶液、乙腈-0.1%磷酸水溶液作为流动相,25、30、35 ℃柱温,0.8、1.0、1.2 mL/min体积流量,并对色谱进行全波长扫描,发现280 nm(二苯乙烯苷、没食子酸)、254 nm(大黄素、大黄素甲醚、大黄素-8--葡萄糖苷、大黄素甲醚-8--葡萄糖)在甲醇-0.1%磷酸水溶液作为流动相、30 ℃柱温、1.0 mL/min体积流量下的色谱峰峰形较好,出峰稳定,吸收强度高。
表4 何首乌、炆何首乌、制何首乌含量平均值及显著性(, n = 10)
Table 4 Average value and significance of content of PMR, BPMR, and PMRP (, n = 10)
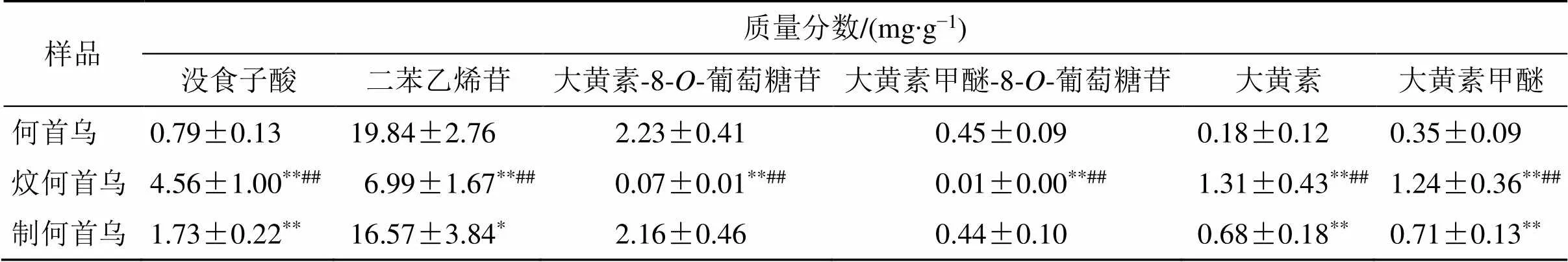
表4 何首乌、炆何首乌、制何首乌含量平均值及显著性(, n = 10)
样品质量分数/(mg∙g−1)没食子酸二苯乙烯苷大黄素-8-O-葡萄糖苷大黄素甲醚-8-O-葡萄糖苷大黄素大黄素甲醚 何首乌0.79±0.1319.84±2.762.23±0.410.45±0.090.18±0.120.35±0.09 炆何首乌4.56±1.00**##6.99±1.67**##0.07±0.01**##0.01±0.00**##1.31±0.43**##1.24±0.36**## 制何首乌1.73±0.22**16.57±3.84*2.16±0.460.44±0.100.68±0.18**0.71±0.13**
与何首乌组比较:*<0.05**<0.01;与制何首乌组比较:##<0.01
*<0.05**<0.01PMR group;##<0.01PMRP group

表5 6种成分峰面积之和占比

表6 6种成分峰面积均值占比
3.2 指纹图谱及模式识别分析
本实验在指纹图谱相似度评价的基础上,采用HCA、PCA、OPLS-DA等化学计量法综合评价何首乌及其2种炮制品的质量。在指纹图谱相似度中,何首乌、炆何首乌、制何首乌各自10批的指纹图谱相似度均>0.99,说明同类饮片不同批次间成分群差异不显著,相同炮制品的整体质量较稳定;在总30批中,何首乌、炆何首乌、制何首乌的相似度分别为0.893~0.925、0.799~0.892、0.976~0.993,可见不同类型炮制品的相似度降低。何首乌与制何首乌的图谱比较接近,而与炆何首乌相差较大,说明何首乌经炆制后其化学成分发生更大的变化。HCA、PCA、OPLS-DA结果与相似度评价结果一致,进一步说明化学计量法用于评价药材质量的稳定、可靠。
3.3 黑豆对何首乌不同炮制品的影响
黑豆作为何首乌的炮制辅料,应用历史悠久,在炮制过程中主要有药材与黑豆交叉铺放和黑豆汁浸泡两种应用形式。本研究发现黑豆汁与何首乌及其炮制品有10个共有峰,故辅料黑豆可能通过这10个成分而发挥对炮制品的作用,但其在炆何首乌与制何首乌中的峰面积具有差异性,这可能与辅料黑豆的应用形式有关。后续可采用正交或响应面实验探讨炮制方法、辅料对何首乌化学成分的具体影响。
3.4 指标成分的确定
根据VIP值>1的原则,本研究发现了6个区分何首乌及其2种炮制品的标志性物质。通过与对照品比对,16、14、1、20号峰分别为大黄素甲醚- 8--葡萄糖苷、大黄素-8--葡萄糖苷、没食子酸、大黄素甲醚。二苯乙烯苷既是何首乌中特有成分,又是其重要的药效成分;现代研究表明二苯乙烯苷在神经保护、抗衰老、降血糖等方面有显著的生物活性[15-17]。
大黄素是何首乌《中国药典》指标成分之一,具有抗动脉粥样硬化、抗肿瘤、乌发等药理作用[18-20]。Ma等[21]通过UPLC-MS/MS技术对何首乌药代动力学进行研究,发现二苯乙烯苷、大黄素、大黄素甲醚、大黄素-8--葡萄糖苷、大黄素甲醚-8--葡萄糖苷、没食子酸等9种成分是何首乌的主要入血成分,其中二苯乙烯苷、大黄素在II期被初级代谢,其他则作为药物原型代谢。本研究发现6者的峰面积在何首乌、炆何首乌、制何首乌各10批的峰占比均达到75%以上;此外,6种成分在总30批何首乌及其炮制品的峰面积均值占比为83.86%。故选择这6种成分的含测结果可较为科学、全面地反映饮片质量。
3.5 含量测定分析
与何首乌、制何首乌相比,炆何首乌中没食子酸、大黄素和大黄素甲醚含量显著升高;而二苯乙烯苷、大黄素-8--葡萄糖苷、大黄素甲醚-8--葡萄糖苷含量显著降低。通过查阅文献可知,何首乌炮制后二苯乙烯苷含量下降与其在光和热的条件下极不稳定,易分解为顺式-二苯乙烯苷的特性有关[22];结合型蒽醌下降、游离型蒽醌上升,是炮制的过程中结合型蒽醌发生水解生成游离型蒽醌所致[23];没食子酸含量上升,可能是可水解鞣质及含有没食子酰基的苷类成分在高温下分解的结果[24]。本研究的不足之处之一在于没有验证成分变化的具体原因,后续可增加相关实验加以佐证。
3.6 基于“物-效-毒”的炮制机制分析
何首乌炮制品药效、毒性作用与其炮制过程中成分变化密切相关。本研究结果显示,何首乌炮制后结合蒽醌含量下降,游离蒽醌含量上升,且与制何首乌相比,炆何首乌的含量变化具有极显著性(<0.01)。研究发现苷类成分在口服后肠吸收之前受到肠内菌丛的首过作用而发生生物转化生成相应苷元,从而影响化合物的肠吸收和生物学活性[25]。结合蒽醌具有致泻活性,大黄素、大黄素甲醚等游离蒽醌与保肝作用密切相关[26],本研究结果显示与何首乌“生泻熟补”药效是一致的。
现代毒理学研究表明大黄素-8--β--葡萄糖苷、大黄素甲醚-8-- β--葡萄糖苷等蒽醌苷类成分和鞣质是何首乌主要的肝毒性成分[27-30];而二苯乙烯苷可能与鞣质、蒽醌类具有协同作用而对肝脏造成更加严重的损伤[31-32]。但研究表明长时间、大剂量服用何首乌制剂或相关单体才会造成肝损伤,如大黄素及大黄素甲醚-8--葡萄糖苷在浓度≥400 μmol/L时才可能对肝组织产生一定的损害作用[33]。故何首乌各主要成分的含量范围及比例与其药效和毒性密切相关,应设置适当的范围,以保证药效作用最大而毒性最低。
4 结论
中药必须经过炮制后入药是中医用药的特点之一,炮制工艺不同,疗效也不同,关键在于炮制品的内在成分发生不同程度的改变。故规范何首乌的炮制方法,选择合理的质控指标是推动何首乌及其饮片发展的关键因素。本研究通过何首乌及其炮制品的指纹图谱与含量测定相结合的方法,并结合多元统计法对其信息作进一步综合分析,清晰地表明了不同何首乌炮制品差异,实现了对何首乌炮制品的全面综合质量评价。多指标的复杂含量测定与指纹图谱相结合的方法为评价何首乌不同炮制品质量提供有效的参考,同时也为其他中药的不同炮制品质量评价提供新思路。
利益冲突 所有作者均声明不存在利益冲突
[1] 中国药典[S]. 一部. 2020: 183-184.
[2] 李欣, 孟磊, 魏胜利, 等. 不同产地何首乌药材质量及差异研究 [J]. 中国现代中药, 2020, 22(3): 384-390.
[3] 清·赵其光. 朱蕴菡, 王旭东校注. 本草求原 [M]. 北京: 中国中医药出版社, 2016: 170-171.
[4] 杨磊, 刘梦娇, 陈文明, 等. 2种炮制方法对何首乌中6种成分变化的影响 [J]. 中成药, 2019, 41(1): 119-123.
[5] 王万根, 张宁华, 徐巧红, 等. 何首乌高压蒸制法蒸制时间对何首乌抗衰老活性影响的研究 [J]. 云南中医学院学报, 2013, 36(2): 1-4.
[6] 江西省食品药品监督管理局. 江西省中药饮片炮制规范: 2008年版 [M]. 上海: 上海科学技术出版社, 2009: 87-88.
[7] 上官贤. 建昌帮中药炮制全书 [M]. 南昌: 江西教育出版社, 2013: 209-211.
[8] 李妍, 何文媛, 王康宇, 等. 基于HPLC多指标成分测定及指纹图谱多模式识别方法的北细辛质量分析 [J]. 中草药, 2022, 53(1): 238-243.
[9] 谭小娟, 李世雄, 李璎峪, 等. 白术饮片的指纹图谱形状特征与质量标志物(Q-Marker)研究 [J]. 中草药, 2021, 52(16): 4844-4851.
[10] 管咏梅, 万鑫浩, 吴文婷, 等. 经典名方桂枝加葛根汤标准汤剂HPLC指纹图谱研究 [J]. 中草药, 2021, 52(18): 5535-5542.
[11] 倪昌荣, 刘史佳, 卢嘉微, 等. 不同产地制何首乌HPLC指纹图谱研究及5种成分的含量测定 [J]. 中医药导报, 2020, 26(9): 29-33.
[12] 王珏, 朱育凤, 姚毅, 等. HPLC同时测定何首乌中5种成分及指纹图谱的建立 [J]. 中国中医药信息杂志, 2019, 26(6): 75-81.
[13] 林艳, 刘月新, 李春, 等. 生/制何首乌HPLC指纹图谱结合模式识别与含量测定的质量控制研究 [J]. 中国中医药信息杂志, 2018, 25(12): 62-66.
[14] 张涛, 邓亚羚, 陈西勇, 等. 基于HS-GC-MS考察建昌帮炆法对何首乌气味形成的影响[J]. 中国实验方剂学杂志, 2022, 28(14): 134-141.
[15] 王松海, 陈建宗, 陈捷. 二苯乙烯苷通过激活Nrf2减轻MPP+诱导的PC12细胞凋亡 [J]. 中国药学杂志, 2017, 52(11): 948-953.
[16] Sun M L, Chen X Y, Cao J J,.Thunb. extract extended the lifespan and healthspan ofvia DAF-16/SIR- 2.1/SKN-1 [J]., 2021, 12(18): 8774-8786.
[17] Wang X B, Zeng J, Wang X,. 2,3,5,4′- tetrahydroxystilbene-2--β--glucoside induces autophagy of liver by activating PI3K/Akt and Erk pathway in prediabetic rats [J]., 2020, 20(1): 177.
[18] 夏丽, 田维毅, 王和生, 等. 大黄素对高脂饲料诱导ApoE-/-小鼠动脉粥样硬化的影响 [J]. 中成药, 2021, 43(12): 3464-3467.
[19] 杨念, 曹风军, 霍剑伟, 等. 基于SREBP1的制何首乌抗肝癌脂代谢蒽醌类活性成分的筛选 [J]. 湖北医药学院学报, 2018, 37(2): 156-160.
[20] Kim J, Kim M M. The effect of emodin on melanogenesis through the modulation of ERK and MITF signaling pathway [J]., 2022, 36(4): 1084-1088.
[21] Ma N H, Zhang Y, Sun L Y,. Comparative studies on multi-component pharmacokinetics ofThunb. extract after oral administration in different rat models [J]., 2021, 12: 655332.
[22] 郭志烨, 韩丽, 杨明, 等. 制何首乌中二苯乙烯苷对光和热的不稳定性 [J]. 中成药, 2014, 36(11): 2280-2285.
[23] 王芬. 何首乌炮制工艺及其饮片质量评价研究 [D]. 广州: 广州中医药大学, 2018.
[24] 杨丽. 大黄炭“形性-化学-生物”三性指标关联机制与炮制传递规律研究[D]. 北京: 北京中医药大学, 2021.
[25] 杨秀伟, 和子超, 陈丽华, 等. 补骨脂中补骨脂苷和异补骨脂苷的人源肠内菌丛生物转化研究 [J]. 中国中药杂志, 2022, 47(14): 3822-3827.
[26] 王卓, 钟凌云, 解杨, 等. 基于“生熟异用”何首乌的研究进展及其质量标志物(Q-Marker)的预测分析 [J]. 中草药, 2022, 53(3): 882-897.
[27] 宋婧, 马致洁, 王伽伯, 等. 何首乌及其主要成分对正常人L02肝细胞损伤作用的研究 [J]. 北京中医药, 2016, 35(7): 694-697.
[28] 汪祺, 戴忠, 王亚丹, 等. 何首乌中8种成分在大鼠肝微粒体体系中的肝毒性研究 [J]. 中国药学杂志, 2018, 53(8): 589-593.
[29] Li H Y, Yang J B, Li W F,.hepatotoxicity screening of different extracts, components, and constituents ofThunb. in zebrafish () larvae [J]., 2020, 131: 110524.
[30] 胡锡琴, 李娅琳, 王磊. 何首乌中鞣质对大鼠肝脏生化指标的影响 [J]. 药物评价研究, 2010, 33(1): 63-65.
[31] 胡锡琴, 李敏, 杨红莲, 等. 何首乌中鞣质与二苯乙烯苷不同配比对大鼠肝功能指标的影响 [J]. 上海中医药杂志, 2011, 45(4): 56-59.
[32] Zhang L, Liu X Y, Tu C,. Components synergy between stilbenes and emodin derivatives contributes to hepatotoxicity induced by[J]., 2020, 50(5): 515-525.
[33] 杨敏, 刘婷, 冯伟红, 等. 何首乌肝毒性物质基础探索研究 [J]. 中国中药杂志, 2016, 41(7): 1289-1296.
Analysis on multi-index components ofand its processed products based on fingerprints and chemometrics
ZHANG Tao1, ZHANG Qin2, YIHai-yan1, WAN Quan1,XIE Ya-ting1, HUANG Min1, KANG Ai-yuan1, CHEN Ming-xia2, 3, CHEN Hua-shi2, CAI Zhong-xi2, ZHANG Jin-lian1
1. College of Pharmacy, Jiangxi University of Chinese Medicine, Nanchang 330004, China 2. Jianchangbang Pharmaceutical Co., Ltd., Fuzhou 344100, China 3. Beijing Scrianen Pharmaceutical Co., Ltd., Beijing 100176, China
To establish fingerprints and multi-component content determination method of 30 batches of(PMR) from three main origins, braised(BPMR), and(PMRP) by HPLC, so as to evaluate its quality in combination with chemometrics method.The fingerprints of PMR and its processed products were established by HPLC and the content of six components was determined. Clustering analysis (HCA), principal component analysis (PCA) and orthogonal partial least squares-discrimination analysis (OPLS-DA) were used to evaluate the quality difference of different batches of PMR, and find the main components of the quality difference between different processed products.There were 20 common peaks in the fingerprints of 30 batches of PMR, BPMR and PMRP, and six common peaks were identified, the peak area ratios were all above 75%. The mass fractions of gallic acid (peak 1), stilbene glycosides (peak 8), emodin-8--glucoside (peak 14), emodin methyl ether-8--glucoside (peak 16), emodin (peak 19), and emodin methyl ether (peak 20) ranged from 0.59—5.86, 4.64—25.83, 0.03—3.11, 0.01—0.59, 0.07—1.98 and 0.25—1.81 mg/g, respecitively. The results of methodological investigation showed that the components had a good linear relationship (≥ 0.999 7), and the average recoveries ranged from 97.80%—101.51%. The results of the similarity of fingerprints showed that the similarity of 10 batches of PMR, BPMR and PMRP were all above 0.99, while the similarity between different types of processed products decreased. HCA can cluster PMR and its two processed products into three categories, PCA results extract three main components, OPLS-DA can effectively distinguish the three kinds of decoction pieces, and six main kinds were screened out according to the principle of VIP greater than 1. Four chemical components with strong correlation with the quality of processed PMR were identified, including emodin methyl ether-8--glucoside, emodin-8--glucoside, gallic acid and emodin methyl ether.In this study, the HPLC fingerprint of PMR and its processed products combined with chemometric method is simple and accurate, which can provide a reference for the quality control and quality evaluation of the characteristic decoction pieces of BPMR.
; Jianchangbang braising method; pharmacopoeia method; HPLC; fingerprint; multi-index components; chemical pattern recognition; gallicacid; stilbene glycosides; emodin-8--glucoside; emodin methyl ether-8-- glucoside; emodin; emodin methyl ether; clustering analysis; principal component analysis; orthogonal partial least squares- discriminant analysis; quality control; quality evaluation
R283.6
A
0253 - 2670(2022)15 - 4653 - 10
10.7501/j.issn.0253-2670.2022.15.008
2022-02-09
国家自然科学基金资助项目(82060724);江西省重点研发计划(20192BBG70073);江西省卫生健康委员会科技计划项目(202120015);江西省中药学一流学科专项(NO.JXSYLXK-ZHYAO039/141);2022年国家级大学生创新创业训练计划项目(202210412288);企业技术开发项目(2020)
张 涛,男,硕士研究生,研究方向为中药学。E-mail: 1512337515@qq.com
通信作者:张金莲,女,教授,博士生导师,主要从事中药学及中药炮制学的教学及科学研究。Tel: (0791)87118995 E-mail: jxjzzjl@163.com
陈明霞,女,高级工程师,主要从事中药新药及炮制技术研究工作。Tel: 18810958249 E-mail: chenmingxia2003@126.com
[责任编辑 郑礼胜]