Claudin-7在口腔鳞状细胞癌中的表达和作用研究
王金鑫,伊 婕,丁宇洁,钟 旖,孙志达
口腔癌在全球流行的癌症中排名第六,其中超过90%是口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)[1]。OSCC最常发生的部位是舌和口底,占所有病例的50%以上,其次是牙龈、腭黏膜以及唇颊黏膜[2]。目前手术、放疗和化疗是OSCC重要的治疗手段。尽管诊断技术和治疗方式进步,但OSCC患者的五年生存率并没有改善。近年来靶向治疗成为医疗领域的一大热点,对肿瘤相关基因和信号通路的研究有助于靶向药物的研发,提高OSCC患者生存率。
Claudin家族由27种基本的紧密连接的整合膜蛋白组成,分子量为20~34 ku,其在上皮细胞间紧密连接功能中起到重要作用[3-4]。紧密连接负责上皮细胞旁通透性屏障的形成和维持细胞极性[5]。Claudin-7是紧密连接蛋白家族的一部分。近年来研究表明Claudin-7在各种癌症中异常表达,并且与癌症的病因和进展有关[6-13]。由于紧密连接被破坏,Claudin-7表达的丧失将促进肿瘤的发生和发展[14]。研究显示Claudin-7的低表达与多种肿瘤的不良预后相关,如结直肠癌、食管鳞癌和乳腺癌等[6-10]。据报道Claudin-7的表达下调可能与OSCC的发病机制有关,并且Claudin-7的缺失是OSCC侵袭和转移的负面预后因素[15-16]。然而,Claudin-7在OSCC中的具体作用机制仍有待阐明。本研究通过检测OSCC组织中Claudin-7的表达情况,并且通过体外实验研究Claudin-7表达对OSCC细胞系增殖、迁移和上皮间充质转化(epithelial-mesenchymal transition,EMT)的作用,以期为 OSCC的诊疗提供新线索。
1 材料与方法
1.1 实验材料
1.1.1 患者的组织标本信息 收集2019年6月—2020年6月于南京医科大学附属口腔医院口腔颌面外科就诊行颌面部肿物扩大切除术的50例OSCC患者的癌组织样本和其中12例癌旁组织(距离肿瘤2 cm)正常标本。纳入标准如下:①患者术前未行放化疗;②患者行头颈部肿物扩大切除术+颈淋巴结清扫术;③患者有完整的临床病理资料。本研究的开展已取得患者或家属知情同意,并且经过南京医科大学伦理委员会批准(南医口院伦审-PJ2020-121-001)。
1.1.2 细胞系来源 本研究中所使用的口腔鳞癌细胞系是Cal27和HN6细胞系,均购买于中国科学院细胞库(中国上海)。
1.1.3 其他主要实验材料 DMEM/F12培养基、胎牛血清、0.25%胰酶消化液(美国Gibco公司);即用型青霉素-链霉素溶液(中国新赛美公司);Claudin-7过表达慢病毒试剂盒(上海吉凯公司);RT-qPCR试剂盒(日本Takara公司);CCK-8试剂盒(日本DOJINDO公司);Transwell小室(美国Corning公司);RT-qPCR引物(上海生工生物工程有限公司);二氨基联苯胺(diaminobenzidine,DAB)显色试剂盒、即用型正常山羊血清BSA、快捷型酶标羊抗兔抗兔IgG聚合物(福州迈新公司);一抗Claudin-7抗体(美国Invitrogen公司);E-钙黏蛋白(E-cadherin)、N-钙黏蛋白(N-cadherin)、波形蛋白Vimentin抗体(美国CST公司);磷酸甘油醛脱氢酶(glyceraldehyde phosphate dehydrogenase,GAPDH)抗体(中国Proteintech公司)。
1.2 实验方法
1.2.1 免疫组化 组织切片用二甲苯和乙醇进行脱蜡和水化,抗原修复后用3% H2O2灭活内源性过氧化物酶活性。接着即用型山羊血清BSA室温封闭30 min,抑制非特异性染色,然后加入足量一抗 4 ℃下孵育过夜,二抗室温孵育30 min。最后加入适量DAB显色,苏木素复染,中性树脂封片,显微镜采集图像。
1.2.2 免疫组化分析 切片染色结果由两位病理科医师进行双盲评价。按照免疫反应评分(immunoreactive score,IRS)对Claudin-7染色结果分组。IRS分为染色强度(staining intensity,SI)和阳性细胞百分率(percentage of positive cell,PP)两部分,IRS=SI×PP。SI 0分代表无染色,1分代表弱染色,2分代表中等程度的染色,3分代表强染色。PP 0分代表0%,1分代表≤10%,2分代表11%~50%,3分代表51%~80%,4分代表>80%。以IRS 0~6分为Claudin-7低表达,6分以上为高表达。
1.2.3 细胞培养和慢病毒转染检测 Cal27和HN6细胞用含有10%胎牛血清的DMEM/F12培养基在标准37 ℃、5%CO2和湿度饱和的培养箱中培养。用过表达Claudin-7的特定shRNA慢病毒和乱序shRNA慢病毒转染Cal27和HN6细胞,以转染过表达慢病毒的为实验组,转染乱序慢病毒的为阴性对照组。转染后用2 μg/mL 嘌呤霉素选择稳定细胞。RT-qPCR用于评估转染效率。
1.2.4 RT-qPCR分析 来自细胞的总RNA用Trizol试剂分离。测定RNA纯度和浓度后,使用逆转录试剂盒合成单链cDNA。进行PCR扩增后,以 GAPDH为内参照,用2-ΔΔCt法进行分析。Claudin-7的mRNA名称为CLDN7,PCR引物序列如表1所示。

表1 RT-qPCR引物序列
1.2.5 蛋白免疫印迹实验 来自细胞和组织的总蛋白用混合蛋白酶抑制剂的RIPA裂解液提取。将变性后的蛋白样品在聚丙烯酰胺凝胶中电泳分离后,转移蛋白至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜。5%脱脂奶粉封膜1 h后,加入一抗4 ℃下孵育过夜,然后加入二抗室温孵育1 h,化学发光剂显影。用凝胶成像分析系统曝光和采集图像,用Image J软件对图片进行统计分析。
1.2.6 细胞活力测定 通过CCK-8试剂盒评估细胞增殖活力。按照20个细胞/μL将细胞接种至96孔板内,每 24 h加入1次 CCK-8 试剂(10 μL/孔)并用多功能酶标仪测量在450 nm处的光密度(optical density,OD)值。
1.2.7 细胞迁移实验 收集细胞并用基础培养基重悬。在Transwell小室的上室中加入400个/μL的细胞悬液,下室中加入600 μL完全培养基。常规培养24 h后用多聚甲醛固定细胞30 min,再用结晶紫染色20 min。清洗小室,用棉签轻轻拭去上室残留的细胞,吹干后,用正置荧光显微镜采集图像。
1.3 统计学方法
采用SPSS 21.0和GraphPad Prism 8软件进行数据统计分析和作图。采用卡方检验和Fisher确切概率法对计数资料组间进行比较,采用列联系数分析Claudin-7表达水平与患者临床病理特征的相关性。以P<0.05表示差异有统计学意义。
2 结 果
2.1 Claudin-7在 OSCC 组织中的表达水平
免疫组织化学染色结果显示:在50例 OSCC组织样本中,有34例样本为Claudin-7低表达,余16例样本为高表达。而在12例癌旁组织样本中Claudin-7均为阳性表达,2例为低表达,余10例为高表达。因此Claudin-7在OSCC中较癌旁组织呈低表达(图1,P<0.05)。蛋白免疫印迹结果显示:OSCC组织中Claudin-7蛋白表达量显著低于癌旁组织,进一步说明Claudin-7在OSCC中较癌旁组织低表达(图2)。
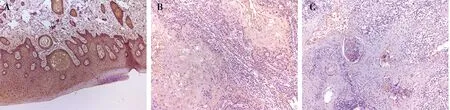
A:癌旁正常组织中Claudin-7高表达; B: OSCC组织中Claudin-7高表达; C: OSCC组织中Claudin-7低表达

N:癌旁组织; T: OSCC组织
2.2 Claudin-7在OSCC组织中的表达与临床病理特征的关系
通过分析50例OSCC患者组织中Claudin-7的表达与临床病理特征的关系,结果(表2)显示:Claudin-7表达水平与患者肿瘤大小、分化程度和淋巴结转移相关(P<0.05);Claudin-7表达水平与其他临床病理特征无关(P>0.05)。

表2 Claudin-7表达与OSCC患者临床病理特征的关系
2.3 Claudin-7表达对OSCC细胞增殖和迁移的影响
RT-qPCR实验和蛋白免疫印迹实验显示:与对照组比较,Cal27和HN6细胞转染慢病毒后Claudin-7的蛋白和mRNA表达水平均显著升高(图3,P<0.05)。CCK-8实验结果显示:与对照组比较,Claudin-7过表达显著抑制了Cal27和HN6细胞的增殖活力(图4A、B,P<0.05);迁移实验结果显示:与对照组比较,Claudin-7过表达后Cal27和HN6细胞的迁移能力显著减弱(图4C、D,P<0.05)。

A、B: 转染后Cal27细胞Claudin-7的蛋白和mRNA表达水平;C、D: 转染后HN6细胞Claudin-7的蛋白和mRNA表达水平;LV-NC代表阴性对照组,LV-CLDN7代表实验组, *:P<0.05,**:P<0.01

A、C: 转染后Cal27细胞增殖活力迁移能力比较;B、D: 转染后HN6细胞增殖活力和迁移能力比较;LV-NC代表阴性对照组,LV-CLDN7代表实验组;*:P<0.05,***:P<0.001
2.4 Claudin-7表达对OSCC细胞上皮间充质转化的影响
蛋白免疫印迹实验和RT-qPCR实验结果显示:与对照组比较,Claudin-7过表达后,Cal27和HN6细胞中EMT转化的上皮标志物E-钙黏蛋白的蛋白表达量和mRNA表达水平显著上调,间充质标志物N-钙黏蛋白和波形蛋白的蛋白表达量和mRNA表达水平显著下调(图5,P<0.05)。
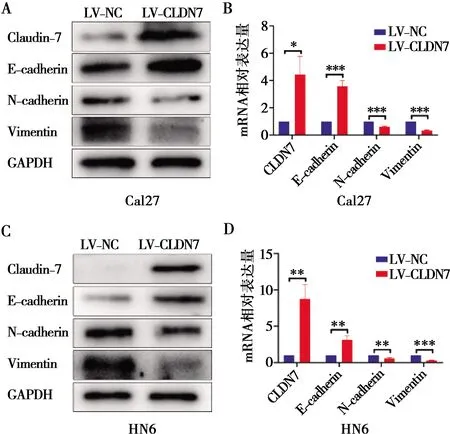
A、B: 转染后Cal27细胞上皮间充质相关指标蛋白和mRNA的表达量;B、D: 转染后HN6细胞上皮间充质相关指标蛋白和mRNA的表达量;LV-NC代表阴性对照组,LV-CLDN7代表实验组;*:P<0.05,**:P<0.01,***:P<0.001
3 讨 论
Claudins相关的细胞间黏附调控通透性屏障、细胞旁转运和信号转导,是肿瘤细胞增殖、转化和转移的重要因素[17]。研究表明紧密连接的变化是肿瘤发生的早期事件[14]。Claudin-7表达减少将导致细胞间黏附性破坏,从而促进肿瘤的侵袭和转移。相反,有证据表明在胃癌、胰腺癌和卵巢癌等一些肿瘤类型中Claudin-7表达增加[11-13,18]。Clauidn-7过度表达导致肿瘤进展和侵袭性的机制尚不清楚,可能是Claudin-7的上调可调控相关信号通路影响肿瘤的发生和发展。我们的研究表明Claudin-7在OSCC中低表达。值得注意的是,在OSCC组织中我们观察到Claudin-7阳性表达为细胞膜和细胞质棕色染色,而在癌旁组织中细胞质未显示Claudin-7染色。据报道在卵巢癌和唾液腺样囊性癌中可以发现Claudin-7的点状细胞质染色[18-19]。正常机体中,Claudin-7表达在细胞膜,然而肿瘤中Claudin-7异位表达的机制仍不清楚。并且进一步分析发现Claudin-7低表达与OSCC患者的肿瘤大小、分化程度和淋巴结转移相关。因此,Claudin-7 可能是有前景的OSCC预后生物标志物。
OSCC特点是对局部组织的侵袭程度高,淋巴结转移的发生率高。增殖和转移都是 OSCC 恶性生物学行为的标志[20]。EMT是指上皮细胞失去细胞间相互作用但获得间充质细胞形态和黏附标记的过程,从而能够从原始组织中分离,被认为与肿瘤转移密切相关,在肿瘤的侵袭和进展中发挥重要作用[21]。EMT 伴随着上皮标记分子 E-钙黏蛋白的下调、间充质标记分子 N-钙黏蛋白和波形蛋白的上调,以及snail-1等转录因子的上调[21]。Ji等[19]研究发现Claudin-7沉默后能够显著增强唾液腺样囊性癌的EMT。Wang等[22]研究显示Claudin-7下调可能通过调节EMT来增强结直肠癌的迁移和侵袭能力。有研究表明OSCC中E-钙黏蛋白表达显著降低[15]。然而,OSCC中Claudin-7和EMT 之间的关系却鲜有研究。我们在体外功能实验发现Claudin-7过表达显著抑制了OSCC细胞的增殖、迁移和EMT。因此,Claudin-7在OSCC中发挥抑癌的作用。
本研究表明Claudin-7在OSCC中表达下调,通过体外上调Claudin-7表达可以抑制OSCC细胞的增殖、迁移和上皮间充质转化。本研究为进一步探讨Claudin-7在OSCC 抑癌作用中的相关机制奠定了基础,并为OSCC治疗策略的制定提供了新的思路。

