术前血清白蛋白-碱性磷酸酶比值在胃癌预后评估中的价值
陈智良,费素娟,郭雅慧,房钰
作者单位:徐州医科大学附属医院消化内科,江苏 徐州 221000
胃癌是消化系统最常见的肿瘤之一,是起源于胃黏膜上皮细胞的恶性肿瘤,绝大多数是腺癌。它是第五大最常见的恶性肿瘤,也与癌症相关的死亡的第三大主要原因[1]。由于缺乏胃癌特有的临床症状,通常被诊断为晚期或转移期病人,尽管开发了新的外科手术技术、化学疗法和放射线治疗,但由于预后不良,该病已成为极为致命的疾病[2]。目前,针对转移性胃癌包括化学疗法和靶向治疗。一线治疗的反应率介于27%至54%之间[3-4]。因此,应探索一种简单、低成本的方法来评估胃癌的预后。
已经提出了多种血清标志物来预测胃癌病人的生存,例如,血小板与淋巴细胞之比(PLR)、中性白细胞与淋巴细胞比率(NLR)、纤维蛋白原[5-8]。最近,提出了一种新的标志物白蛋白与碱性磷酸酶比率(AAPR),并据报道与多种恶性肿瘤,包括非小细胞肺癌(NSCLC),乳腺癌和肝细胞癌(HCC)的生存相关[9-11],而在胃癌中尚未充分探讨术前AAPR 的预后价值。因此,本研究旨在探讨术前AAPR 对行胃癌手术病人总生存期的影响。同时比较AAPR 与全身炎症反应的两个代表NLR 与PLR 对于胃癌生存结果的评估价值。
1 资料与方法
1.1 一般资料 回顾性分析于2016 年3 月至2019年12 月在徐州医科大学附属医院普外科实施胃癌根治术的胃腺癌病人396 例,根据病人具体情况,9例在胃癌根治性手术的基础上实行肝转移灶切除术。其中307例行腹腔镜手术,89例行开腹手术;41例行毕罗Ⅰ式,178 例行毕罗Ⅱ式,177 例行Rouxen-Y 式消化道重建。男性291 例,女性105 例。年龄范围为28~86岁,年龄59.9岁。纳入标准:病例资料完整;病人或近亲属知情同意;经胃镜及病理确诊为胃腺癌病人;无合并其他恶性肿瘤;术前未行放疗和化疗;否认吸烟史;手术均R0 切除,D2 根治(手术质量控制:主刀医师均副高职称两年以上,按D2 根治原则实施手术)。排除标准:伴有甲状旁腺功能亢进或减退;伴有胆结石、肝囊肿、肝硬化等肝胆系统疾病合并佝偻病,软骨病等骨骼系统疾病;合并其他恶性肿瘤;术前服用他汀类药物;合并免疫系统疾病;存在血栓疾病史;术前无法进食或进食较差或术前进行肠内或静脉营养支持者;随访结果缺失。本研究符合《世界医学协会赫尔辛基宣言》相关要求。
1.2 血样收集 采集胃癌病人术前1 周内外周静脉血,行血常规、CRP、生化全套、凝血功能等检查,所有项目均在清晨空腹状态抽取。使用全自动生化检测仪器,以及厂家和试剂项目提供的有效参数,采用速率法检测术前血清ALB 及ALP 水平。ALB 正常值为35~50 g/L,ALP 正常值为42~128 U/L。
1.3 方法 AAPR 的计算根据血清白蛋白(ALB)和碱性磷酸酶(ALP)计算AAPR 值,公式为:AAPR=ALB(g/L)/ALP(U/L)。根据术前AAPR 值与病人随访生存状态构建5 年时依性ROC 曲线,选取约登指数最高的临界值作为AAPR 的分组标准,AAPR 的最佳截断值为0.586,将AAPR≥0.586 定义为AAPR升高组,AAPR<0.586定义为AAPR 降低组。胃癌分期参考美国癌症联合会(AJCC)胃癌TNM 分期(2017年第8版)[12]。
1.4 随访 所有病人均获术后随访,随访方式为定期电话、病人门诊复查或上门方式进行随访,记录时间为手术时间至末次随访或死亡的时间。术后3个月开始术后第1次随访,术后2年内每3个月随访1 次,5 年内每6 个月随访1 次。随访项目包括血常规、生化、胸腹盆腔CT、肿瘤标志物和胃镜检查等。随访截止时间为2020年10月31日。
1.5 统计学方法 采用SPSS 22.0 软件进行统计学分析。计数资料以例数和百分数表示,组间比较采用χ2检验;采用Kaplan Meier 法和Log-rank 检验进行单因素分析,将单因素分析中P<0.05 的因素纳入Cox 比例风险回归模型进行多因素分析。采用时间依赖性ROC 曲线比较AAPR、PLR、NLR 以及联合诊断的预后价值。使用R 软件(version 3.6.0)Survival-ROC 包进行时间依赖性ROC 曲线的绘制,同时获得各指标最佳截断值。P<0.05为差异有统计学意义。
2 结果
2.1 最佳截断值 肿瘤长径、白蛋白、碱性磷酸酶、中性粒细胞、淋巴细胞、NLR、PLR、单核细胞、血小板、AAPR 的最佳截断值分别为3.4 cm、42.1 g/L、61 U/L、3.24×109/L、1.6×109/L、1.97、112.73、0.41×109/L、308×109/L、0.586。见表1。

表1 胃癌病人5年生存率下的各指标最佳截断值
2.2 AAPR 与临床病理特征的相关性 AAPR 与胃癌病人的肿瘤浸润程度、淋巴结转移、TNM 分期、神经或脉管侵犯、肿瘤长径、年龄、白蛋白、碱性磷酸酶、中性粒细胞、淋巴细胞、血小板、NLR、PLR、均有关(P<0.05)。结果见表2。
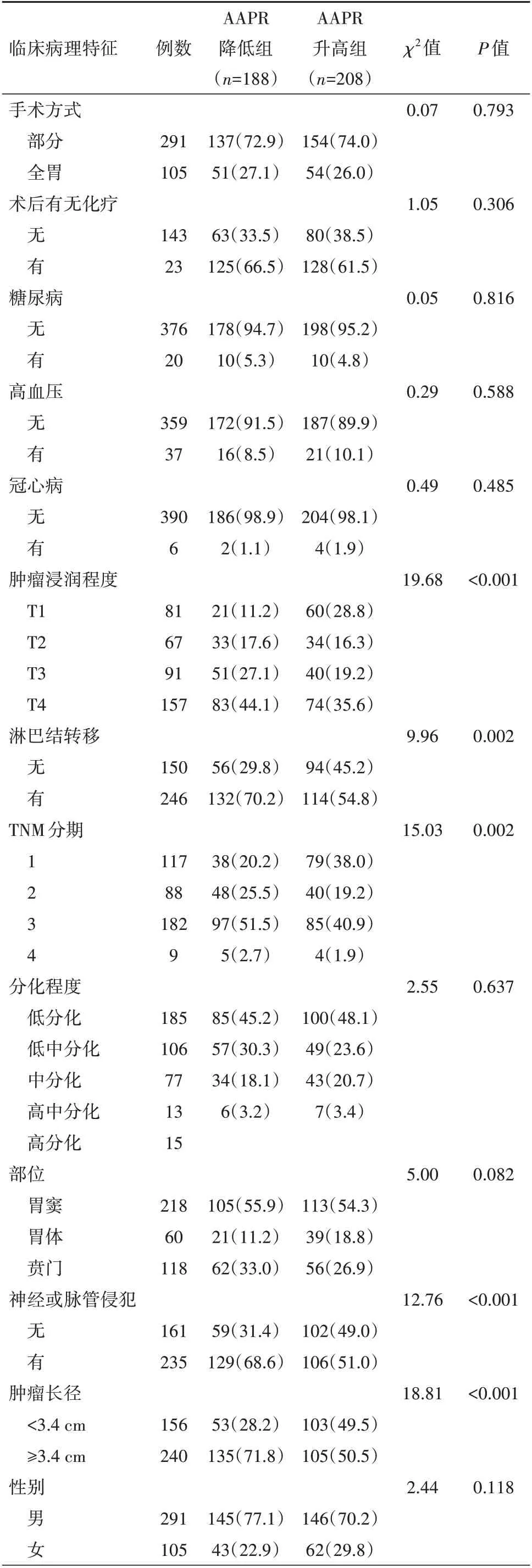
表2 胃癌病人白蛋白与碱性磷酸酶比率(AAPR)与临床病理资料的相关性/例(%)
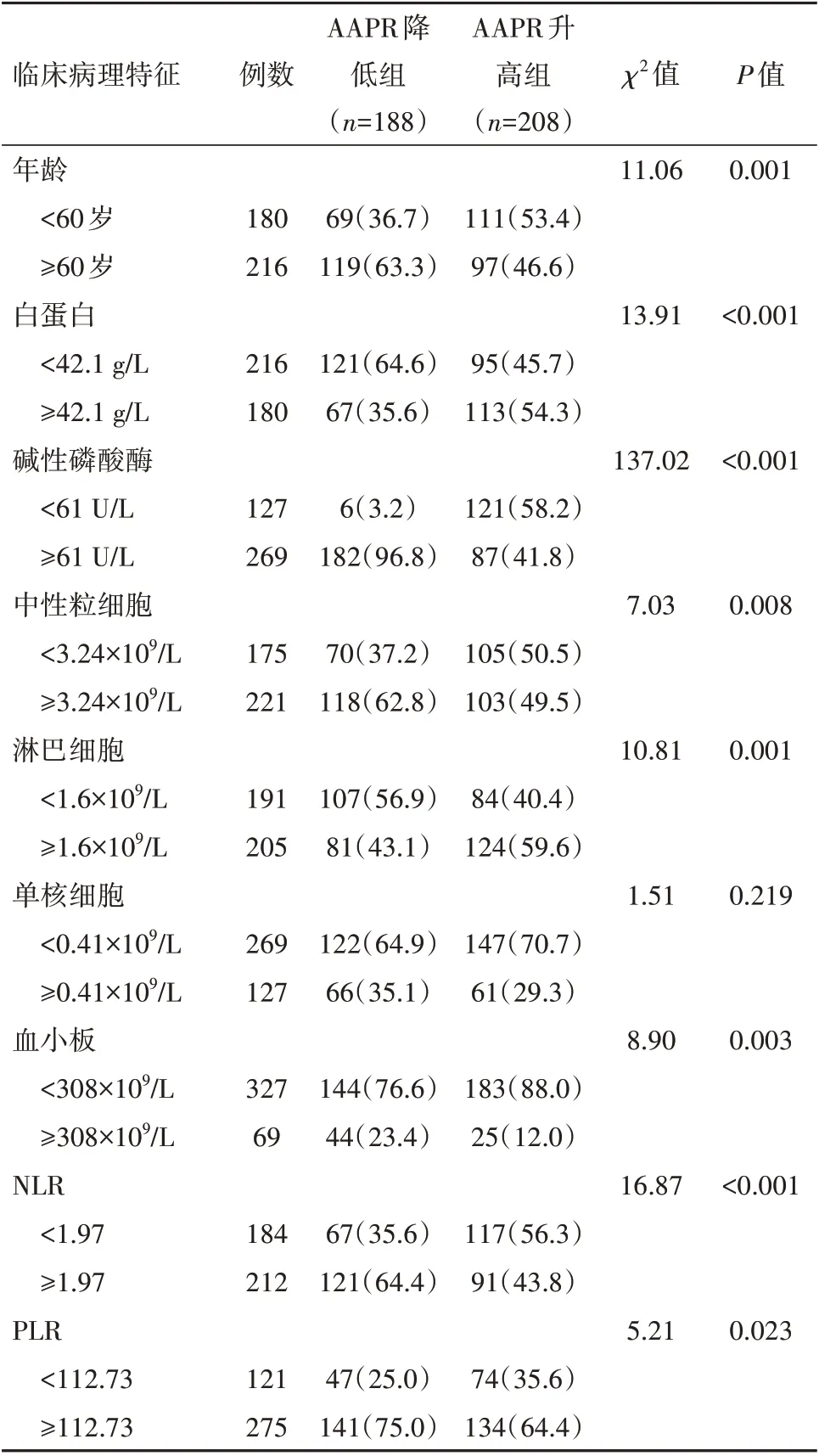
续表2 胃癌病人白蛋白与碱性磷酸酶比率(AAPR)与临床病理资料的相关性/例(%)
2.3 胃癌病人术后生存的单因素和多因素分析单因素分析结果显示,手术方式、术后有无化疗、肿瘤浸润程度、淋巴结有无转移、TNM 分期、神经或脉管有无侵犯、肿瘤长径、年龄、白蛋白、碱性磷酸酶、淋巴细胞、NLR、PLR、血小板、AAPR 的5 年生存率均差异有统计学意义(均P<0.05),结果见表3;将单因素分析中P<0.05 的因素纳入到多因素分析中,多因素分析结果显示术后有无化疗、手术方式、TNM分期、肿瘤浸润程度、PLR、AAPR 均是影响胃癌病人预后生存的独立危险因素(均P<0.05)。结果见表4。AAPR≥0.586 的病人5 年累积生存率高于AAPR<0.586 的病人(86.7%比41.7%),差异有统计学意义(χ2=47.57,P<0.05)。
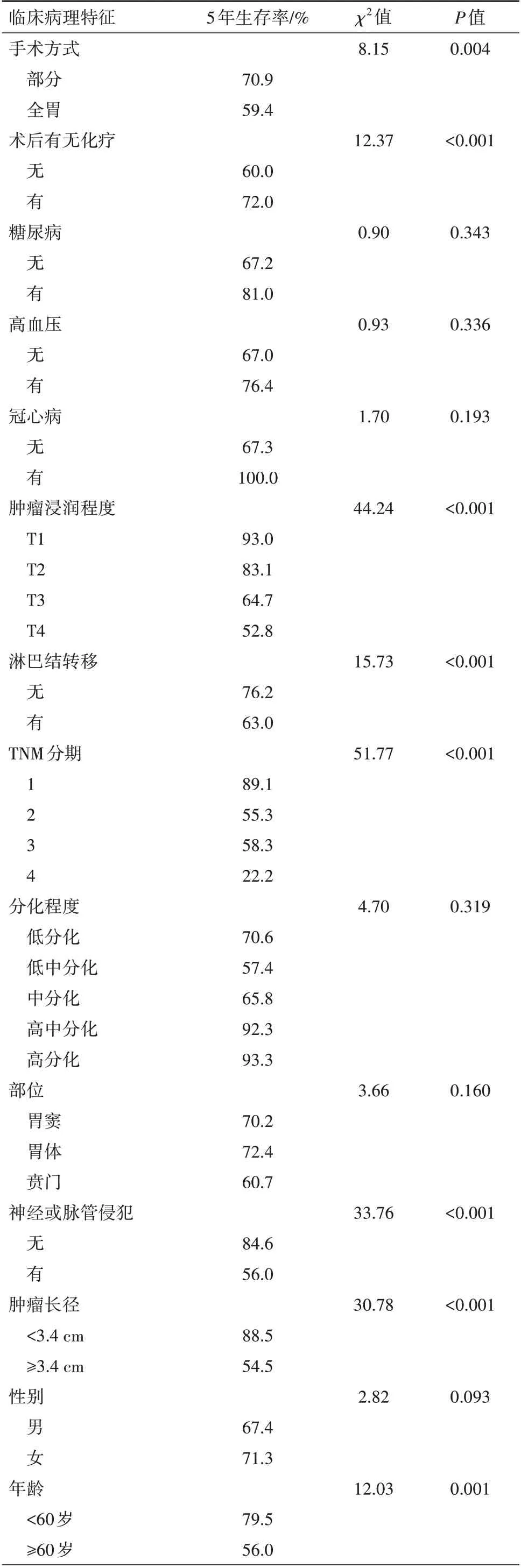
表3 胃癌病人的单因素分析结果

续表3 胃癌病人的单因素分析结果

表4 胃癌病人的多因素分析结果
2.4 AAPR、PLR、NLR 以及联合诊断预测胃癌预后能力的比较 AAPR 预测5 年胃癌病人生存率的AUC 值为0.64,95%CI(0.58,0.69),灵敏度为58.55%,特异度为67.28%;PLR 预测5 年胃癌病人生存率的AUC 值为AUC 值0.58,95%CI(0.53,0.64),灵敏度为76.50%,特异度为40.74%;NLR 预测5 年胃癌病人生存率的AUC 值为0.55,95%CI(0.50,0.61),灵敏度为58.12%,特异度为54.94%;AAPR 预测5 年胃癌病人生存率的AUC 值高于PLR与NLR。将AAPR、PLR、NLR 综合成为联合指标时,联合诊断的AUC 值为0.65,95%CI(0.59,0.70),灵敏度为61.11%,特异度为65.43%。
3 讨论
胃癌是一种侵袭性肿瘤,其生物学特征取决于病人的种族,肿瘤位置,肿瘤类型和遗传状况。目前癌症分期的准确性被认为是治疗癌症的基石,美国癌症联合委员会(AJCC)的肿瘤-淋巴结转移(TNM)分类已经运用在多种肿瘤分期上,肿瘤的预后往往取决于肿瘤的分期。同时手术前的准确分期将对于胃癌的治疗也至关重要,以便实行针对性的治疗及病情的评估。然而通过影像学进行分期常常低估肿瘤转移性风险,加上人们对胃癌异质性生物学了解尚不充分,阻碍了有效治疗方案的发展,病人预后得不到改善。因此越来越多的研究致力于胃癌基础研究。血液学标志物较易获得,同时低成本的血液学标志物会是癌症流行病学领域研究的理想生物标志物。
白蛋白是血浆中最丰富的蛋白质,在肝脏实质细胞合成。白蛋白是一个球型蛋白质,包含585 种氨基酸和三个大小相似的结构域,每个结构域又包含两个亚级结构域。ALB 与全身炎症反应相关,可以用于评估人体的营养状况,同时被发现在维持DNA 复制及促进细胞增殖中起作用[13]。有研究表明,ALB 可以对致癌物可以发挥抗氧化作用,并调节全身和器官或组织特异性免疫反应[14]。一个在大样本的研究中发现,在进行胃肠道手术时,术前白蛋白水平的降低不仅仅是术后易出现心肺疾病、伤口裂开、深静脉血栓等并发症[15-16],低白蛋白提示病人术后远期生存率降低[17]。
碱性磷酸酶(ALP)属磷酸单酯水解酶,是一组特异的磷酸酯酶,主要功能是去磷酸基团。该酶广泛分布于人体多种组织及器官中,主要集中在肝脏,骨骼和肾脏和胎盘中。ALP 如何影响癌症预后机制尚不明确,起初由Kojima 等[18]报道了具有艾氏腹水的小鼠肝脏中ALP 活性有显著变化,表明肝脏ALP 活性升高与癌细胞增殖之间存在联系,后续有研究表明ALP 水平可能与晚期肿瘤状态有关,癌细胞核仁中ALP 具有较高活性,并且ALP 的高活性增加癌细胞的增殖[19]。Ail Aminian 等[20]报道了术前食管癌病人中ALP 水平的升高提示可能出现淋巴结转移,因此ALP 水平可能是肿瘤增殖的敏感指标。国内外多项研究揭示了血清ALP 水平的高低可以作为前列腺癌[21]、食管癌[22]、胰腺癌[23]、乳腺癌[24]等多种恶性肿瘤独立预测生存水平因子。同样在胃癌方面,监测血清ALP 可以评估术前胃癌病人复发风险[25],较高的ALP 值预示胃癌病人整体生存率降低。
因此,ALB 和ALP 在肿瘤进展中起重要作用。而来自ALB和ALP的AAPR可能会扩大这些分子的预后价值,特别是通过反映低ALB 水平和高ALP 水平的不利影响。首先由Anthony 等[10]报道首先提出AAPR是HCC病人独立的预后因素。而后有研究表明在已转移的鼻咽癌病人中较低的AAPR 值提示病人免疫力低下及可能合并有骨转移及肝转移[27],在上尿路上皮癌(UTUC)病人中,AAPR 值可以作为危险因素分层因子,指导后续治疗方案[28]。根据ALB和ALP 计算得出的AAPR 可能反映癌症病人的营养状况和免疫反应,从而可以预测癌症病人的生存率。AAPR 是一种低成本,无创且易于获得的方法,可对病人进行分层并有利于病人的治疗。低AAPR与生存期差有关,因此低AAPR 的病人可能需改善营养状况并接受相关治疗。此外,对于这些病人,可以提供辅助治疗和更持久的随访。
本研究的不足:(1)本研究是回顾性的,可能导致选择偏见。(2)本研究从一个中心提取数据,样本量相对较少。AAPR 的最佳临界值仍然需要验证。因此,有必要进行大规模的多中心研究。(3)本研究以术前AAPR 为中心,但是没有评估AAPR 的动态变化。最后,今后需要更多的基础研究进一步探讨癌症病人生存之间AAPR的确切机制。

