高效离子液体催化剂合成及其在多组分串联反应中的应用
李若璞,徐一泽,王政林,徐大振
南开大学化学学院,天津 300071
当前,生态文明建设已纳入国家重大战略。在“十四五”规划中已明确要推动形成绿色发展方式和生活方式的指导方针。本科教学实验也要与时俱进,以国家战略为指导改进实验内容。实施“源头减排”的绿色化学是解决环境问题、支持生态文明建设最好的途径。绿色化学反应最重要的原则之一就是使用无毒可循环使用的催化体系实现反应的高效转化。而离子液体作为重要的绿色溶剂之一,在许多化学和生物化学转化中得到了广泛的应用[1,2]。许多功能性离子液体也被合成并用作各种反应的催化剂,如Henry反应[3]、羟醛缩合反应[4,5]、Mannich反应[6]、Michael加成反应[7,8]和Knoevenagel缩合反应[9,10]。
另一方面,多组分反应是有机合成和药物化学中最重要的反应之一,因为它们可以广泛用于构建各种复杂有机分子骨架[11]。多组分反应提供了一种通过单一合成操作生成多个新键的有效方法,该方法无需复杂的纯化步骤,并且能够以较高收率从廉价易得的原料中得到高度官能化的化合物,这是高效构建具有此类结构骨架化合物的有效方法。
本团队所在课题组的指导教师近几年致力于高校科研反哺教学的探索与实践工作,在2016-2019年,以离子液体催化的多组分反应为研究课题,指导本科生进行课外创新实验,共发表本科生作为第一作者的SCI国际英文研究论文14篇,在培养拔尖本科学生的同时,还为多种重要化合物的合成提供了高效、绿色的方法。在本实验中,我们选择了其中具有代表性的季铵盐催化剂和有机中间体进行合成,最终合成的是高频出现在天然产物[14]、颜料、荧光标记物和光致变色材料中[15]的2-氨基-4H-吡喃杂环骨架结构化合物。含有这类杂环结构骨架的化合物常常表现出广泛的生物和药理学活性,如抗癌[16],抗氧化[17],抗炎[18],抗微生物[19]和抗高血糖等[20]。图1中列出了两个具有代表性的含有2-氨基-4H-吡喃结构的化合物。在本实验中,我们将新概念(离子液体催化)、新方法(多组分反应)引入到大学基础有机实验课程中,并且合成了具有重要生物活性和用途的2-氨基-4H吡喃类化合物,不但有利于学生学习先进的知识和技术,切身体会化学的用途和魅力,还能鼓励更多的同学参与到课外科研创新的工作中,为“拔尖2.0”和“强基”计划添砖加瓦。这对于早期培养学生学习化学的热情、激发探索精神是非常重要的。

图1 代表性2-氨基-4H-吡喃衍生物
1 实验目的
(1) 将“离子液体”和“多组分反应”两个概念引入到本科实验教学中,让学生接受新的知识,让学生实验与时俱进。
(2) 践行科教融合、理论联系实际,实验所得产物具有抗菌和抗癌的药效,可提供给相关药企进行进一步加工使用,实现了从科研到教学再到应用的完整体系。
(3) 采用催化剂循环体系,减少原料的使用和废弃物的污染,通过源头减排的方式,引领学生深入了解“绿色化学”的概念,实现绿色环保的化学实验。
2 实验原理
催化剂的合成:季铵盐离子液体催化剂IL-1的合成可通过酸碱中和方法合成;催化剂IL-2是通过对叔胺的烷基化实现合成的(图2)。

图2 催化剂的合成反应式
4H-吡喃衍生物A和B的合成:这两个化合物都是通过一锅的三组分Knoevenagel-Michael串联反应来合成的。首先发生羰基和亚甲基之间的Knoevenagel脱水反应,然后双甲酮对新生成的双键进行第一次Michael加成,中间体烯醇化后,羟基对氰基再进行氧杂Michael加成,然后在发生分子内的氢转移得到目标化合物(图3、4)。

图3 4H-吡喃衍生物A的合成反应式(实验1)

图4 4H-吡喃衍生物B的合成反应式(实验2)
3 实验仪器与材料
3.1 实验试剂及材料
4-溴苯甲醛,丙二腈,5,5-二甲基-1,3-环己二酮,六水合三乙烯二胺,溴丁烷等试剂均购于安耐吉化学(Energy Chemical);吲哚-2,3-二酮购于希恩思(HEOWNS);乙醇,乙酸,乙酸乙酯等均购于天津市化学试剂六厂;试剂均为分析纯,未进行纯化直接使用。薄层色谱使用GF254薄层层析硅胶版进行检测,通过抽滤、重结晶对产物进行分离纯化。
3.2 实验仪器和表征方法
智能电磁搅拌加热器(巩义市予华仪器责任有限公司),循环水式真空泵(巩义市予华仪器责任有限公司),低温冷却液循环泵(巩义市予华仪器责任有限公司),旋转蒸发器(天津科诺仪器设备有限公司),ZF-20D暗箱式紫外分析仪(天津科诺仪器设备有限公司),400 MHz核磁共振波谱仪(400 NMR spectrometer)。核磁样品均使用氘代二甲基亚砜溶解,纯度为99.8%。
4 实验仪器与材料步骤
4.1 催化剂IL-1的制备
在100 mL圆底烧瓶中加入六水合三乙烯二胺(4.40 g,20 mmol)和40 mL乙酸乙酯,搅拌助溶。若固体不能完全溶解,可继续补加乙酸乙酯直至固体完全溶解(每次补加2 mL),得到无色透明溶液。室温下,向溶液中缓慢滴加乙酸(1.20 g,20 mmol),溶液中有微弱的放热现象。搅拌,约1.5 h后反应完全。蒸馏除去乙酸乙酯,得白色固体催化剂。
4.2 催化剂IL-2的制备
在100 mL圆底烧瓶中加入六水合三乙烯二胺(4.40 g,20 mmol)和30 mL乙酸乙酯,加热至60 °C完全溶解,得到无色透明溶液。恒温条件下向溶液中继续加入溴丁烷(2.74 g,20 mmol),溶液缓慢由透明无色变为乳白色溶液,反应约1.5 h后,能够观察到反应体系中出现明显的分层,并且上层为无色,下层略显黄色,停止加热,静置、自然降至室温后,冰水浴,待乙酸乙酯层变清澈、下层变为白色蜡状膏体后,直接倾出上层乙酸乙酯清液,然后再加入5 mL乙酸乙酯,猛烈搅拌后,置于冰水浴中静置,倾出上层乙酸乙酯,再重复一次以上操作,减压下除去剩余少量乙酸乙酯,得到催化剂。
4.3 4H-吡喃衍生物A的合成
在25 mL圆底烧瓶中依次加入4-溴苯甲醛(925.0 mg,5.00 mmol),丙二腈(363.5 mg,5.50 mmol),5,5-二甲基-1,3-环己二酮(736.0 mg,5.25 mmol)和7.5 mL乙醇。搅拌20 min,直至固体全部溶解,溶液呈无色透明。向溶液中加入催化剂[Dabco-H]OAc (86.0 mg,0.50 mmol),搅拌,溶液逐渐变为白色浑浊。搅拌15 min后,静置,溶液析出大量白色固体。待固体完全析出后,抽滤,用0 °C乙醇洗涤(5 mL × 2),收集白色滤饼,将产品放入红外干燥箱中,干燥至恒重,得到纯产品,记录产品质量,计算产品收率,烘干后的产品可直接用于核磁性质测试。
为验证实验中催化剂和溶剂的循环套用能力,将抽滤后的滤液直接用于下一个相同反应的催化。将滤液转移至25 mL圆底烧瓶中,依次加入与第一次反应相同量的原料,记录反应时间。反应结束后按照第一次操作进行后处理,计算产品产率。催化体系的循环利用实验可操作五次。
4.4 4H-吡喃衍生物B的合成
在25 mL圆底烧瓶中依次加入吲哚-2,3-二酮(735.5 mg,5.00 mmol),5,5-二甲基-1,3-环己二酮(736.0 mg,5.25 mmol),丙二腈(363.5 mg,5.50 mmol)和10 mL乙醇-水溶液(体积比1 : 1),搅拌使固体均匀分散在溶液中,体系呈砖红色。然后向加入催化剂[Dabco-H]OAc (86.0 mg,0.50 mmol),搅拌,砖红色反应体系颜色略加深为深红,再逐渐变浅为淡黄色浊液。继续搅拌20 min,等固体不再增加后,静置,抽滤,用冷的乙醇-水溶液(体积比1 : 10)洗涤(5 mL × 2)。收集白色滤饼,将产品放入红外干燥箱中,干燥至恒重,得到纯产品,记录产品质量,计算产品收率,烘干后的产品可直接用于核磁性质测试。
5 结果与讨论
5.1 催化剂IL-1的制备
向六水合三乙烯二胺的乙酸乙酯溶液中滴加乙酸时,溶液中有微弱放热。反应结束后蒸馏除去溶剂,得到的催化剂为白色固体,熔点约为80 °C,反应为定量反应,分离产率可达98%。
5.2 催化剂IL-2的制备
向无色透明的三乙烯二胺-乙酸乙酯溶液中加入溴丁烷后,溶液缓慢由透明无色变为乳白色。继续恒温反应,乳白色乙酸乙酯层下方出现淡黄色清液。反应约1.5 h后能够观察到明显分层,且乙酸乙酯层逐渐转变为无色透明。反应结束时,乙酸乙酯层变为澄清透明。
冷水浴降温后,原乙酸乙酯层下方的淡黄色清液变为白色蜡状膏体。倒出澄清透明的乙酸乙酯层,再向烧瓶内加入少量乙酸乙酯,加热至60 °C混匀。再次冷却倒出乙酸乙酯层,将剩余蜡状物旋干即可得到白色固体产物,分离产率可达90%。所得产品的熔程为48-51 °C。
5.3 4H-吡喃衍生物A的合成
随着反应进行,体系中产生大量白色沉淀。如图5(a)为反应开始前的体系,(b)为反应结束后的体系。
反应搅拌15 min后用薄层层析(TLC)检测反应,以对溴苯甲醛为对比,检测原料的消失,判断反应进程。如图5(c)为用二氯甲烷和乙醇(V:V= 25 : 1)作为展开剂的层析板,层析板左侧为原料对溴苯甲醛,中间为原料双甲酮,右侧为反应体系。层析发现原料对溴苯甲醛消失后,停止反应。

图5 反应前后的对比和检测
为验证实验所用催化剂在该反应中的重复使用性能,使用同一反应液进行5次重复实验。记录反应时间随反应次数变化如图6,计算反应产率随反应次数变化如图7。

图6 实验1反应时间随反应次数变化折线图

图7 实验1产率-反应次数分布柱形图
推测反应时间随反应次数的增加而延长的可能原因:每次反应结束后抽滤转移液体时,部分溶液残留导致体系内催化剂损失,使反应时间延长。
取第一次反应的粗产品,用无水甲醇进行重结晶。得到产品1.68 g。该反应的理论产量为1.87 g,计算可得重结晶后产率为89.84%。
实验所得产品为白色固体,熔程为199-201 °C。具有吸湿性,在空气中放置一段时间后质量增加。产品易溶于二甲基亚砜和甲醇,不易溶于水,水溶性约为10 mg/1 mL水。不溶于乙酸乙酯和乙醇。
对烘干后的产品进行核磁共振氢谱和碳谱测试,数据如下:
(a):1H NMR (400 MHz, DMSO-d6):δ0.95 (s, 3H, CH3),1.03 (s, 3H, CH3),2.08-2.27 (m, 2H, CH2),2.46-2.57 (m, 2H, CH2),4.18 (s, 1H, ArH),7.09-7.11 (m, 2H, ArH),7.13 (s, 2H, NH2),7.49 (d, 2H,J= 8.0 Hz, ArH);图8为产品的1H NMR谱图。

图8 实验1产品的1H NMR谱图
(b):13C NMR (100 MHz, DMSO-d6):δ27.3, 28.8, 32.3, 35.7, 40.1, 50.4, 58.1, 112.7, 120.0, 120.1, 130.0, 131.7, 144.7, 158.9, 163.1, 196.2。
可以看出,重结晶后产品的核磁图与文献数值一致,表明产品具有良好的纯度。
5.4 4H-吡喃衍生物B的合成
随着反应进行,砖红色反应体系颜色略加深为深红,再逐渐变浅为淡黄色浊液。图9(a)为反应开始前的体系,(b)为反应结束后的体系。

图9 反应前后的对比和检测
搅拌15 min后用薄层层析检测反应,以原料吲哚-2,3-二酮为对比,检测原料的消失,判断反应进程。如图9(c)为用二氯甲烷和甲醇(V:V= 20 : 1)作为展开剂的层析板。层析板左侧为原料吲哚-2,3-二酮,中间为原料双甲酮,右侧为反应体系。层析发现原料吲哚-2,3-二酮消失后,停止反应。
为验证实验所用催化剂在该反应中的重复使用性能,我们对衍生物B进行了同样的循环实验,实验结果显示循环套用产率依然稳定。同时,多次重复实验的成功也说明本实验的可靠性高,实验稳定性和重现性好。
实验所得产物为淡黄色固体,熔点≥ 300 °C。产物易溶于二甲基亚砜,微溶于甲醇,不溶于水,也不溶于乙醇、乙酸乙酯和二氯甲烷。
对烘干后的产品进行核磁共振氢谱和碳谱测试,数据如下:
(a):1H NMR (400MHz, DMSO-d6):δ0.99 (s, 3H, Me),1.03 (s, 3H, Me),2.06-2.19 (m, 2H, CH2),2.55-2.60 (m, 2H, CH2),6.78 (d, 1H,J= 7.6 Hz, ArH),6.88 (t, 1H,J= 7.6 Hz, ArH),6.97 (d, 1H,J= 6.8 Hz, ArH),7.13 (t, 1H,J= 7.6 Hz, ArH),7.23 (s, 2H, NH2),10.40 (s, 1H, NH);图10为产品的1H NMR谱图。
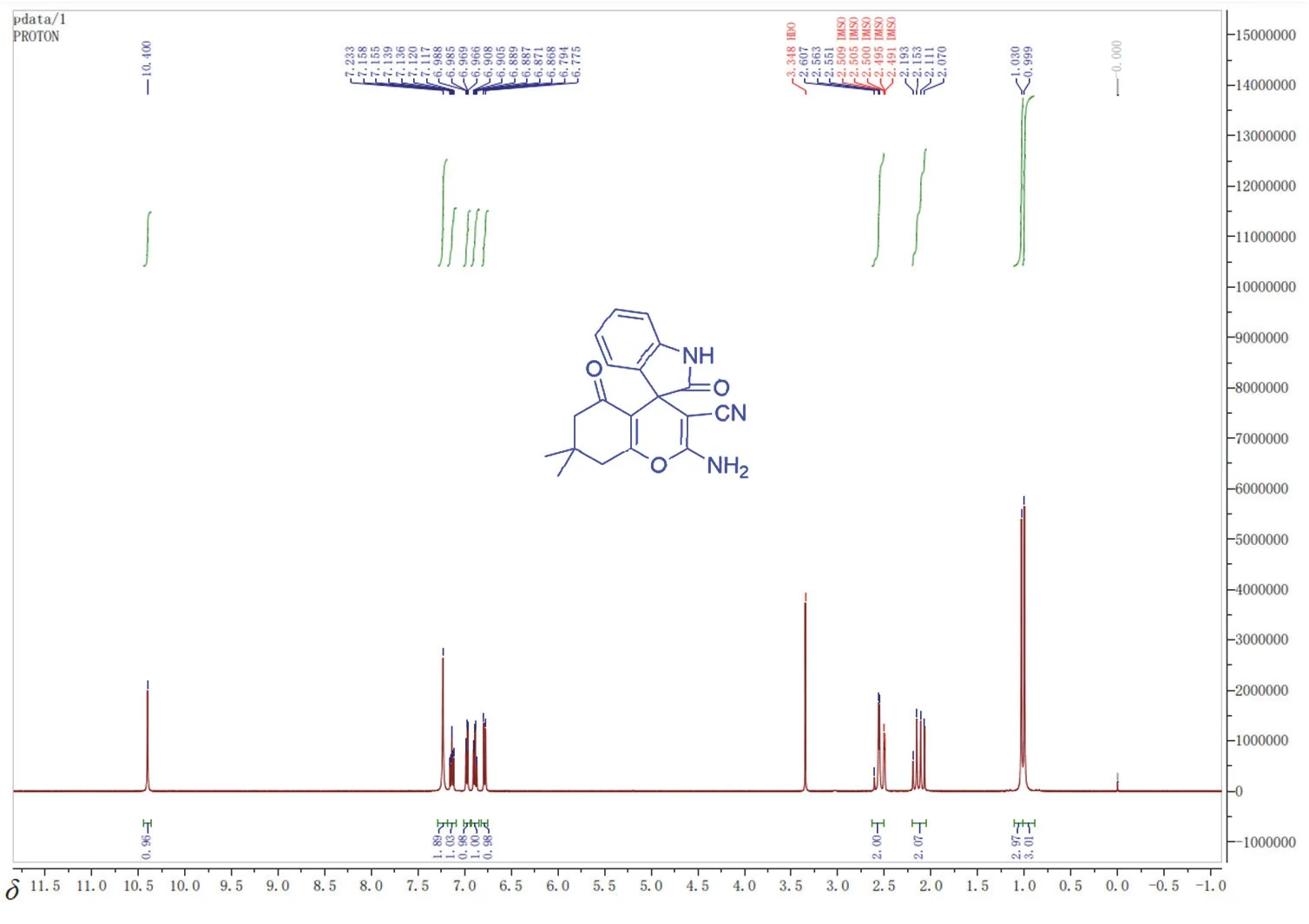
图10 实验2产品的1H NMR谱图
(b):13C NMR (100MHz, DMSO-d6):δ27.4,28.0,32.4,47.2,50.4,57.9,109.7,111.2,117.8,122.1,123.4,128.6,134.8,142.5,159.2,164.6,178.4,195.3。
可以看出,纯化后产品的核磁图与文献数值一致,表明产品具有良好的纯度。
6 结语
本实验践行科教融合、理论联系实际,实现了从科研到教学再到应用的完整体系。通过科研反哺教学,将“离子液体”和“多组分反应”两个概念引入到本科实验教学中,让学生学习了之前从未出现在本科实验教学中的新概念。通过离子液体催化两个三组分Knoevenagel-Michael串联反应,合成两类重要的4H-吡喃类化合物,分离产率高、重现性好,而且反应过程中现象变化明显(反应1:生成白色沉淀;反应2:体系由红色变成乳黄色),易于观察和检测,激发了学生的学习兴趣。并且本实验将理论联系实际,所得功能性产物可进一步用于生产。另外,催化体系可以多次回收循环套用,减少了浪费,有助于学生建立绿色化学的理念,让学生能够通过实验发现化学之美,通过实验了解化学在生产和生活中的用途,激发大家学习化学的兴趣,让学生爱上化学。实验的可推广性也很强,可根据高校实验条件进行实验课时及内容的调整,是适合引入当前大学实验教学课程的经典案例。

