“两性一度”教学要求下的物理化学综合实验教学探索
——以无表面活性剂微乳的构筑及应用为例
张永民,樊晔,刘雪锋,胡学一,方云
江南大学化学与材料工程学院,江苏 无锡 214122
在国家全面实施一流本科专业、一流本科课程“双万计划”的背景下,如何实现物理化学实验课程的“两性一度”,更好地支撑我校物理化学一流课程的建设与发展,正面临新的机遇和挑战。
物理化学一向被认为是一门“教师难教,学生难学”的课程,具有公式推导多且适用条件严格、概念抽象、理论难于理解的特点。为了帮助学生更好地掌握这一课程,夯实理论基础,提高科研能力,物理化学实验是必不可少的。然而,常规的实验教学设计多局限于单个知识点的应用,较少涉及多个知识点的综合运用;教学内容的更新滞后于科学发展,新技术、新知识融入较慢;教学过程重操作轻设计,重验证轻拓展。上述问题的存在造成了学生理论与实际联系不足、创新意识不强、主观能动性不高、综合实践能力欠缺的现象[1,2]。因此,为了充分激发学生的主观能动性,培养学生的创新意识和创新能力,使其成为建设创新型国家的合格一分子[3,4],迫切需要把一些物理化学的前沿研究巧妙地融入实验教学,通过与理论知识的有机融合展现给本科生。
微乳液是一种均匀透明、光学各向同性和热力学稳定的胶体分散体系[5],其分散质点尺寸一般在1-100 nm之间。自问世以来,微乳液便因其纳米液滴的小尺寸效应和限域作用,被广泛用于纳米颗粒制备、药物输送等领域[5,6]。
传统微乳液通常需要高浓度的表面活性剂(> 10% (w),质量分数)来乳化液滴,并辅以助表面活性剂降低界面张力,从而稳定巨大的油/水界面。这类体系被称为表面活性剂基微乳(Surfactant-Based Microemulsion,SBME)。大量表面活性剂的使用不仅带来高成本,而且也导致了潜在的环境安全隐患[7],严重制约了微乳技术的可持续性发展。更为严重的是,基于SBME制备的纳米颗粒往往会因表面活性剂(特别是阳离子表面活性剂)的吸附,对纳米材料的性能产生不可忽视的影响[8]。Smith等[9]发现两种不混溶的液体在一定配比的两亲性溶剂存在下可自发形成热力学稳定的分散体系,即无表面活性剂微乳液(Surfactant-Free Microemulsion,SFME)。这为上述问题提供了一种全新的解决方案,且可避免表面活性剂带来的成本和环境问题[10]。
在此,我们以SFME这一物理化学前沿研究为抓手,通过“SFME的构筑-Ag纳米颗粒(AgNPs)制备-催化活性评价”将物理化学中的相平衡、胶体化学、界面化学和动力学等知识有机串联,设计了一个新的物理化学综合实验。
1 SFME的构筑及胶体性能评价
1.1 实验原理
SFME是由两种不混溶的液体和一种两亲性溶剂所形成的均匀透明、热力学稳定的纳米分散体系,如图1中的单相区。根据连续相和分散相的不同,SFME可进一步划分为水包油(O/W)、油包水(W/O)和双连续(B.C.)三种类型。SFME的形成主要有两种解释[11]。一方面,SFME的形成与各组分之间的氢键作用密切相关。基于氢键作用,两亲性溶剂可分别与水相和油相互溶,但主要吸附于油水两相的界面区,具有类似SBME中表面活性剂的作用,可降低油水界面张力。另一方面,SFME的形成是水化力和混合熵之间相互平衡的结果。

图1 油、水和两亲性溶剂构筑的三元相图
1.2 水-乙醇-乙酸乙酯SFME的构筑及Tyndall现象观察
在干燥的玻璃试管中按照一定的质量比(建议比例:0 : 10、2 : 8、4 : 6、5 : 5、6 : 4、8 : 2和10 : 0)依次加入乙酸乙酯和水。25 °C超级恒温槽中恒温5 min后,在磁力搅拌下缓慢滴加乙醇,记录体系发生相转变(由浑浊变澄清)时乙醇的质量。重复此步骤三次,计算各组分的质量分数,即为三元相图中的一个坐标点。用平滑的曲线将相转变点连接起来即可构成单相区与多相区的分界线,得到水-乙醇-乙酸乙酯三元相图(图2A)。与已有报道的SFME相似[12],水-乙醇-乙酸乙酯三元相图也可简单分为两个区域:单相区和多相区。
沿着图2A中所示路径配制一系列不同乙醇含量的样品a、b、c、d、e。将激光从样品瓶一侧或底部射入,在入射光的垂直方向上观察到了不同的Tyndall现象(图2B):越靠近两相分界线,样品的Tyndall现象越明显;反之,则越弱。当乙醇含量超过50% (w)后,则几乎观察不到Tyndall现象。这说明在单相区中有纳米聚集体存在,从而导致了光的散射,证实了微乳液的形成。但是,这种Tyndall现象在高乙醇含量时则完全消失,即纳米聚集体的瓦解,此时体系为真溶液,而非纳米分散体系。简言之,水-乙醇-乙酸乙酯三元相图的单相区包括含有纳米液滴的微乳区和真溶液区。

图2 水-乙醇-乙酸乙酯的三元相图(A)和样品的Tyndall现象照片(B)
在教学过程中可根据时间和小组分工的变化,对微乳区的完整绘制作进一步要求,也可要求学生探索Tyndall现象沿不同路径的变化。即可加深印象、巩固知识,也可拓展发散思维。
1.3 微区划分
以对微环境极性敏感的甲基橙(MO)作为探针对三元相图中的单相区进行微区划分[13]。固定乙酸乙酯与乙醇的质量比,配制一系列水相质量分数(fw)不等的SFME样品,控制水相中MO浓度为0.096 mmol·L-1。利用紫外-可见分光光度仪(UV-Vis)测定样品中MO的最大吸收波长(λmax),然后绘制λmax随fw的变化曲线。如图3A所示,随含水量(fw)的增大,λmax发生了红移,表明MO所处环境极性增大。根据λmax随fw的变化可将SFME划分为W/O、B.C.和O/W三种微观结构(图3B),得到一组转折点。即随着fw增大,SFME从W/O依次向B.C.和O/W发生转变。改变乙酸乙酯/乙醇质量比,重复实验,可获得其他几组转折点。将相同转变的转折点相连,即可得到三个微区的分界线。
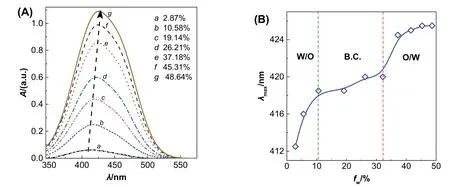
图3 含水量fw对MO紫外-可见吸收光谱(A)和λmax (B)的影响
考虑到时间和后续实验的需要,每一组同学可自行选择三个乙酸乙酯/乙醇质量比进行微区划分。
2 AgNPs颗粒的制备及表征
在W/O微区选择配方作为纳米反应器用于制备AgNPs。分别用5 mmol·L-1AgNO3和50 mmol·L-1NaBH4水溶液代替微乳配方中的水,获得含AgNO3微乳(AgNO3-SFME)和含NaBH4微乳(NaBH4-SFME)。观察发现样品依然保持透明和光学各向同性,且Tyndall现象明显(图4A),说明AgNO3或NaBH4的引入并未破坏SFME中的纳米聚集体。
搅拌下将2 mL NaBH4-SFME缓慢滴入2 mL AgNO3-SFME,样品逐渐由无色变成淡黄色或黄褐色,即AgNPs形成。继续搅拌1 h后,获得含有AgNPs的SFME (2.5 mmol·L-1)。为了获得较小的纳米颗粒,应快搅拌慢滴加。
通过TEM观察发现AgNPs-SFME均匀地排布在铜网上,没有明显团聚现象发生(图4B)。对约150个粒子进行粒径统计分析,得到AgNPs-SFME的平均粒径约2.36 ± 0.13 nm,分布较窄。
XRD谱图(图4C)显示了单质银[111]、[200]、[220]和[311]面的特征衍射峰,没有其他杂质银的衍射峰被发现,即AgNPs-SFME属于纯度很高的单质银结晶。

图4 AgNO3-SFME和NaBH4-SFME样品的Tyndall现象照片(A);AgNPs-SFME的TEM照片(B)和XRD谱图(C)
在实际教学中,可根据情况选择一种或两种技术对AgNPs进行表征。即使无法对AgNPs-SFME进行表征,也不会影响后续实验。
此外,AgNPs也可通过简单的直接沉淀法制备。但是,由于缺少微乳液滴的模板效应,颗粒尺寸和形貌通常难以得到较好的控制。教学过程中可以鼓励学生自主开展相关实验,对比两种方法所制备的AgNPs。
3 AgNPs催化4-硝基苯酚还原反应的动力学
3.1 实验原理
贵金属纳米粒子因高的比表面积以及表面原子特异的化学性质而表现出较高的催化活性。研究表明AgNPs可催化4-硝基苯酚还原为4-胺基苯酚(图5)[14]。

图5 4-硝基苯酚的还原反应
碱性条件下,4-硝基苯酚在400 nm左右具有典型的UV-Vis特征吸收峰,而还原产物4-胺基苯酚的λmax则在300 nm附近,两者互不干扰。根据Lambert-Beer定律:
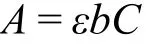
其中A为吸光度,ε为摩尔吸光系数,b为吸收池厚度,C为吸光物质的浓度,A与C成正比关系。因此,可以通过UV-Vis法对AgNPs催化还原4-硝基苯酚反应的动力学过程进行实时监测。
3.2 4-硝基苯酚的标准曲线
为了对反应过程中反应物浓度进行定量,需要先建立4-硝基苯酚的标准曲线。如图6所示,在实验浓度范围内,4-硝基苯酚的浓度-吸光度显示出优异的线性关系:y= 0.01866x- 0.01902,R2= 0.9967。

图6 4-硝基苯酚的浓度-吸光度标准曲线
3.3 反应动力学
将15 μL AgNPs-SFME分散液和4 mL 4-硝基苯酚溶液(0.1 mmol·L-1)混合于比色皿中,超声振荡30 s后,加入25 μL NaBH4水溶液(0.5 mol·L-1),超声振荡,并开始计时。为了避免AgNPs的紫外吸收所带来的干扰,体系中AgNPs的浓度控制在0.01 mmol·L-1以下。
宏观上,随着NaBH4的加入,4-硝基苯酚和NaBH4混合体系的颜色逐渐由黄色或淡黄色变为无色。通过对样品的UV-Vis光谱扫描,可以发现4-硝基苯酚在400 nm处的特征吸收随着AgNPs-SFME的加入迅速降低,并在35 min后达到最小(图7A)。根据标准曲线计算4-硝基苯酚的浓度,从而可以建立反应物浓度随时间的变化。如图7C所示,ln[4-硝基苯酚]与反应时间呈明显的线性关系,符合一级反应动力学特征。根据线性拟合的结果可知,以AgNPs-SFME为催化剂的反应速率常数是0.0916 min-1。
为了更好地了解界面吸附的影响,我们提供了基于SBME (16.65% (w)十六烷基三甲基溴化铵、33.16% (w)正丁醇、25.22% (w)乙酸乙酯,其余为水)制备的AgNPs-SBME分散液(2.5 mmol·L-1),平均粒径2.0 ± 0.11 nm。相比之下,加入相同量AgNPs-SBME后,4-硝基苯酚的特征吸收下降较慢,100 min后才降至最小(图7B),以AgNPs-SBME作催化剂的反应速率常数约为0.0309 min-1(图7C)。

图7 4-硝基苯酚紫外-可见吸收光谱随时间的变化(A,B)和4-硝基苯酚浓度与反应时间的关系(C)
无论是直观的吸光度变化,还是拟合得到的反应速率常数,均表明AgNPs-SFME的催化活性较高,而AgNPs-SBME的催化活性略低。这主要归因于表面活性剂在AgNPs-SBME上吸附所致。
在这一环节,可鼓励学生对由不同方法获得的AgNPs的催化活性进行分析、思考,并设计简单的实验进行验证(例如:对AgNPs-SBME离心洗涤后再评价催化活性)。若时间允许,或采取分组方式,在实际教学中可平行安排SFME和SBME的构筑及AgNPs的制备,进行组间对比。当然,也可以加入直接沉淀制备的AgNPs进行对比实验。同时,也可安排学生考查不同温度下的反应动力学,进而获得不同AgNPs催化下反应活化能。
4 可行性分析
(1) 硬件可行性。本实验所需的试剂均是化学实验中常用试剂,廉价易得、安全隐患小、易于管理。所需仪器也较为常见,多数高校都有配置。至于TEM和XRD两种大型仪器即使没有配置,也不影响实验的顺利开展。
(2) 内容可行性。本实验所涉及的内容属于物理化学课程的核心内容,是教学大纲中要求学生熟练掌握的部分。虽然三元相图部分高校不做要求,但本实验的相图属于较为简单的一类。即使没有学习,也可根据二元相图的知识进行理解。
(3) 时间可行性。本实验可按照3-5天进行安排。根据时间长短,可自主增减相应内容,具有较高的灵活性。
(4) 满足两性一度要求。要完成上述实验,学生不仅需要具备扎实的理论知识基础,而且要能够对相图、胶体、界面、动力学和催化等多个物理化学理论进行灵活的综合运用,并且需要具备从现象提出问题,做出判断,进而设计实验进行验证的能力。完全达到了高等教育的两性一度要求。
5 实验开设建议
(1) 施教对象:本实验面向化学化工类专业本科高年级学生开设,最佳施教对象应为修完物理化学等基础化学课程的大二或大三学生,可作为化学化工类专业基础化学综合实验教学内容。
(2) 时间安排:本实验综合性较强,经验证一个实验流程大约需要3-5个教学工作日。因此,建议在短学期的综合实践环节开展,时长1周。
(3) 人员安排:按照一个实验教学班28-32人计,可分成14-16组,每组2人。
(4) 实验内容:主要实验内容包括,① 水-乙醇-乙酸乙酯SFME的构筑及Tyndall现象观察(1天);② 微区划分(0.5天);③ SFME模板法制备AgNPs及表征(1天);④ AgNPs催化4-硝基苯酚还原反应的动力学(1天);⑤ 4-硝基苯酚的标准曲线(0.5天);⑥ 其他方法制备AgNPs (1天);⑦ 活化能(0.5天)。其中①-④为每组学生必须完成项,⑤-⑦可作为选做项目,⑤-⑥也可由教师提供。
(5) 前期准备:实验开始前一周,教师通过学生工作群将实验目的提供给学生,鼓励学生自主查阅相关资料,如微乳的制备、三元相图的绘制、AgNPs的制备等,小组讨论后制定实验方案,经教师检查后提出修改建议、注意事项等,如相界面的观察、催化剂浓度、反应过程监测等。
(6) 实验过程:每组学生根据教师审核通过后的实验方案开展实验,在实验过程中,教师可引导学生关注实验现象背后的本质,如Tyndall现象、催化反应中的颜色变化等。
(7) 实验结束后,要求学生完成一份完整的实验报告,尤其要通过对实验现象和实验数据的深入分析和讨论,建立“现象-数据-理论”三者之间的内在关联。
6 结语
设计了一个涉及相图、胶体与界面化学、动力学等多个知识点的物理化学综合实验,搭建了热力学与动力学之间的桥梁,融入了胶体与纳米科学等前沿研究,有助于学生完善知识架构,激发科研兴趣,培养创新思维。同时,该实验也积极引导学生关注化学化工的绿色化发展问题,培养学生的环保意识与科学担当精神。此外,该实验也为学有余力的学生保留了进一步提升能力的空间(如:可鼓励学生设计实验对催化活性的差异进行分析)。总之,该综合实验不仅有助于提升学生的综合实践能力,而且有助于拓展创新思维,提高科学素养,是对“一流课程”建设的有力支撑。

