氮杂环卡宾催化的Michael加成反应
赵明,许玉荣,林静,陈虎
合肥师范学院化学与化学工程学院,合肥 230601
Michael加成反应是有机化学中一类十分重要的反应,碳负离子(给体)可以和α,β-不饱和醛、酮、酯等亲电共轭体系(受体)发生亲核1,4-加成反应[1]。作为有机催化剂的氮杂环卡宾催化的反应取得了巨大的研究进展,其也能够催化Michael加成反应[2-5]。在氮杂环卡宾催化作用下,醛可以作为给体与α,β-不饱和酮等受体发生亲核1,4-加成反应,即Stetter反应。反应中,氮杂环卡宾前体(盐)在碱性条件下首先失去质子生成卡宾(活体),然后和醛进行结合形成中间体2,中间体2经过质子转移进一步形成更稳定的烯胺中间体3 (即Breslow中间体),此中间体具有亲核性,使得醛的反应极性由亲电性转变为亲核性(极性反转),接着具有亲核性的Breslow中间体3与α,β-不饱和酮等发生1,4-加成反应,再经质子转移及卡宾离去,得到最终产物7 (图1)。此外,氮杂环卡宾也可以作为Brønsted碱,活化醇等发生Michael加成反应。本文在有机化学Michael加成反应知识点的基础上进行延伸和拓展,介绍氮杂环卡宾催化的Michael加成反应。
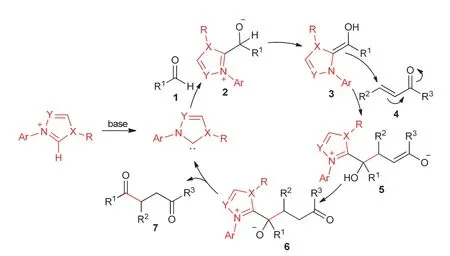
图1 氮杂环卡宾催化的Stetter反应机理
1 Stetter反应
1973年,Stetter教授等[6]首次报道在氮杂环卡宾催化作用下醛可以与α,β-不饱和羰基化合物发生1,4-加成反应。后来,人们把在氮杂环卡宾催化作用下醛与Michael受体之间的加成反应称之为Stetter反应。经发展,α,β-不饱和酮、α,β-不饱和酯、硝基烯、乙烯基砜、乙烯基磷酸酯等都可以作为Stetter反应的Michael受体[7]。对于Stetter反应,可分为分子间Stetter反应、分子内Stetter反应及其不对称反应。
1.1 分子间Stetter反应
2004年,Scheidt教授课题组[8]发展了氮杂环卡宾催化酰基硅烷与α,β-不饱和酮之间的分子间Stetter反应(图2)。反应以酰基硅烷8代替醛为底物,有效降低了醛之间的安息香缩合。2006年,Scheidt教授课题组[9]又以噻唑盐类化合物12作为亲核试剂,对分子间Stetter反应进行了报道(图3)。反应中,噻唑盐底物12在氟离子作用下,首先脱去羟基上的硅烷保护基,生成Breslow中间体,然后再与硝基烯13发生加成反应,最终得到β-硝基酮14。

图2 酰基硅烷与α,β-不饱和酮之间的分子间Stetter反应
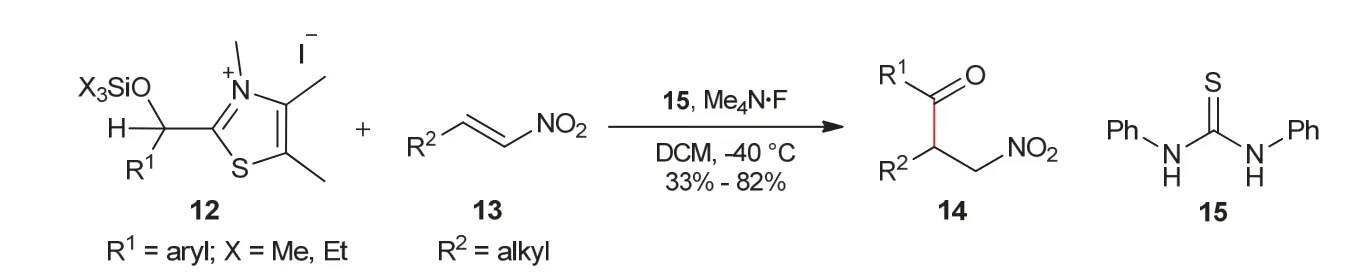
图3 噻唑盐与硝基烯之间的分子间Stetter反应
后来,Biju教授课题组[10,11]发展了乙烯基砜、乙烯基磷酸酯作为Michael受体的分子间Stetter反应。当Michael受体为乙烯基砜17时,在氮杂环卡宾19催化作用下,芳香醛或脂肪醛16与其反应可以得到γ-酮砜化合物18;当Michael受体为乙烯基磷酸酯21时,反应可以得到γ-酮磷酸酯化合物22 (图4)。
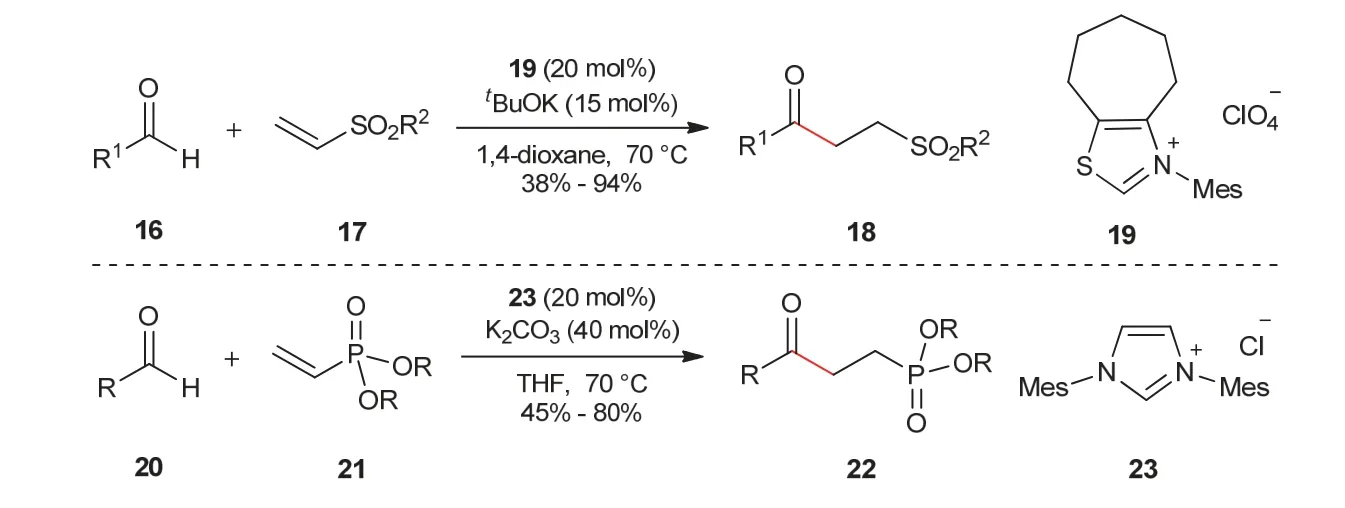
图4 γ-酮砜和γ-酮磷酸酯的合成
2013年,池永贵教授课题组[12]实现了糖类化合物与α,β-不饱和酮之间的分子间Stetter反应。反应中,在氮杂环卡宾27催化作用下糖类化合物24可以产生一个单碳的酰基阴离子中间体,然后作为亲核试剂与α,β-不饱和酮Michael受体25发生反应,最终得到β-甲酰基酮化合物26 (图5)。

图5 β-甲酰基酮的合成
1.2 不对称分子间Stetter反应
分子间Stetter反应的产物含有手性中心。因此,化学家对不对称分子间Stetter反应进行了尝试和研究;通过手性氮杂环卡宾催化,可以诱导出手性产物。Stetter反应已经作为一种有效的合成方法,被应用于天然产物的全合成中[13]。
1989年,Enders教授课题组[14]研究了首个不对称分子间Stetter反应,丁醛和查尔酮在手性噻唑类氮杂环卡宾31催化作用下,以4%的产率、39%的ee值得到1,4-二酮产物30 (图6)。2008年,Enders教授课题组[15]发展了芳香醛与α,β-不饱和酮之间的不对称分子间Stetter反应。在手性氮杂环卡宾35催化作用下,芳香醛32与α,β-不饱和酮33反应,能够以高达98%的产率和78%的ee值得到1,4-二羰基化合物34 (图7)。

图6 不对称分子间Stetter反应

图7 1,4-二羰基化合物的合成
2012年,Glorius教授课题组[16]实现了丙烯酸酯作为Michael受体的不对称分子间Stetter反应。在合成的新型三唑类手性氮杂环卡宾39催化作用下,醛36与低活性的亲电试剂丙烯酸酯37反应,可以以良好的产率和立体选择性得到α手性γ-酮酯化合物38 (图8)。
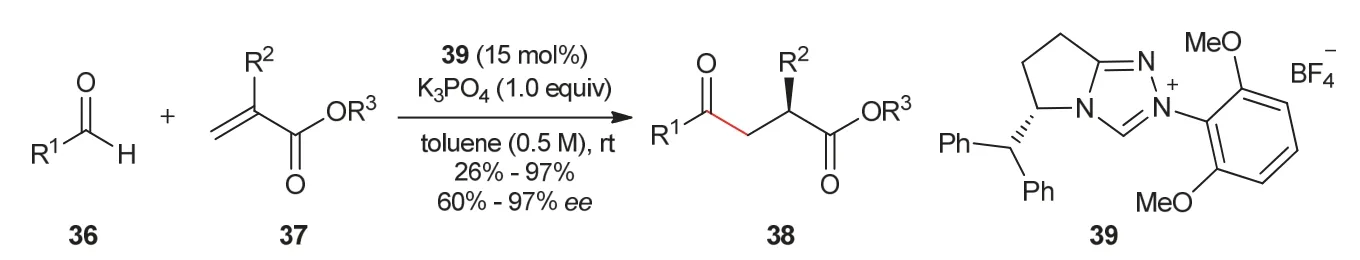
图8 γ-酮酯化合物的合成
1.3 分子内Stetter反应
相对于分子间Stetter反应,分子内Stetter反应的发展要晚些。1995年,Ciganek教授[17]报道了首个分子内Stetter反应。反应中使用含有醛和α,β-不饱和酯结构的化合物40作为底物,在噻唑类氮杂环卡宾42催化作用下,经过分子内的1,4-加成反应,得到了苯并吡喃酮或苯并呋喃酮产物(图9)。
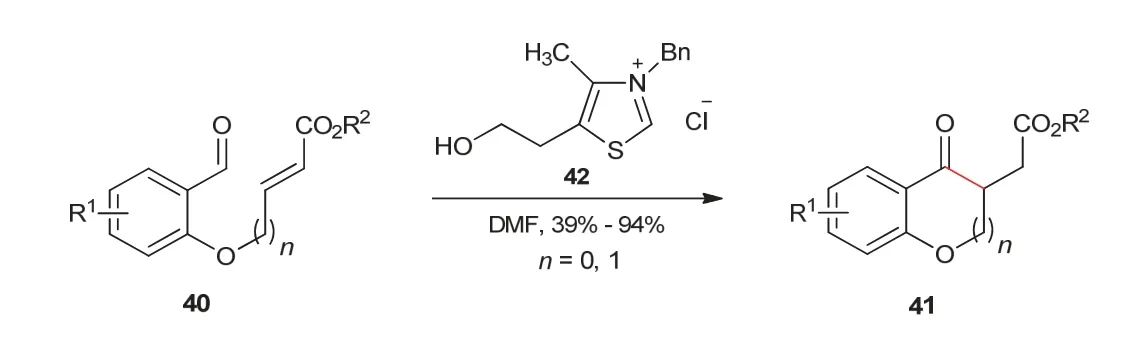
图9 分子内1,4-加成反应
此后,Enders教授[18]、Rovis教授[19]、游书力研究员[20]、Rafiński教授[21]等课题组设计了不同的手性氮杂环卡宾催化剂用于不对称分子内Stetter反应。Enders教授课题组以手性氮杂环卡宾45作为催化剂,反应的产物可以达到73%的产率和74%的ee值;Rovis教授课题组使用合成的手性氮杂环卡宾46催化分子内Stetter反应,最终以高达95%的产率、97%的ee值得到目标产物;游书力研究员课题组设计合成了新型的手性三唑类氮杂环卡宾47催化分子内Stetter反应,最终反应的产物高达97%的产率和97%的ee值;Rafiński教授课题组使用手性氮杂环卡宾催化剂48催化分子内Stetter反应,反应的产率和ee值分别高达99%和98% (图10)。
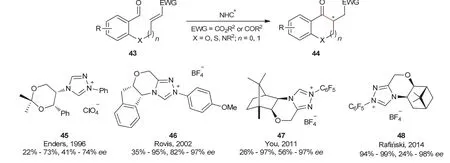
图10 不对称分子内Stetter反应
房新强教授课题组[22]通过不对称分子内Stetter反应去对称化,以高产率高立体选择性构筑了一系列含有两个手性中心的环酮化合物50 (图11)。反应中,底物49含有两个相同的Michael受体,在手性氮杂环卡宾51催化作用下,醛与其中一个Michael受体发生反应,分子结构的对称性被去除,并得到目标分子50。
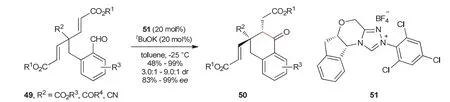
图11 不对称分子内Stetter反应去对称化反应
2 Brønsted碱催化
在Stetter反应中,氮杂环卡宾是以结合形成Breslow中间体的方式催化反应。此外,氮杂环卡宾也可以以非共价键的方式催化反应,即作为Brønsted碱,催化醇等发生Michael加成反应。反应中,氮杂环卡宾首先作为Brønsted碱活化醇等亲核试剂,提高其亲核性,形成中间体53,然后活化的亲核试剂与α,β-不饱和酮等发生1,4-加成反应,最终得到产物56 (图12)。
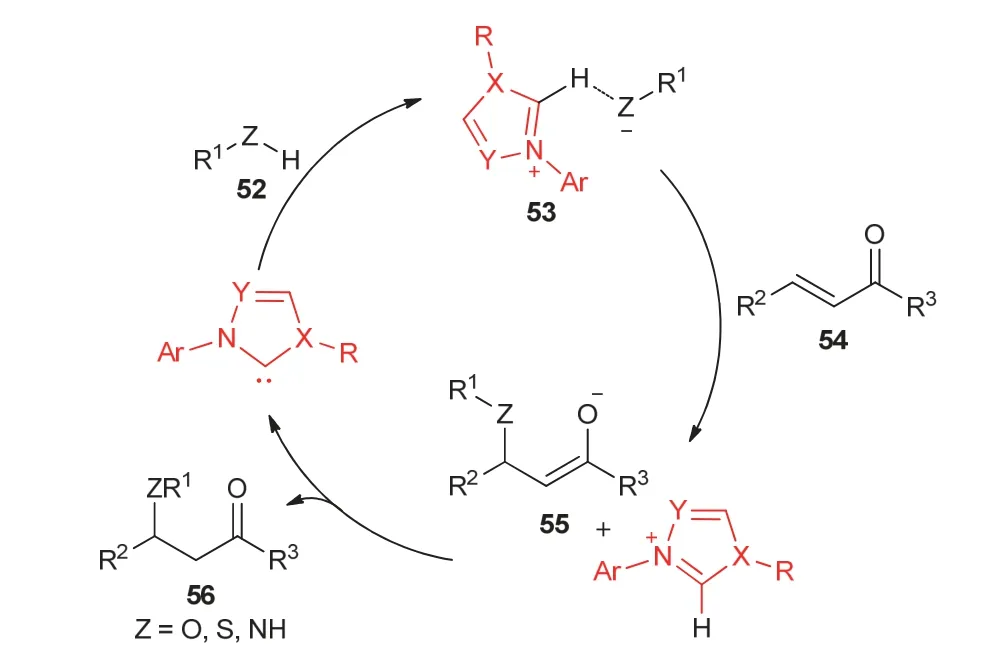
图12 氮杂环卡宾作为Brønsted碱催化反应机理
2010年,Scheidt教授课题组[23]发展了氮杂环卡宾23催化醇57与α,β-不饱和酮或α,β-不饱和酯58之间的氧杂Michael加成反应(图13)。底物57无论是伯醇还是仲醇在氮杂环卡宾23催化活化下,都可以作为反应的亲核试剂。后来,周岭教授课题组[24]以醇或酚作为亲核试剂对氮杂环卡宾催化2-硝基半乳糖糖苷化反应进行了报道(图14)。在氮杂环卡宾62催化作用下,醇或酚与2-硝基半乳糖60反应,得到以α构型为主的1,2-顺式-2-硝基糖苷产物61,经进一步转化,可以为糖肽的合成提供有价值的结构单元。

图13 氮杂环卡宾催化醇的Michael加成反应
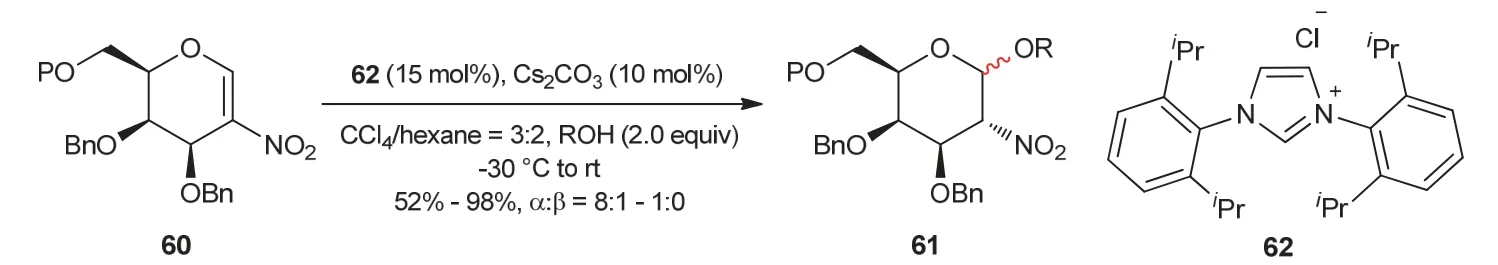
图14 氮杂环卡宾催化的糖苷化反应
3 结语
本文主要介绍了氮杂环卡宾催化的Michael加成反应。总的来说,氮杂环卡宾催化的Michael加成反应,氮杂环卡宾可以通过催化转变醛的反应极性与Michael受体发生加成反应,也可以作为Brønsted碱活化醇等发生Michael加成反应。氮杂环卡宾催化的反应不断被发展,在安息香缩合反应、氢酰化反应、环加成反应、酯化反应、协同催化、自由基反应等方面都取得了重要的研究进展。此部分内容,把本科生熟悉的安息香缩合反应(醛极性反转)和Michael加成反应联系到一起,供大家参考、交流,拓展本科教学内容,激发学生的探索和学习兴趣。

