艾滋病合并消化道溃疡的内镜下表现
施言,高静,吴乾能,章復龙,朱元东,周丹
(浙江大学医学院附属杭州市西溪医院 消化科,浙江 杭州 310023)
艾滋病(acquired immunodeficiency syndrome,AIDS)是全球重大的公共健康问题,是由人类免疫缺陷病毒(human immunodeficiency virus,HIV)引起的传染性疾病。HIV主要侵犯人体的免疫系统,表现为CD4+T淋巴细胞数量不断减少,最终导致人体细胞免疫功能缺陷,造成各种机会性感染和肿瘤的发生。胃肠道是HIV攻击的主要器官之一,但消化道溃疡性病变的临床报道较少。本研究总结本院20例AIDS患者的内镜下消化道溃疡特征,以期提高临床一线工作者对该病的认知。
1 资料和方法
1.1 一般资料
收集浙江大学医学院附属杭州市西溪医院2018年5月-2021年5月行胃肠镜检查的20 例AIDS 合并消化道溃疡的患者的临床资料。20 例患者中,男17例,女3 例;年龄24~73 岁,平均(49.21±14.08)岁;确诊HIV感染1个月~13年,平均(5.04±4.30)年。患者行内镜检查的原因:腹痛6 例,胸痛1 例,肛周疼痛5 例,里急后重2 例,贫血1 例,进食后梗阻感1 例,发热腹泻1 例,肠息肉复查3 例。HIV 核糖核酸(ribonucleic acid,RNA)阳性者7 例,HIV RNA 值为1.40×102~3.57×105IU/mL,平均(2.81±8.97)×104IU/mL;合并梅毒血清学阳性2 例,血清巨细胞病毒(cytomegalovirus,CMV)阳性1 例。本研究经本院医学伦理委员会审定通过,所有患者检查前已签署内镜检查知情同意书。
1.2 内镜检查
我院消化科使用奥林巴斯CV-260SL、GIF240 和GIF260 胃镜,南京微创公司活检钳。所有患者经静脉麻醉后在心电监护下进镜,操作过程中,仔细观察消化道各部位黏膜特点,有无糜烂、溃疡形成,如发现明显的单个或多个溃疡性病灶,对处于病灶中央和交界处的黏膜分别活检数块送病理检查。缓慢退镜时,再次仔细观察消化道各部位黏膜。结束内镜检查后,将患者运送至苏醒室,内镜护理人员监测并记录患者基本生命体征情况,等待患者苏醒。
1.3 观察指标
部分患者行HIV RNA 检测和CD4+T 细胞检测,记录检测结果,统计分析这两者与消化道恶性肿瘤、特异性病原体感染以及普通炎性溃疡的关系。内镜下检查发现消化道溃疡性病灶后,详细记录溃疡部位、数量、直径大小、累及深度、溃疡边缘形态、周围黏膜特点以及病理学结果(重点关注银染色、抗酸染色以及包涵体病毒)。
1.4 统计学方法
选用SPSS 22.0 统计软件处理数据。计量资料以均数±标准差(±s)表示;计数资料以例(或百分比)表示,统计分析采用χ2检验或Fisher 确切概率法。P<0.05为差异有统计学意义。
2 结果
2.1 结肠镜和病理结果
20 例患者中,食管溃疡4 例(20.0%),胃溃疡3例(15.0%),回盲部溃疡3例(15.0%),回肠末端溃疡2例(10.0%),结肠溃疡1例(5.0%),直肠溃疡7例(35.0%)。病理结果提示:放线菌感染1 例(5.0%),结核杆菌感染2例(10.0%),真菌感染1例(5.0%),腺癌1 例(5.0%),鳞状细胞癌1 例(5.0%),非霍奇金淋巴瘤2例(10.0%),慢性炎症12例(60.0%)。
2.2 外周血HIV RNA 阳性和CD4+ T 细胞数量与消化道溃疡的关系
20 例患者中,16 例(80.0%)行HIV RNA 检测,发现7 例(7/16,43.8%)可检测出HIV RNA。17 例(85.0%) 行CD4+T 细胞检测,发现7 例(7/17,41.2%)CD4+T 细胞数<250/µL(腺癌1 例,非霍奇金淋巴瘤1 例,特异性病原体感染2 例,慢性炎症3例),CD4+>250/µL 者10例(真菌感染1例,慢性炎症9例)。本研究发现:外周血HIV RNA阳性和CD4+T细胞数量与消化道恶性肿瘤(腺癌、鳞癌和非霍奇金淋巴瘤)(P=0.268,P=0.315)、特异性病原体感染(结核杆菌和放线菌)(P=0.359,P=0.621)以及普通炎性溃疡无明显相关性(P=0.549,P=0.058)。见附表。
2.3 AIDS患者消化道溃疡的内镜下表现和病理图片
2.3.1 普通炎性溃疡 患者男,28 岁,因“反复剑突下隐痛1个月余”入院。入院后胃镜示:胃角后壁可见一直径约0.6 cm 溃疡性改变,上覆盖薄白苔,溃疡边缘锐利干净,周围黏膜少许红肿隆起。于溃疡边缘活检2 块。见图1A。病理示:(胃角)黏膜慢性炎伴糜烂,萎缩(-),肠化(-),幽门螺杆菌(Helicobacter pylori,HP)(-)。免疫组化/特殊染色:抗酸染色(-),EB 病毒(Epstein-Barr virus,EBV)(-),CMV (-),单纯疱疹病毒(herpes simplex virus,HSV)(-)。见图1B。
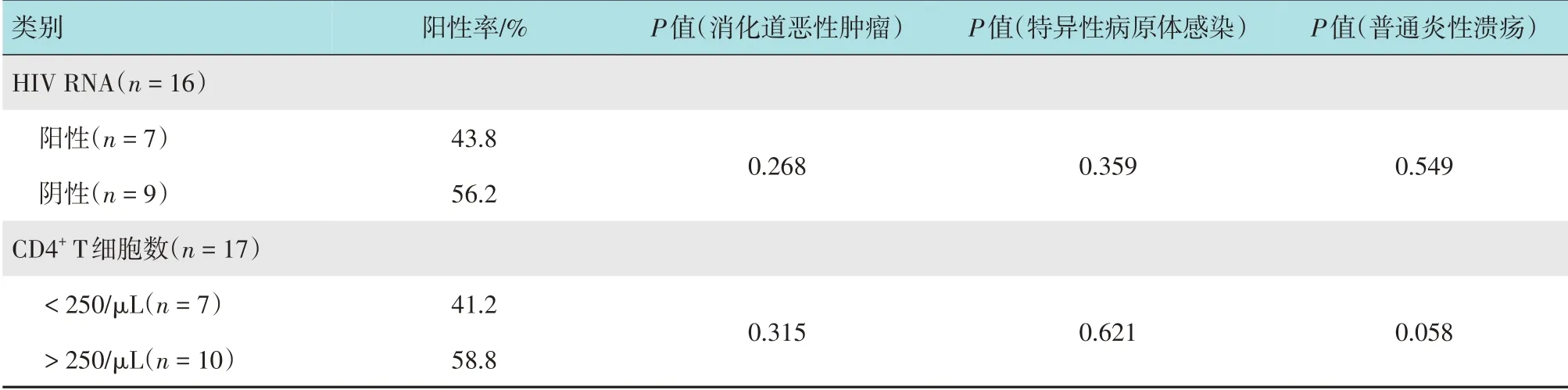
附表 HIV感染者外周血HIV RNA以及CD4+T细胞数量与消化道溃疡的关系Attached table Relationship between the viral load of HIV RNA,amounts of CD4+T cells in peripheral blood and digestive ulcer in HIV-infected patients

图1 普通炎性溃疡Fig.1 Common inflammatory ulcer
2.3.2 食管放线菌感染 患者男,56 岁,因“反复胸骨后疼痛1年余”入院。入院后胃镜示:距门齿38.0~42.0 cm巨大穿凿样溃疡性改变,似累及平滑肌层,溃疡边缘较整齐,周围黏膜轻度充血,于溃疡边缘多点活检。见图2A。病理示:(食道)黏膜慢性炎伴糜烂,炎性肉芽组织增生,可见硫磺颗粒沉积和丝状革兰氏阳性菌。免疫组化/特殊染色:银染(+),抗酸染色(-),EBV(-),CMV(-),HSV(-)。结合病理可见:硫磺颗粒和丝状革兰氏阳性菌,同时银染阳性,符合放线菌的组织病理学表现。见图2B。
2.3.3 特发性食管溃疡 患者男,26 岁,因“上腹部隐痛2 周”入院。入院后查胃镜示:距门齿约22.0 cm及以下可见食管多发大小不等、穿凿样溃疡,基底多平坦,覆白苔,较大者由距门齿约40.0 cm 延伸至45.0 cm,累及贲门胃底,占据1/3食管腔。于贲门处活检2 块,距门齿35.0 cm 处活检2 块。见图3。病理示:(贲门、食管)黏膜慢性炎伴糜烂、坏死,符合溃疡改变。免疫组化:银染(-),抗酸染色(-),CMV(-),EBV(-),HSV(-)。患者血液标本CMV、EBV 和HSV 的RT-PCR 检测均为阴性,住院过程中使用相应的抗病毒及抗真菌药物,但疗效不佳。

图2 食管放线菌感染Fig.2 Esophageal actinomycetes infection
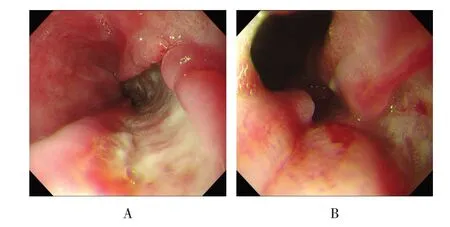
图3 特发性食管溃疡Fig.3 Idiopathic esophageal ulcer
2.3.4 肠结核病例A 患者男,48 岁,因“右下腹痛1个月余”入院。入院后肠镜示:回盲瓣口累及回肠末端约8.0 cm长的巨大、全周型环形溃疡,周围黏膜质硬,伴有肠腔狭窄,予以活检送病理。见图4。病理示:回盲部黏膜坏死伴肉芽组织增生,间质见多量、大小一致、呈团簇状孢子的泡沫样组织细胞。免疫组化:糖原染色(periodic acid schiff,PAS)(+),银染(+),抗酸(+),墨汁染色(-),EBV(-),CMV(-)。大便涂片:抗酸杆菌(+)。腹部增强CT 示:回盲部占位伴腹腔及腹膜后多发淋巴结。结合患者典型的临床表现、内镜下溃疡特点和病理学证据,诊断为溃疡型肠结核合并真菌性肠炎。
2.3.5 肠结核病例B 患者女,47 岁,因“右下腹痛4 d”入院。入院后行肠镜示:回盲部结构紊乱,可见一直径约0.6 cm×0.6 cm 的不规则样溃疡,伴结节状隆起,同时可见多枚大小不等、形态不同的结节息肉样隆起。见图5。病理示:(溃疡处)黏膜慢性炎伴炎性肉芽组织增生,可见干酪样坏死性肉芽肿;黏膜慢性炎(结节息肉处)。特殊染色:抗酸染色(+),EBV(-),CMV(-),HSV(-)。同时患者结核杆菌感染T 细胞斑点试验(tuberculosis infection T cell spot test,T-SPOT)呈强阳性。结合患者肠镜下表现、病理和T-SPOT 检查结果,诊断为溃疡性肠结核。

图4 肠结核病例AFig.4 Case A of intestinal tuberculosis
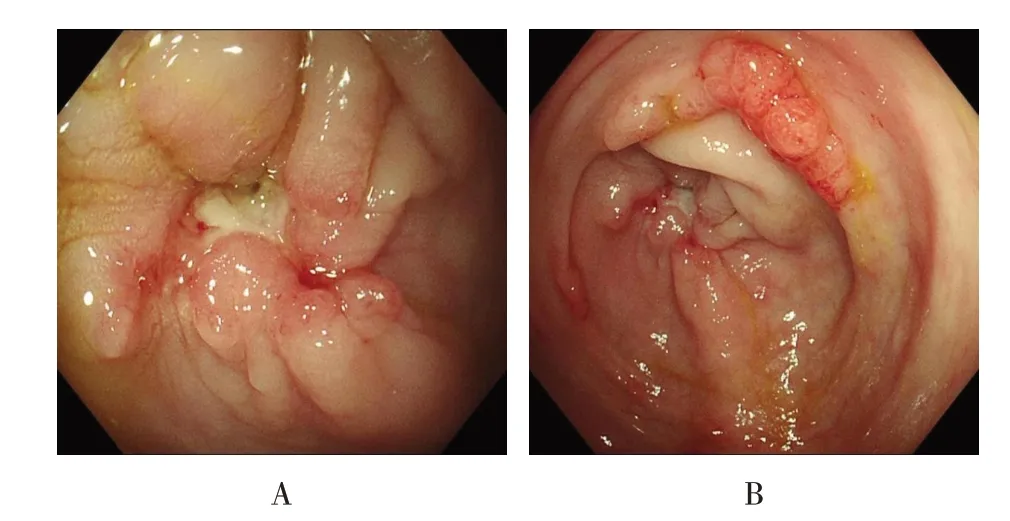
图5 肠结核病例BFig.5 Case B of intestinal tuberculosis
2.3.6 非霍奇金高侵袭性B 细胞淋巴瘤 患者男,55 岁,因“右下腹间断性钝痛1 个月余”入院。入院后肠镜示:回肠末端多发溃疡增生样病变,其中一个较大,周围呈河堤样隆起,底覆污苔,回盲部可见一直径约3.0 cm×1.0 cm 的溃疡增生样病变,质地尚软,底深,分别取活检送病理。见图6。病理示:回肠末端、回盲部黏膜及黏膜下见异型淋巴细胞浸润性生长。结合免疫组化结果,诊断为非霍奇金高侵袭性B细胞淋巴瘤。
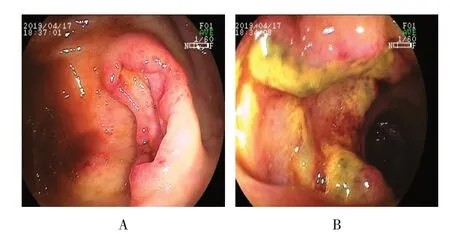
图6 非霍奇金高侵袭性B细胞淋巴瘤Fig.6 Non-Hodgkin highly invasive B-cell lymphoma
3 讨论
AIDS 是一类严重危害人类健康的传染性疾病。胃肠道是人体最大的免疫器官,亦是AIDS 病毒攻击的主要靶器官。文献[1]报道,约75.0%以上的HIV 感染者会出现胃肠道症状,包括:恶心呕吐、腹痛、腹泻、肛周疼痛和里急后重等。目前,国内关于消化道溃疡型病变的相关报道较少。本文着重介绍并分析HIV患者合并消化道溃疡的内镜下特征和相关病理结果,以提高临床医师对该类病变的判断和诊治能力。
本研究显示,食管溃疡、回盲部溃疡和直肠溃疡的发病率较高。溃疡的形态学特点因溃疡性质不同而有差异,如:食管放线菌感染的内镜下表现为单个巨大溃疡,特发性食管溃疡则为多个连续的穿凿样溃疡。回肠末端和回盲部溃疡以结核杆菌感染和恶性淋巴瘤侵犯多见。直肠的溃疡形态多呈散在分布,且大小不等。本研究中,直肠溃疡7 例,1 例表现为深溃疡伴周围黏膜明显隆起,病理提示:直肠鳞癌,已行手术治疗;还有1例表现为直肠多发浅溃疡,病理提示:轻中度不典型增生,需要密切保持内镜随访。这提示:对于发生在直肠的溃疡性病变,需警惕癌前病变,甚至恶性溃疡的可能性。HIV感染者的消化道溃疡病因与正常人群的溃疡病因有明显的不同,常由机会性感染或恶性肿瘤导致,炎症性肠病极为少见[2]。本研究提示:食管放线菌感染、结核杆菌感染、真菌感染和非霍奇金淋巴瘤是HIV患者消化道溃疡首要考虑的病因。国外研究[3-5]表明,HIV 可直接损害肠道,或通过间接(免疫介导)机制影响肠上皮的所有成分,引起细胞因子免疫和辅助性T细胞17大量减少,破坏肠道结构,导致菌群移位和免疫损伤。笔者认为,患者HIV RNA阳性和CD4+T细胞数量明显减少,是病毒复制活跃和机体免疫力低下的特征,患者机会性感染和恶性肿瘤发生概率会明显增加,但病例分析未见这两者与消化道恶性肿瘤和机会性感染存在明显相关性,推测可能与总体样本量偏少有关,需在下一步的临床研究中扩大病例数量。
本文病例中有1例考虑为食管放线菌感染。食管放线菌感染属于较罕见的消化道感染类型,免疫力低下或正常的人群均可发生,但以HIV感染和肿瘤患者多见。典型的病理涂片可见丝状革兰氏阳性菌,或可看到硫磺颗粒沉积。现有文献[6-7]报道,放线菌感染可引起多种形态的食管内病灶,如:食管多发纵形斑、黏膜下占位和大片覆膜的坏死区域等。而放线菌感染引起的食管溃疡,其内镜下表现无特异性。有文献[8]报道了单个或多个浅溃疡或巨大穿凿样溃疡。由于放线菌的培养需要特定的生长条件,加之目前大量广谱抗生素的应用,使得细菌培养阳性率偏低。因此,病理结果成为明确诊断的关键。
本文中有2 例患者明确为肠结核杆菌感染。HIV感染、接受器官移植和终末期肾病被认为是结核病发病的高危因素[9],其内镜下表现主要为:溃疡型、增生型或混合型。本文患者均表现为溃疡型肠结核。溃疡型肠结核的典型内镜下特点[10]为:①回盲瓣的累及率超过90.0%,一般为全周型或次周型溃疡,并可向回肠末端及盲肠和升结肠方向扩展;溃疡间可见增生性病变;②溃疡可累及周围腹膜和肠系膜淋巴结;③因病变常与周围组织粘连,急性穿孔较为少见,慢性穿孔多形成腹腔脓肿或肠瘘。
本文中有1例考虑特发性食管溃疡。该患者病理提示:慢性炎症,免疫组化示抗酸染色、CMV、EBV和HSV 等病毒抗体染色均为阴性,血液标本相应病毒的RT-PCR检测也均为阴性,住院过程中应用抗病毒及抗真菌药物疗效不佳。因患者食管多发溃疡未找到传染性病原体证据,且常规抗病毒、抗真菌无效,笔者考虑该患者为特发性食管溃疡。特发性食管溃疡的诊断是在排除其他病原学证据后建立的,病因尚不明确。有学者[11]认为,潜在机制是HIV诱发了食管黏膜凋亡。最有效的治疗手段是使用类固醇类药物,但前提是充分、高效的抗病毒治疗[12]。该病例内镜下特点为多个直径不等、形态不规则的穿凿样溃疡,边界锐利清晰,溃疡间黏膜充血肿胀,病变可累及至贲门。对于HIV感染者,采用多块组织学病理和免疫组化排除了其他病原学感染后,可诊断为特发性食管溃疡。
胃肠道的非霍奇金淋巴瘤是最常见的结外淋巴瘤,约85.0%以上为B 细胞淋巴瘤。危险因素包括:先天性免疫缺陷、感染(特别是HIV 感染和EB 病毒感染)、职业环境(频繁使用杀虫剂和染发剂)和遗传[13]。小肠和结肠非霍奇金淋巴瘤内镜下形态主要分为肿块型、溃疡型、淋巴瘤样息肉病型、弥漫型和混合型,以肿块型和溃疡型多见[14]。巨大溃疡型非霍奇金淋巴瘤的周边隆起常比溃疡型明显,溃疡深如岩洞,呈“口小腔大”表现。本文中非霍奇金淋巴瘤病例的内镜下特点为回盲部和回肠末端的多发溃疡增生性改变,表现为巨大溃疡,底深、覆污苔,周围黏膜堤坝样隆起,呈恶性侵犯特征。
综上所述,AIDS 合并消化道溃疡患者需特别关注的溃疡类型有食管放线菌、特发性食管溃疡、肠结核和肠道非霍奇金淋巴瘤。HIV感染者的消化道溃疡病因与正常人群的溃疡病因有明显的不同,常由机会性感染或恶性肿瘤导致。如患者因吞咽困难、胸骨后疼痛或腹痛至消化科门诊就诊,临床医师需警惕并发胃肠道疾病的可能性,及时行胃肠镜检查,避免漏诊和误诊。

