RhGM -CSF与rhEGF在中厚皮片供区创面的应用
黄云,鲍琼,曹东升
(安徽医科大学第二附属医院,安徽 合肥 230601)
关键字:粒细胞-巨噬细胞集落刺激因子;表皮生长因子;供皮区
0 引言
中厚皮片具有存活较易,在存活后收缩性、耐磨性、色泽改变等方面不明显等特点,在整形外科中被广泛应用于身体各部位皮肤缺损的修复[1]。但供皮区的愈合时间长、疼痛不适等特点,增加了患者痛苦。伤口愈合是一个复杂的过程,有多种细胞因子参与、调控,添加外源性生长因子可加速创面愈合[2]。重组人粒细胞巨噬细胞集落刺激因子( recombinant human granulocyte macrophage colony stimulating factor,rhGM -CSF)与重组人表皮生长因子( recombinant human epidermal growth factor,rhEGF)都具有加速创面上皮化进程、促进伤口愈合的作用。国内外少有在供皮区上对比rhGM -CSF与rhEGF疗效的研究,为在临床上提供皮片供区治疗选择方式,本研究通过二者在中厚皮片供区的局部应用,比较rhGM -CSF与rhEGF对中厚皮片供区的影响。
1 材料与方法
1.1 病例资料
2020 年 5月至2021年5月在安徽医科大学第二附属医院整形外科行大腿中厚皮移植术患者60例,随机分为对照组、EGF组与GC组,每组各20例。其中对照组:男9例,女16例,年龄(25-66)岁 ,平均年龄(43.55±11.49)岁,创面平均面积(54.45±14.82)cm2;EGF组:男12例,女13例,年龄(21-67)岁 ,平 均年龄(42.20±12.41)岁,创 面 平 均 面 积(50.67±14.07)cm2;GC组:男11例,女14例,年 龄(23-63)岁 ,平 均 年 龄(41.55±12.80)岁,创 面 平 均 面积(51.49±14.12)cm2;患者的一般资料(年龄、性别、供区面积)比较差异无统计学意义(P>0.05),见表1,该临床研究所有患者治疗前均签署相关知情同意书。
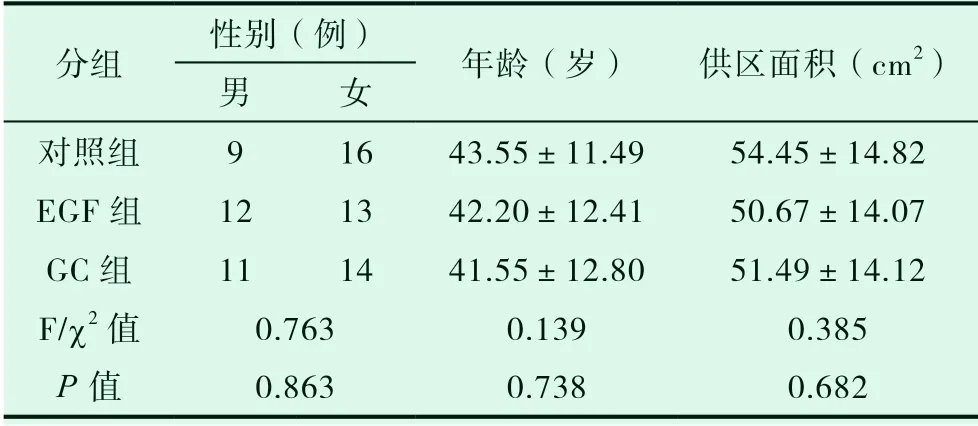
表1 三组一般资料对比
1.2 纳入标准
需行取大腿处中厚皮片的患者,年龄≥20岁且<70岁。
1.3 排除标准
使用免疫抑制剂、激素等患者;哺乳期、孕期的妇女;糖尿病血糖控制不佳者;明确对 rhGM-CSF、rhEGF、类似药物过敏的患者;患有精神疾病的患者。
1.4 创面处理
对照组:常规消毒铺巾后,估算需取皮面积,亚甲蓝在大腿处标记,供皮区肾上腺素利多卡因肿胀麻醉,电动取皮机,厚度约0.5mm,所有患者的取皮由同一治疗组医师操作,盐水纱布压迫止血后,凡士林纱布覆盖供皮区,普通纱布、棉垫及绷带加压包扎。术后3d第一次换药,以后每两天换药一次,直至创面愈合。GC组与EGF组:在术后即刻和换药时,供皮区予均匀涂抹外用 rhGMCSF 凝胶剂(长春金赛药业有限责任公司,规格100μg/(10g·支))或rhEGF(桂林华诺威基因药业有限公司,规格200μg/(20g·支)),厚度2-3mm,其余处理同对照组。
1.5 观察指标
1.5.1 创面愈合情况
计算第10d及14d创面愈合率(供皮区愈合率=(治疗前面积-治疗后面积)/治疗前面积×100%);记录创面完全愈合时间(以供皮区完全上皮化为愈合标准)。
1.5.2 疼痛评估
利用视觉模拟评分(Visual Analog Scale,VAS),评估在第3d、7d、10d换药时患者供皮区的疼痛情况。
1.5.3 术后瘢痕情况
根据温哥华瘢痕量表(vancouver scar scale,VSS),评测三组创面在术后第3个月的瘢痕情况。
1.5.4 创面分泌物培养
换药时取创面分泌物进行培养,记录细菌培养阳性率。
1.6 统计学处理
使用SPSS 26.0软件分析,分类资料采用卡方检验;服从正态分布的定量资料用±s表示,采用方差分析,组间两两比较采用LSD检验,不服从正态分布的计量资料,采用中位数(四分位间距)即M(QU-QL)表示,进行非参数检验;以P<0.05 表明差异有统计学意义。
2 结果
2.1 创面愈合情况
GC组与EGF组第10d及14d创面愈合率均高于对照组(P<0.05),GC组第10d及14d创面愈合率均高于EGF组(P<0.05)。GC组与EGF组创面愈合时间较对照组愈合时间短(P<0.05),GC组创面愈合时间较EGF组愈合时间短(P<0.05),见表2。
表2 三组供皮区创面愈合率及愈合时间的比较(±s)
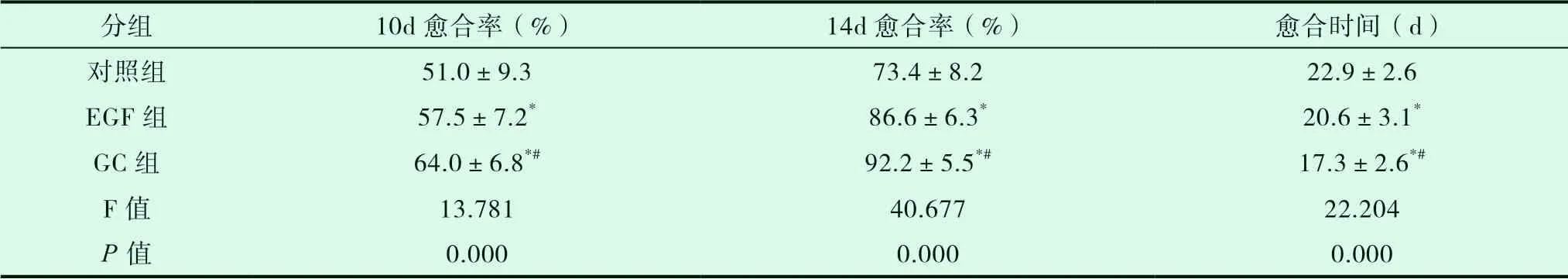
表2 三组供皮区创面愈合率及愈合时间的比较(±s)
注:*与对照组比较,P<0.05,#与EGF比较,P<0.05
分组 10d愈合率(%) 14d愈合率(%) 愈合时间(d)对照组 51.0±9.3 73.4±8.2 22.9±2.6 EGF组 57.5±7.2* 86.6±6.3* 20.6±3.1*GC组 64.0±6.8*# 92.2±5.5*# 17.3±2.6*#F值 13.781 40.677 22.204 P值 0.000 0.000 0.000
2.2 疼痛评估
三组在第3d换药时疼痛评分差异无统计学意义(P>0.05);在7d及10d换药时疼痛评分时,GC组与EGF组均低于对照组(P<0.05),并且GC组均低于EGF组(P<0.05),见表3。
2.3 术后瘢痕情况
在术后第3个月供皮部位瘢痕情况评估中,三组瘢痕评分差异有统计学意义(P<0.05)。在组间两两比较中,GC组和EGF组分别与对照组相比较时,瘢痕评分差异有统计学意义(P<0.05),见表3,典型病例见图1、图2、图3所示。
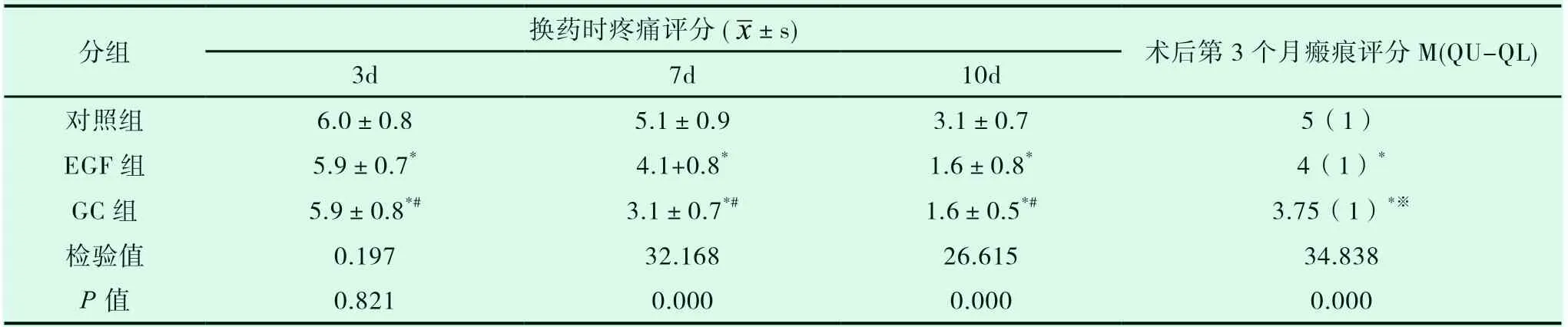
表3 三组换药时疼痛评分和术后3个月瘢痕评分
2.4 创面分泌物培养
除对照组与EGF组仅各出现一例感染,检出率为4%,差异无统计学意义(P>0.05)。
3 讨论
中厚皮片移植术在创面修复上的广泛应用,在供区从而形成新的创面,一般需要3周甚至更长时间愈合,愈合过程中疼痛、瘙痒等不是及伴发感染等并发症,大大增加了患者的痛苦。临床上中厚皮片供皮区的治疗有刃厚皮片回植、各种生物制剂及功能性敷料等方式。
我们局部应用rhGM -CSF与rhEGF来对比在中厚皮片供区愈合情况,GC组和EGF组在创面愈合率及完全愈合时间上明显早于对照组,且rhGMCSF效果优于rhEGF,这表明rhGM -CSF更能加速创面上皮化进程,促进伤口愈合。在术后瘢痕评分中方面,显示出rhGM-CSF和rhEGF都具有抑制瘢痕提高愈合质量。
EGF是由血小板、巨噬细胞和成纤维细胞分泌通过与细胞表面上的表皮生长因子受体(EGFR)结合而发挥作用[3],EGF促进再上皮化机制可能是与邻近创面基底细胞膜上的EGF受体结合,促进基底膜细胞与基底膜分离, 基底膜细胞向表层移行形成单细胞层,然后经有丝分裂形成复层上皮细胞而加速创面的上皮化、诱导皮肤干细胞快速定向分化有关[4]。
GM-CSF促进伤口愈合的机制可能通过两种方式[5-6]:首先,GM-CSF对巨噬细胞,中性粒细胞,朗格汉斯细胞,成纤维细胞等具有趋化性,它加速伤口愈合;其次,GM-CSF可以直接刺激上皮细胞、血管内皮细胞和其他修复细胞,促进其增殖、分化。
既往研究表明,GM-CSF具有刺激免疫干细胞增殖的作用,GM-CSF 作为重要的免疫增强剂,应用于严重感染以及化放后等免疫低下患者,取得了良好的效果[7]。GM-CSF可以促进烧伤创面的再上皮化和血管生成,从而促进更快速的创面恢复[8]。在创面愈合过程中,诱导中性粒细胞和巨噬细胞成熟和迁移、刺激和编码其他炎症因子及细胞生长因子(表皮细胞生长因子、血管内皮生长因子、血小板源性生长因子、成纤维细胞生长因子等)的基因表达和蛋白质合成,通过这些因子作用于修复细胞,从而达到促进创面愈合的效应,机制可能与促进成纤维细胞增殖及胶原的表达有关[9]。此外,EGF组与GC组在第7天及第10天换药时疼痛评分均低于对照组,这可能与凝胶剂具有良好的生物相容性,不刺激伤口,保护好新生组织,加速创面愈合,能延长药物的释放和扩散,安全、耐受性好,且具有良好的机械性能[10-11],以及在促进创面愈合后,疼痛刺激较少有关。
在本研究中,除了EGF组和对照组各有一例感染外,3组均为见严重并发症,表明rhGM -CSF凝胶与rhEGF凝胶具有一定安全性,并且能够抑制瘢痕增生,提高愈合质量。rhGM -CSF比rhEGF更能加速创面愈合,并且具有减轻换药时疼痛,使用时方便、安全等特点,临床上值得应用。
——栽培注意事项

