肝硬化患者胃肠激素水平与消化道症状积分的相关分析
鲁申奥 陈艳 靳江 郭虹 张英剑 刘晓敏
肝硬化为肝脏疾病的终末阶段,当肝硬化进展至失代偿期时,多数肝硬化患者除严重肝功能损伤及常见并发症外可出现一个或多个胃肠道症状[1]。目前国内外对于肝硬化肝功能受损与胃肠功能障碍间关系的相关研究报道结论不一。本研究通过回顾性分析肝硬化患者胃肠激素水平的变化与消化道症状积分,探讨肝硬化患者胃肠功能紊乱与肝硬化程度的关系。
对象与方法
1.对象:选取2014年10月~2015年8月我科收治的肝硬化患者95例为肝硬化组,其中男66例,女29例,年龄20~75岁,平均年龄(53.31±12.76)岁。纳入标准:(1)符合国际肝病协会制定的《慢性乙型病毒性肝炎防治指南》和《慢性丙型病毒性肝炎防治指南》中肝炎肝硬化的诊断标准[2];(2)符合2010年《酒精性肝病诊疗指南》[3]中关于酒精性肝硬化的诊断标准。排除标准:(1)消化道溃疡、幽门梗阻、既往消化道手术史;(2)特殊原因引起的胃及十二指肠疾病;(3)妊娠期、哺乳期;(4)精神分裂症或不能配合检查及治疗;(5)内分泌疾病;(6)合并恶性肿瘤;(7)合并多器官功能衰竭。按照Child-Pugh肝功能分级表[4],再将肝硬化组患者分为肝功能A级组(45例)、肝功能B级组(23例)、肝功能C级组(27例)。纳入同期我院健康体检者40例作为对照组(NC组),其中男25例,女15例,年龄23~70岁,平均年龄(50.58±11.41)岁。肝硬化组与NC组受试者性别、年龄比较差异均无统计学意义(P>0.05),具有可比性。所有受试者7天内均未服用影响胃肠动力或胃酸分泌药物。本研究已通过我院伦理委员会批准。
2.方法:对肝硬化组患者进行Child-Pugh肝功能分级、消化道症状积分评定,对所有受试者行胃肠激素水平测定。消化道症状积分评定参照LIFE评分[5],结合临床症状,按无、轻、中、重4个程度,分别给予0~3分的评分,而后将各项评分相加为总分。采用酶联免疫吸附试验(ELLSA)检测血清胃泌素(GAS)、胃动素(MTL)及血管活性肠肽(VIP)水平。
结 果
1.肝硬化组与NC组受试者血清GAS、VIP及MTL水平比较:肝硬化组患者血清GAS、VIP水平均明显高于NC组,MTL水平低于NC组(P<0.05)。见表1。
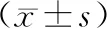
表1 肝硬化组与NC组受试者血清GAS、MTL及VIP水平比较
2.不同肝功能分级组与NC组受试者血清GAS、VIP及MTL水平比较:肝功能C级组患者血清GAS、VIP水平均高于肝功能A级组、B级组及NC组,但血清MTL水平均低于肝功能A级组及NC组(P<0.05)。不同肝功能分级的3组患者血清GAS水平均高于NC组,血清MIL水平均低于NC组,肝功能B级组、C级组患者血清VIP水平均高于NC组(P<0.05)。见表2。
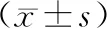
表2 不同肝功能分级组及NC组血清GAS、MTL及VIP水平比较
3.不同肝功能分级组患者消化道症状积分比较:肝功能A级组、B级组、C级组患者消化道症状积分依次上升,分别为(1.71±1.41)分、(3.13±1.71)分、(7.96±1.89)分,两两比较差异均有统计学意义(P<0.05)。
4.肝硬化患者消化道症状积分、Child-Pugh肝功能分级与胃肠激素水平的相关分析:Pearson相关分析结果显示,肝硬化患者消化道症状积分、Child-Pugh肝功能分级与血清GAS、VIP水平呈正相关,与血清MTL水平呈负相关(P<0.05)。见表3。肝硬化患者Child-Pugh肝功能分级与消化道症状积分呈正相关(r=0.837,P<0.001)。

表3 肝硬化患者消化道症状积分、Child-Pugh肝功能分级与胃肠激素水平的相关性分析
讨 论
随着疾病的进展,肝硬化患者除肝损害症状逐渐加重外,通常伴随着其他系统或器官的诸多并发症。据目前研究表明,约80%的肝硬化患者伴1个或多个胃肠道的症状,其中44%的患者出现腹胀,21%出现腹痛,28%出现腹泻,7%出现便秘[1]。研究表明肝硬化患者出现胃肠功能障碍可能与胃肠激素分泌异常相关,胃肠道的严重症状与肝脏疾病的严重程度有关[6]。同时部分研究认为,胃肠动力障碍不仅是肝硬化的常见并发症,同时也是导致肝硬化肝损害程度加重进展的重要原因之一[7]。
胃肠道系统由神经和体液因素共同参与、相互作用,其中体液调节在胃肠道运动的调节中起着至关重要的作用。肝脏作为胃肠激素灭活的主要代谢器官及部分胃肠激素的靶器官,在胃肠激素的代谢中起着重要作用。因此肝硬化时肝功能受损,肝脏生物转化能力降低,导致患者血浆胃肠激素变化,进一步对机体产生影响,进而表现为肝硬化患者胃肠道动力异常。国内外多数研究表明,肝硬化患者普遍存在以胃排空障碍、反流性食管炎为主要临床表现的胃肠道运动功能紊乱症状[8]。生理状态下GAS具有促进消化液分泌、收缩食管胃括约肌、胃及小肠平滑肌、胆囊平滑肌、促进胃肠道排空等作用。VIP主要生理功能是舒张胃肠道平滑肌,包括食管括约肌、胃的容受性扩张及肛门内括约肌的松弛等,进而导致胃排空延缓、抑制小肠的运动,同时也可抑制胃液分泌;而食管下括约肌松弛、食管抗反流屏障功能障碍是造成胃食管反流病的主要发病机制。本研究显示,肝硬化组患者血清GAS、VIP水平较NC组明显升高,且随着Child-Pugh肝功能分级上升而升高,说明肝硬化患者血清GAS、VIP水平升高程度与肝功能损害程度相关;肝硬化患者消化道症状积分与血清GAS、VIP水平呈正相关,进一步证明随着肝功能的逐渐恶化,肝硬化患者消化道症状逐渐加重。MTL具有促进胃肠排空的功能,本研究显示肝硬化患者消化道症状积分、Child-Pugh肝功能分级与血清MIL水平呈负相关,与多数研究结果一致[9],考虑肝硬化患者出现的以胃肠排空能力减弱为主要表现的消化道功能障碍与血清MTL水平降低有关。但也有部分研究显示,肝硬化时血清MTL水平较正常对照组明显升高,考虑主要与胃动素受体的变化相关[10]。
目前国内外多项关于肝硬化胃肠激素水平变化及胃肠功能障碍的相关性研究均对其发生机制进行相应探讨[11]。相关研究结果显示,肝硬化患者胃肠激素水平变化机制主要包括[12]:(1)肝功能受损时,肝脏的生物转化作用减弱;(2)胃肠激素受体数量减少、变性、敏感度减低;(3)肝硬化时胃肠激素的代偿能力升高;(4)肝-肾综合征导致肝肾清除毒素能力减弱,从而使胃肠激素代谢减少;(5)门脉高压侧枝循环的开放导致部分胃肠激素不经代谢直接进入血液循环。肝硬化失代偿期出现门静脉高压导致胃肠道黏膜、血管、屏障结构及神经体液因素出现改变,使得胃肠道结构发生改变,对胃肠功能造成影响。肝硬化患者的胃肠动力障碍导致机体长期处于营养不良的状态,不仅影响肝功能修复,且可加重肝功能损害。
肝硬化患者的胃肠功能障碍与功能性胃肠病(FGID)患者胃肠动力异常的临床表现相似,如均可出现反酸、恶心、呕吐、上腹饱胀不适、腹痛、腹泻、便秘等为表现的临床症状。但FGID的胃肠动力异常主要由精神心理因素导致且不存在器质性疾病,而肝硬化患者以食管动力异常及胃排空障碍等为主要表现的胃肠功能障碍与自主神经病变、胃肠激素紊乱及门脉高压相关的器质性胃肠结构改变等因素密切相关,与FGID食管动力异常与内脏高敏感继发的食管蠕动所致病变发生机制显著不同。但相关研究显示包括内脏高敏感、肠道菌群改变、免疫功能紊乱等在内的多种因素在两种疾病的发生、发展中起着重要作用[13]。
综上所述,肝硬化患者胃肠激素水平紊乱导致胃肠道功能障碍,并与肝脏功能受损程度存在显著正相关,即肝脏损害越重,胃肠道症状表现越明显,消化道积分越高。本研究仅探讨了肝硬化患者空腹血清胃肠激素水平、消化道症状积分与肝硬化程度的关系,包括肝硬化时胃肠道结构器质性改变、免疫屏障受损、炎性介质的释放、菌群失调、合并幽门螺杆菌感染、胃肠道吸收障碍及其他胃肠激素的异常分泌等多种因素对肝硬化患者胃肠功能障碍的影响均未展开讨论;相关影响及机制仍需要进一步研究探讨、证实。

