肠气囊肿症16例临床诊治分析
陈林晖 于祥 陈慧 张旭东
肠气囊肿症(PCI)主要发生于小肠及结肠,以黏膜下或浆膜下形成含气(氢气、二氧化碳、氮气等)囊肿为主要临床表现,发病率约0.03%,临床较为罕见。本研究回顾性分析我院内镜中心确诊的PCI的患者16例的临床资料,以提高临床医生对该病的认知及诊断水平。
对象与方法
1.对象:纳入2013年1年~2020年6月在我院内镜中心行结肠镜和超声内镜检查且确诊为PCI的患者16例,其中男12例,女4例,年龄45~89岁,平均年龄(63.2±11.8)岁。纳入标准:(1)经结肠镜及超声内镜确诊为PCI;(2)内镜检查见肠腔内球状隆起,单发或多发,透明或半透明,黏膜表面光滑完整,予活检钳深部咬取囊壁,隆起塌陷并有气体冒出;(3)超声内镜示病变来源于黏膜下层,呈无回声或低回声改变,固有肌层和浆膜层完整。排除标准:肠源性囊肿,结肠息肉及恶性肿瘤、肠淋巴管瘤。本研究经我院伦理委员会审批通过,所有患者均知情同意。
2.方法
(1)临床资料收集:包括年龄、性别、既往病史、原发疾病、临床症状、病变发生部位、结肠镜及超声内镜下表现。
(2)治疗方法:4例无症状患者未予任何治疗,随访中主诉无不适,1年后复查肠镜显示气囊肿消失。其余12例患者均以腹痛、腹泻为主,予曲美布汀分散片每次0.1 g每日3次、复方嗜酸杆菌片每次0.5 g每日3次、谷氨酰胺肠溶胶囊每次2粒每日3次口服等对症治疗;若合并黏液便、血便、大便常规或血常规发现有白细胞增多的患者,则同时予左氧氟沙星片每次0.1 g每日2次口服;对于内科保守治疗效果不佳的单发PCI患者,予以活检钳夹破、囊肿抽吸术等内镜治疗。
(3)疗效评估标准:经治疗1年后随访,如患者腹痛、腹胀、腹泻等临床症状缓解或消失达3个月以上,或复查内镜示气囊肿病灶较前缩小或消失,评估为治疗有效。
结 果
1.临床资料:16例患者中60岁以上者占62.5%(10/16),81.3%(13/16)的患者继发于其他基础疾病,如胃肠道手术、2型糖尿病、消化道溃疡、肠道息肉等;25.0%(4/16)的患者无任何临床症状,75.0%(12/16)的患者有腹痛、腹泻、腹胀等表现。病变发生于横结肠者最多,占50.0%(8/16),其他依次为升结肠(37.5%,6/16)、乙状结肠(12.5%,2/16)。
2.结肠镜及超声内镜下表现:结肠镜检查发现单发气囊肿患者12例(75.0%),主要表现为单发泡状气囊肿,活检钳压之变形;多发气囊肿4例(25.0%),结肠镜下可见呈葡萄状或串珠样气囊肿及围绕肠腔的鹅卵石样气囊肿。超声内镜下可见病灶起源于黏膜下层,呈无回声改变,局部可见分隔。见图1。
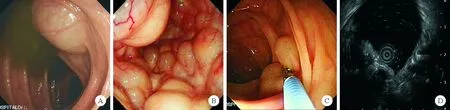
图1 PCI患者结肠镜及超声内镜下表现(A:单发的泡状气囊肿;B:多发葡萄状气囊肿;C:活检钳压之变形;D:病灶起源于黏膜下层,呈无回声改变,局部可见分隔)
3.治疗方案及预后:4例患者予临床观察,12例患者给予结肠镜下囊肿抽吸术、囊肿夹破及药物治疗。随访6个月~5年,94%(15/16)的患者完全缓解,1例(6.3%)患者预后欠佳,仍有腹胀、间断血便。16例PCI患者临床特点及治疗情况见表1。
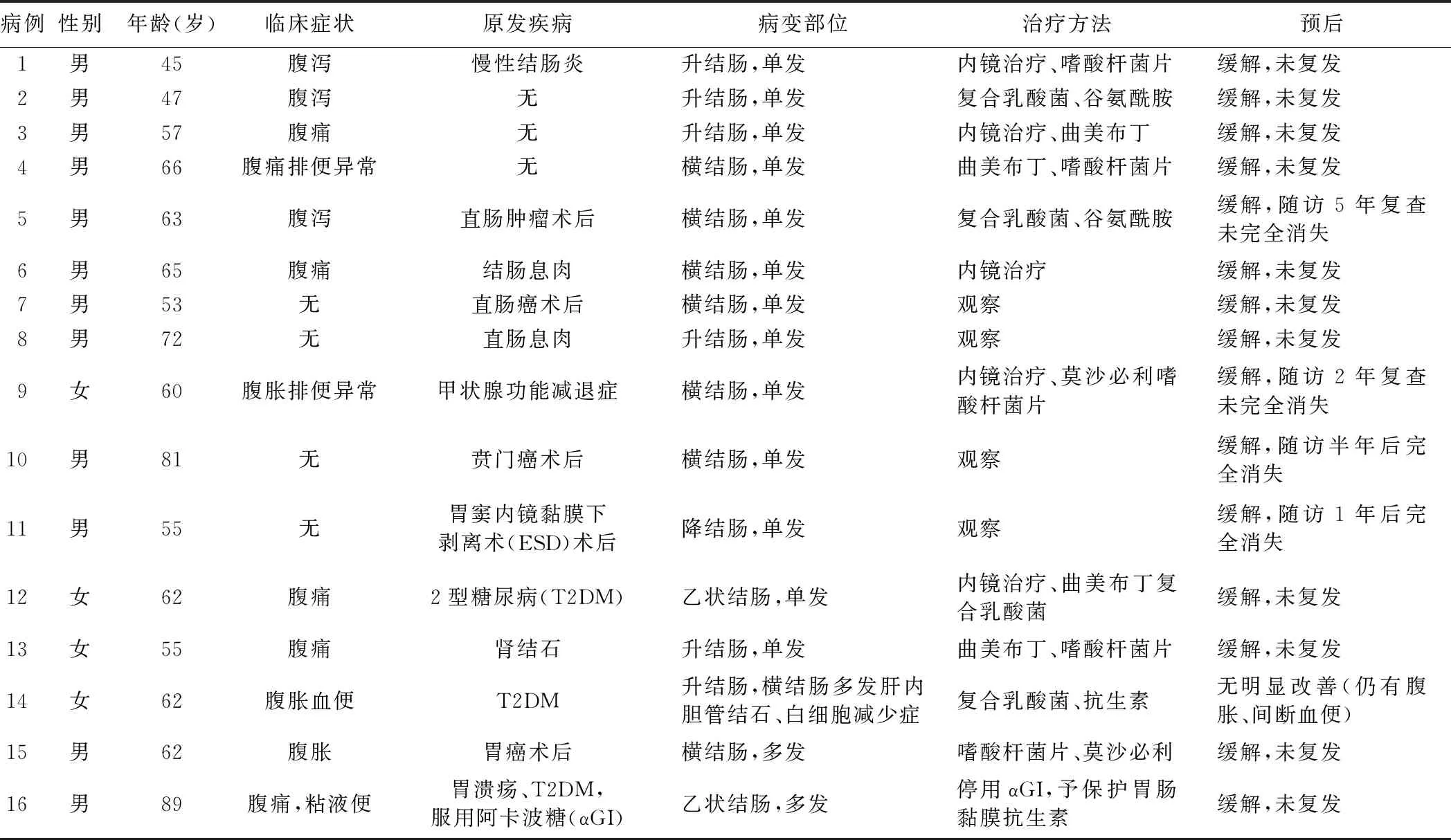
表1 16例PCI患者临床特点及治疗情况
讨 论
根据病因,PCI可分为原发性和继发性:约15%的患者可能与接触三氯乙烯有关,称为原发性PCI;其余85%的患者多继发于其他疾病,如消化道溃疡、肠息肉、肠道手术、支气管哮喘、自身免疫性疾病、血液肿瘤等,称为继发性PCI[1]。本病临床较少见,随着内镜技术的广泛开展,其检出率逐渐上升。国内有研究显示,随着年龄增长,PCI发病率逐渐增加[2]。本研究中,60岁以上的患者达62.5%,可能与老年患者基础疾病较多,易形成继发性PCI有关。目前PCI确切的发病机制尚不明确,可能的推测如下:(1)肠道通透性增加:如肠道炎症、梗阻、肠黏膜缺血、肠镜检查等导致肠黏膜损伤,肠道通透性增加,肠腔压力增加,气体积聚;(2)肺源性疾病:如慢性阻塞性肺疾病、肺气肿、间质性肺炎等,肺泡破裂,肺泡内空气泄漏,通过纵隔、腹膜后到达肠黏膜下,造成气囊肿;(3)营养不良:营养不良者肠道内碳水化合物吸收障碍,被细菌分解后产生大量气体,造成结肠下气囊肿;(4)肠道细菌感染:当肠黏膜屏障受损,某些产气菌如肠道梭状芽孢杆菌、大肠杆菌等可进入肠壁内产生气体;(5)化学物质和某些药物的影响:某些服用分子靶向药物如舒尼替尼、奥西替尼、贝伐单抗的肿瘤患者罹患PCI的概率增加,可能与药物使用过程中肠道不良反应增加、免疫屏障缺陷有关。某些肝移植术后的儿童有发生PCI的倾向,可能与类固醇激素的使用有关[3]。胡梦成等[4]搜集分析相关病例结果显示长期口服α糖苷酶抑制剂致PCI的患者数量呈增加趋势,且发病风险和累及效应与年龄呈正相关;(6)淋巴管扩张:由于淋巴管上皮细胞破裂后被组织细胞及巨细胞包埋,从而引起淋巴管内气体扩张,形成肠气囊肿。
本研究中,有4例患者PCI继发于胃肠道手术,推测手术中的机械损伤致胃肠道黏膜受损,气体进入胃肠黏膜形成气囊肿。病例9号继发于甲状腺功能减退症,推测该患者由于原发病致肠道神经病变、动力不足和功能障碍,肠道气体积聚,形成气囊肿。病例16号服用阿卡波糖2年,推测由于肠腔内糖类大量积聚,细菌分解后产生大量气体,加之合并胃溃疡胃肠道动力差,肠腔内压增高,气体进入肠黏膜下形成积气囊肿。
PCI可发生于全消化道,但以结肠最为多见。部分患者无任何症状,部分可有腹泻、腹胀、大便习惯改变等非特异性消化道症状,临床主要依靠肠镜、超声内镜、腹部CT等检查确诊。国内研究发现,肠单发气囊肿好发于升结肠、横结肠,临床表现有腹痛、腹泻倾向;多发气囊肿则主要见于升结肠、乙状结肠、降结肠,有腹痛、肿瘤标记物升高倾向[1]。本研究中,肠道单发气囊肿多见于横结肠、升结肠,与上述研究一致。
目前对于PCI的治疗尚无统一方案,结合国内外文献,总结经验性治疗方案如下:(1)接触三氯乙烯的原发性PCI患者,应脱离接触环境;无症状及基础疾病者,无需特殊治疗,约50%的患者可自愈。(2)内科保守治疗,是非手术治疗的首选方法,包括积极治疗原发病、胃肠减压、调整饮食结构、避免产气类及油腻生冷食物、停用可疑药物、调节肠道菌群、促进肠黏膜修复、使用抗生素等。(3)高压氧治疗,是目前公认的治疗PCI的有效方案:2~3个大气压下,1~2小时/天,治疗时间为1周~1个月,大部分患者可获得治愈[5]。(4)内镜治疗,可行内镜下高频电切除、活检钳夹破、穿刺针穿刺排气、无水酒精注射等治疗。但考虑到肠道气囊肿中可能存在甲烷等易爆气体,因谨慎使用氩气刀切除。(5)手术治疗,当并发急性肠系膜缺血、肠道穿孔、梗阻时,需要行外科手术干预。(6)中医中药:结合中医辩证方法,给予破气消积、活血逐瘀、健脾渗湿、消肿散结等验方,疗效显著,一般预后良好[6]。本研究中,我们对4例无症状患者未予任何治疗,随访中无不适主诉,1年后复查结肠镜显示气囊肿消失。该4例患者继发于胃肠道手术后,且均为单发气囊肿,因此建议对于继发于术后的单发无症状PCI患者以临床观察为主。本研究中,对于以腹痛、腹泻为主的患者,予曲美布汀、嗜酸杆菌片、谷氨酰胺等对症治疗;合并黏液便、血便、大便常规或血常规发现有白细胞增多者,则同时予喹诺酮类抗生素口服;对于内科保守治疗效果不佳的单发PCI患者,予活检钳夹破、囊肿抽吸术等内镜治疗,效果较好。本研究中对4例患者予临床观察,11例予内镜及药物保守治疗后,大部分取得良好疗效,症状完全缓解。但病例14号因合并2型糖尿病、白细胞减少症及肝内胆管结石病史30余年,治疗效果欠佳,这可能与其病史较长、免疫调节功能差、胃肠道动力异常等有关。国外报道也指出,PCI如合并脓毒血症,血气分析提示pH值<7.3,碳酸氢盐水平<20 mEq/L,乳酸水平>2 mmol/L,淀粉酶水平>200 μ/L和影像学检查提示门静脉积气时,死亡风险增加[7]。这也提示我们,在临床工作中,需对腹痛、腹泻等非特异性消化道症状提高警惕,以期早期发现,正确诊断,合理治疗,从而改善预后,提高患者生活质量。
综上所述,PCI发病率低,多继发于胃肠道手术、糖尿病、消化性溃疡等疾病,尤其是老年人群,临床症状无特异性。因此,对于此类患者出现腹痛、腹胀、腹泻等症状时,应常规进行内镜检查。早期发现,正确诊断,及时治疗,是改善PCI预后的关键。

