铅暴露对肥胖小鼠皮质铁死亡影响的实验研究
陈小君 孟淑娟 庞淑兰 王伟轩 张艳淑
1华北理工大学公共卫生学院 河北唐山 063210;2曹妃甸区临港医院;3唐山弘慈医院病理科
铅是广泛存在于生活和工作环境中的有毒颗粒物,可以通过呼吸道进入机体,造成中枢神经系统损伤,表现为学习记忆能力和神经功能降低,出现焦虑抑郁等神经行为[1]。肥胖与遗传高度相关[2],不仅是心血管疾病、糖尿病和癌症的诱发形式,也为肥胖症与神经系统疾病的关系和机制研究提供新契点。研究表明肥胖与情绪症状和认知功能障碍的高患病率相关,也是心血管疾病、糖尿病等疾病并发症的主要危险因素[3]。关于铅暴露对神经损伤的机制一直以来存在多种说法。有报道铅暴露可导致氧化应激,进而损伤神经细胞,导致细胞凋亡[4]。铁死亡(ferroptosis)于 2012年由Dixon SJ等[5]发现,是一种依赖于铁和活性氧并以脂质氧化为特征的、不同于细胞凋亡的新类型的细胞死亡方式。细胞铁死亡在细胞内谷胱甘肽过氧化酶4(GLutathione peroxidase 4,GPX4)、Xc-、GCH1等抗氧化系统被药物学或者遗传学手段抑制时发生[6]。GPX4以谷胱甘肽(Glutathione,GSH)为还原剂,催化脂质过氧化物还原成对应的醇,从而保护细胞免受脂质过氧化损伤。胱氨酸/谷氨酸逆蛋白转运体Xc-系统由催化亚基SLC7A11和伴侣亚基SLC3A2组成,SLC7A11属于溶质载体家族成员的一种,其介导的胱氨酸和谷氨酸的摄取和释放过程在抑制氧化反应和维持氧化应激条件下的细胞存活中发挥关键调节作用。丙二醛(Malondialdehyde,MDA)是脂质过氧化的终产物,可作为机体抗氧化潜能的一个重要指标,可以反映生物机体经历脂质过氧化速率和强度,与神经损伤的严重程度密切相关。研究表明,铁死亡可以导致许多神经系统疾病[7]。但是铅暴露引起肥胖小鼠皮质铁死亡未见报道。本研究以铅暴露肥胖小鼠为模型,分析铁死亡中抗氧化系统相关氧化损伤指标,探讨铅暴露对肥胖小鼠皮质铁死亡的影响,以期为铅暴露神经损伤的防治提供新的思路。
1 材料与方法
1.1实验动物及处理 雄性成年C57小鼠48只,动物证号:SCXK(京)2020-004。按照体质量随机分为4组,即对照组、铅暴露组、肥胖组和铅暴露+肥胖组,每组12只小鼠。其中对照组、铅暴露组小鼠分别给予自由饮水、250mg/L醋酸铅饮水,肥胖组、铅暴露+肥胖小鼠除给予高脂饲料外,分别给予自由饮水、250mg/L 醋酸铅饮水。以肥胖组与铅暴露+肥胖组小鼠平均体质量不低于对照小鼠平均体质量的120%,判定肥胖模型小鼠造模成功。染毒时间为 24周。本研究经华北理工大学实验动物伦理委员会审查批准。
1.2神经行为检测
1.2.1旷场试验(Open field test,OFT) 该试验用于评价铅暴露对实验小鼠自主学习及探究行为的影响。将木制立方体箱(50cm×50cm×50cm)内壁涂黑,底板划分成16个小方格,沿墙的12个方格为外周格,其余4个为中央格。实验中,每次将一只小鼠放在正中央,摄像机记录3min内小鼠在中心格停留时间、运动总路程、穿格次数、直立次数和排便粒数。每只小鼠结束观察后用75%的酒精擦拭箱内壁以清理其气味和排泄物,以免影响下次实验。
1.2.2高架十字迷宫试验(Elevated plus maze,EPM) 该试验能使动物既产生探究的冲动也产生恐惧,能较好地反映动物的焦虑情绪。将动物置于迷宫中央,头朝向封闭臂区,用摄像器记录其活动情况。记录每只实验小鼠5min内的开臂进入次数(OE)与闭臂进入次数(CE),开臂进入时间( open arm time, OT)和闭臂进入时间( close arm time, CT)。开臂次数百分比(OE%)=开臂次数/(开闭次数+闭臂次数),开臂停留时间百分比(OT%)=开臂停留时间/(开臂停留时间+闭臂停留时间)。

1.4实验小鼠血清中甘油三酯(T-CHO)和总胆固醇(TG)的含量的测定 实验动物染毒结束后,麻醉处理,眼球取血入1.5mL离心管,静置后离心取血清冻存于-80℃冰箱备用。应用ELISA法测定血清中T-CHO、TG的含量(试剂盒来自南京建成生物研究所)。
1.5实验小鼠皮质中氧化损伤指标的检测 动物染毒结束后,于冰盒上取皮质组织,冻存于-80℃冰箱备用。取皮质组织,加裂解液,制作10%的组织匀浆,离心取上清液。①应用ELISA法检测组织中铁、GSH和MDA含量。ELISA试剂盒来自南京建成生物研究所。②应用Wester-Blot进行皮质中GPX4和SLC7A11 蛋白表达的检测:将皮质组织以1mg:7.5μL比例加入适量预冷的RIPA裂解液(含1%蛋白酶抑制剂PMSF),冰上匀浆,4℃,12000r/min,离心半径6cm,离心30min,取上清于离心管并置于-20℃保存。以BCA法进行蛋白浓度定量。蛋白变性。SDS聚丙烯酰胺凝胶配制。电泳。转膜。应用Image J软件定量分析条带光密度值。SDS-PAGE凝胶制备试剂盒来自Solarbio生命科学公司,GPX4抗体和SLC7A11抗体来自Affinity生物科技公司。

2 结果
2.1铅暴露对肥胖小鼠肥胖指数和脂肪系数的影响 与对照组比较,肥胖组和铅暴露+肥胖组小鼠的肥胖指数、脂肪系数均明显升高,差异有统计学意义(P<0.0)。见表1、图1。

表1 铅暴露小鼠脂肪系数和肥胖指数的变化

图1 各组小鼠脂肪系数和肥胖指数的变化
2.2铅暴露对肥胖小鼠T-CHO、TG的影响 对照组相比,肥胖组和铅暴露+肥胖组中小鼠血清中T-CHO、TG含量均显著升高,差异有统计学意义(P<0.05)。未见铅暴露+肥胖组与肥胖组小鼠血清中T-CHO、TG含量有明显差异。见表2、图2。
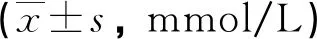
表2 铅暴露对肥胖小鼠血清T-CHO、TG的影响

图2 各组小鼠血清T-CHO、TG的变化
2.3铅暴露对肥胖小鼠神经行为的影响
2.3.1铅暴露对肥胖小鼠空间学习记忆功能的影响 在旷场试验中,铅暴露组和铅暴露+肥胖组小鼠中央区域停留时间明显低于对照组和肥胖组,而铅暴露+肥胖组小鼠中央区域停留时间又显著高于铅暴露组;与对照组和肥胖组比较,铅暴露组和铅暴露+肥胖组小鼠站立次数明显减少,肥胖组小鼠站立次数高于铅暴露组,差异有统计学意义(P<0.05)。见表3、图3。

表3 铅暴露对肥胖小鼠中央区域停留时间和站立次数的影响
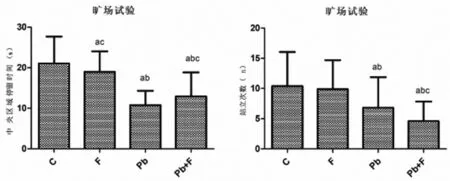
图3 铅暴露后肥胖小鼠学习记忆能力的变化
2.3.2铅暴露对肥胖小鼠焦虑抑郁症状的影响 在高架十字迷宫试验中,肥胖组、铅暴露组和铅暴露+肥胖组小鼠进入开放臂次数比例均低于对照组,铅暴露组和铅暴露+肥胖组小鼠在开放臂停留时间比例均低于对照组和肥胖组,差异均有统计学意义(P<0.05)。见表4、图4。

表4 铅暴露对肥胖小鼠进入开放臂次数和时间的影响

图4 铅暴露后肥胖小鼠焦虑抑郁状态的变化
2.4铅暴露对肥胖小鼠皮质氧化损伤相关指标的影响
2.4.1铅暴露对实验小鼠皮质中Fe、GSH和MDA含量的影响 与对照组比较,肥胖组和铅暴露+肥胖组小鼠皮质中Fe和MDA含量均升高,GSH含量降低;与肥胖组比较,铅暴露+肥胖组小鼠皮质中铁和MDA含量升高,GSH含量降低;与铅暴露组比较,铅暴露+肥胖组小鼠皮质中MDA和GSH含量均发生明显变化,差异均有统计学意义(P<0.05),而Fe含量没有明显差异。见表5、图5。

表5 铅暴露肥胖小鼠皮质中Fe、GSH和MDA含量变化

图5 各组小鼠皮质中Fe、GSH和MDA含量变化
2.4.2铅暴露对实验小鼠皮质中GPX4和SLC7A11蛋白表达的影响 铅暴露组、肥胖组和铅暴露+肥胖组相较于对照组,小鼠皮质中GPX4和SLC7A11 蛋白表达降低,(P<0.05)。与肥胖组比较,铅暴露组和铅暴露+肥胖组小鼠皮质中GPX4和SLC7A11 蛋白表达均降低,且铅暴露+肥胖组小鼠皮质中GPX4和SLC7A11 蛋白表达降低更明显(P<0.05)。见图6。

图6 铅暴露肥胖小鼠皮质中GPX4、SLC7A11 表达变化
3 讨论
本研究以高脂饮食和醋酸铅饮水成功建立了铅暴露肥胖小鼠模型,通过检测皮质铁含量和GSH抗氧化系统的蛋白变化,初步阐明了铅暴露对肥胖小鼠皮质铁死亡的影响。神经行为试验结果表明,铅暴露加剧了肥胖小鼠的神经行为损害,包括学习记忆能力和探究能力降低、焦虑抑郁症状增加。铅暴露+肥胖组相较于肥胖组,实验小鼠皮质中Fe和MDA含量升高,GSH含量降低,并且铅暴露+肥胖组小鼠皮质中MDA和GSH含量变化更加明显,并有加剧趋势;肥胖组、铅暴露组、铅暴露+肥胖组实验小鼠皮质GPX4和SLC7A11 蛋白表达均低于对照组,且铅暴露组和铅暴露+肥胖组中小鼠皮质中GPX4和SLC7A11 蛋白表达也低于肥胖组,铅暴露+肥胖组降低更为明显。铅暴露肥胖小鼠的焦虑抑郁程度加重,铅暴露+肥胖组小鼠皮质中铁和MDA含量升高、GSH含量显著降低,铅暴露+肥胖组小鼠皮质中GPX4和SLC7A11 蛋白表达显著降低。提示铅暴露可能加剧肥胖小鼠皮质铁死亡。
长期慢性铅暴露可导致空间学习忆能力下降、焦虑抑郁等神经行为变化,肥胖也与神经精神疾病有关,但是铅暴露是否加剧肥胖实验动物神经行为改变及其有关机制的研究较少。本研究对实验小鼠的神经行为进行测试,旷场试验结果显示,肥胖小鼠以及肥胖小鼠铅暴露后,中央区域停留时间及站立次数降低,提示铅暴露导致小鼠的学习记忆和探究能力下降,与Ho等[8]的报道的一致。高架十字迷宫试验结果显示,小鼠在经铅暴露24周后,开放臂次数比例及停留时间比例都低于对照组;Louise等将2005~2015年纳入瑞典儿童肥胖治疗登记册的12507人(6~17岁),与其相匹配的对照人群进行比较,发现肥胖是儿童和青少年焦虑抑郁重要的危险因素,本研究结果也表明肥胖小鼠的焦虑抑郁状态增加,提示铅暴露可导致实验小鼠出现焦虑抑郁状态,而铅暴露肥胖小鼠表现出更强烈的焦虑抑郁状态。
铁死亡是一种因铁离子大量蓄积,伴随脂质过氧化发生的程序性死亡方式,以 GSH耗竭、铁离子和脂质氧化产物MDA增加为主要特点,涉及许多分子事件,包括心肺损伤[9]、肿瘤[10]和神经退行性疾病[11-12]。本研究对实验小鼠皮质中GSH、Fe和MDA进行测试,结果发现实验小鼠皮质中铁和MDA含量均升高,GSH含量降低。为进一步探究皮质铁死亡的相关机制,我们检测了铅暴露小鼠、肥胖小鼠和铅暴露肥胖小鼠的皮质铁死亡标志性分子蛋白SLC7A11和GPX4的表达水平,以探讨铅暴露对肥胖小鼠皮质铁死亡的影响。SLC7A11作为胱氨酸/谷氨酸逆向转运体( xc-系统)中重要组成,调控胱氨酸在细胞内和细胞外之间的转换,而胱氨酸是合成 GSH 的重要的蛋白原料[13]。由于 SLC7A11 蛋白表达受到干扰或抑制可能造成GSH合成不足,从而导致GPX4活性下降,GPX4通过降解某些脂质过氧化物,抑制脂质过氧化。本研究结果显示,肥胖组、铅暴露组和铅暴露+肥胖组小鼠皮质中GPX4和SLC7A11表达均降低,而肥胖组小鼠在增加铅暴露后,皮质中SLC7A11和 GPX4表达降低更明显。GPX4 表达降低,导致脂质氧化产物MDA增加, GSH合成降低。
综上所述,铅暴露和肥胖均可引起实验小鼠的焦虑抑郁症状,而铅暴露可增加肥胖小鼠的焦虑抑郁症状,这些可能由于铅暴露加剧了肥胖小鼠皮质铁死亡。

