MLR、RDW对AECOPD合并肺炎的早期预测价值研究
闵沛 景琴 付爱双 侯琳琳 姜娇 邵东风 戈艳蕾
华北理工大学附属医院呼吸内科 河北唐山 063000
慢性阻塞性肺疾病简称慢阻肺,是一种以不可逆的气流受限为特点、多见于老年人群的消耗性疾病,据推测至2030年成为全球第三大死亡原因[1]。慢性阻塞性肺疾病急性加重(acute exacerbation of chronic obstructive pulmonary disease,AECOPD)是导致慢阻肺患者死亡的主要原因,临床多以咳嗽、咳黄痰、痰液量增加、呼吸困难等症状为临床表现,并且需要反复住院或调整药物治疗;最常见诱因是感染,约占50%~75%[2]。呼吸道感染使病情反复急性加重,肺功能进行性下降,严重威胁患者生活质量及生命,同时免疫力下降,容易并发肺部感染[3]。肺炎是慢阻肺患者住院主要原因,也是老年患者重要死亡原因之一[4]。因此识别早期AECOPD合并肺炎对控制病情及预后非常关键,临床上需要寻找简单、易得的生物指标来帮助临床医生快速识别早期AECOPD合并肺炎的患者。
临床上发现许多指标可应用于疾病诊断、治疗及预后判断。目前常用的血液指标有:中性粒细胞、降钙素原、血清淀粉酶样蛋白。但这些指标均为单一指标,同时受许多因素影响,例如:首先降钙素原受甲状腺疾病影响[5],其次降钙素原对非细菌感染肺炎(比如:病毒、真菌)诊断价值较小,最后已有文献证明降钙素原在诊断AECOPD合并肺炎价值一般[6];中性粒细胞易受吸烟、年龄、运动等因素影响;血清淀粉酶样蛋白受动脉粥样硬化、肝脏疾病影响[7]。因此上述常用血液生物指标在AECOPD合并肺炎诊断方面有一定局限。
随着对生物指标研究深入发现,单核细胞绝对数与淋巴细胞绝对数比值(Monocyte-lymphocyte ratio,MLR)作为一个复合指标,受检测方法等因素影响小,评估更加稳定。有研究发现MLR是存在冠心病的独立危险因素,且与冠状动脉病变严重程度呈正相关[8]。国外文献记载MLR也可作为早期卒中相关性肺炎的预测因子之一[9],有研究已证明MLR在AECOPD患者中明显升高[10]。红细胞体积分布宽度(Red blood cell distribution width,RDW)是一种反应机体炎症及疾病严重程度、预后的指标。已有文献证明在AECOPD患者中,随着RDW升高其死亡风险增加[11],同时有研究证明RDW升高与社区获得性肺炎患者的病死率升高有关[12]。本研究旨在探讨MLR、RDW对AECOPD合并肺炎的早期预测价值。
1 资料与方法
1.1一般资料 收集2019年6月~2020年1月于华北理工大学附属医院呼吸科住院的AECOPD患者332例作为研究对象。根据是否合并肺炎,将其分为肺炎组152例、非肺炎组180例。本研究经华北理工大学附属医院伦理委员会审核通过。
1.2诊断及排除标准
1.2.1COPD诊断标准 2020年《慢性阻塞性肺疾病全球倡议》指南:有相关临床症状及危险因素者应怀疑患有COPD,需完善肺功能检查,应用支气管扩张剂后第一秒用力呼气量(Forced expiratory volume 1, FEV1)/用力肺活量(Forced vital capacity, FVC)<70%,可确定存在持续性气流受限,同时除外其他具有特征性的气流受限的疾病(如:支气管扩张症、肺结核、严重间质性肺病变、弥漫性或闭塞性细支气管炎)即诊断为COPD。
1.2.2AECOPD诊断标准 COPD的患者以呼吸道症状恶化(典型表现为:呼吸困难加重、咳嗽加剧、痰量增多和/或痰液呈脓性)为特征的临床事件,其症状变化程度超过日常变异范围并导致药物治疗方案改变。
1.2.3肺炎诊断标准 2016年制定《中国成人社区获得性肺炎诊断和治疗指南》中的诊断标准:①在院外发病。②肺炎相关临床表现,症状表现:新近出现的咳嗽、咳痰或原有呼吸道症状加重,伴或不伴脓痰、发热、胸痛、呼吸困难及咯血;体征表现:肺部实变体征或/和闻及湿性啰音;实验室检查:外周血白细胞>10×109/L或<4×109/L,伴或不伴细胞核左移。③胸部影像学检查提示新出现的斑片状浸润影、叶或段实变影、磨玻璃影或间质性改变,伴或不伴胸腔积液。符合①、②及③中任何一项,并除外肺结核、非感染性肺间质性疾病、肺部肿瘤、肺栓塞、肺不张、肺嗜酸粒细胞浸润症、肺水肿及肺血管炎等后,可建立临床诊断。
1.2.4排除标准 先天性心脏疾病、脑卒中、自身免疫性疾病、血液系统肿瘤等可能影响相关临床指标的患者、临床资料不齐全患者。
1.3方法
1.3.1一般资料 性别、年龄、住院时间、体质量指数(BMI)、高血压、冠心病、糖尿病
1.3.2血液参数指标 淋巴细胞绝对值(Lym)、单核细胞绝对值(Mon)、中性粒细胞绝对值(NE)、RDW、血小板体积分布宽度(PDW)、红细胞沉降率(ESR)、MLR。MLR(MLR=单核细胞绝对值与淋巴细胞绝对值的比值)。
1.3.3实验室检测 患者入院24h内抽取空腹静脉血5mL,30min内送检,使用Sysmex X-E-2100血液分析仪检测血常规,自动血沉测定仪检测ESR。

2 结果
2.1AECOPD合并肺炎组与非肺炎组基线资料比较 两组性别、年龄、BMI、高血压、冠心病、糖尿病、PDW比较差异无统计学意义(P>0.05);两组住院时间、Mon、Lym、RDW、NE、MLR、ESR比较差异有统计学意义(P<0.05)。见表1、2。

表1 两组基线资料比较(例)

注:()内数据为四分位数间距。

表2 两组间血常规相关指标及ESR指标比较

注:()内数据为四分位数间距。
2.2AECOPD合并肺炎影响因素的二分类Logistic回归分析 二元Logistic回归分析显示:随着MLR升高,AECOPD合并肺炎的风险增加(OR=21.898,95%CI:1.121~427.864,P<0.05);随着RDW增加,AECOPD合并肺炎风险降低(OR=0.556,95%CI:0.446~0.692,P<0.05)。见表3。

表3 AECOPD合并肺炎影响因素二分类Logistic回归分析
2.3MLR、RDW及两者联合检测ROC曲线图 预测AECOPD合并肺炎的ROC曲线分析结果显示:MLR的曲线下面积(AUC)为0.731(95%CI:0.676~0.785,P<0.001),最佳截止值为0.312,敏感度为66.4%,特异度为69.4%;RDW的AUC为0.735(95%CI:0.680~0.790,P<0.001),最佳截止值为12.35%,灵敏度为61.8%,特异度为83%;二者联合的AUC为0.784(95%CI:0.734~0.834,P<0.001),最佳截止值为0.473,灵敏度为67.8%,特异度为78.3%;见图1。
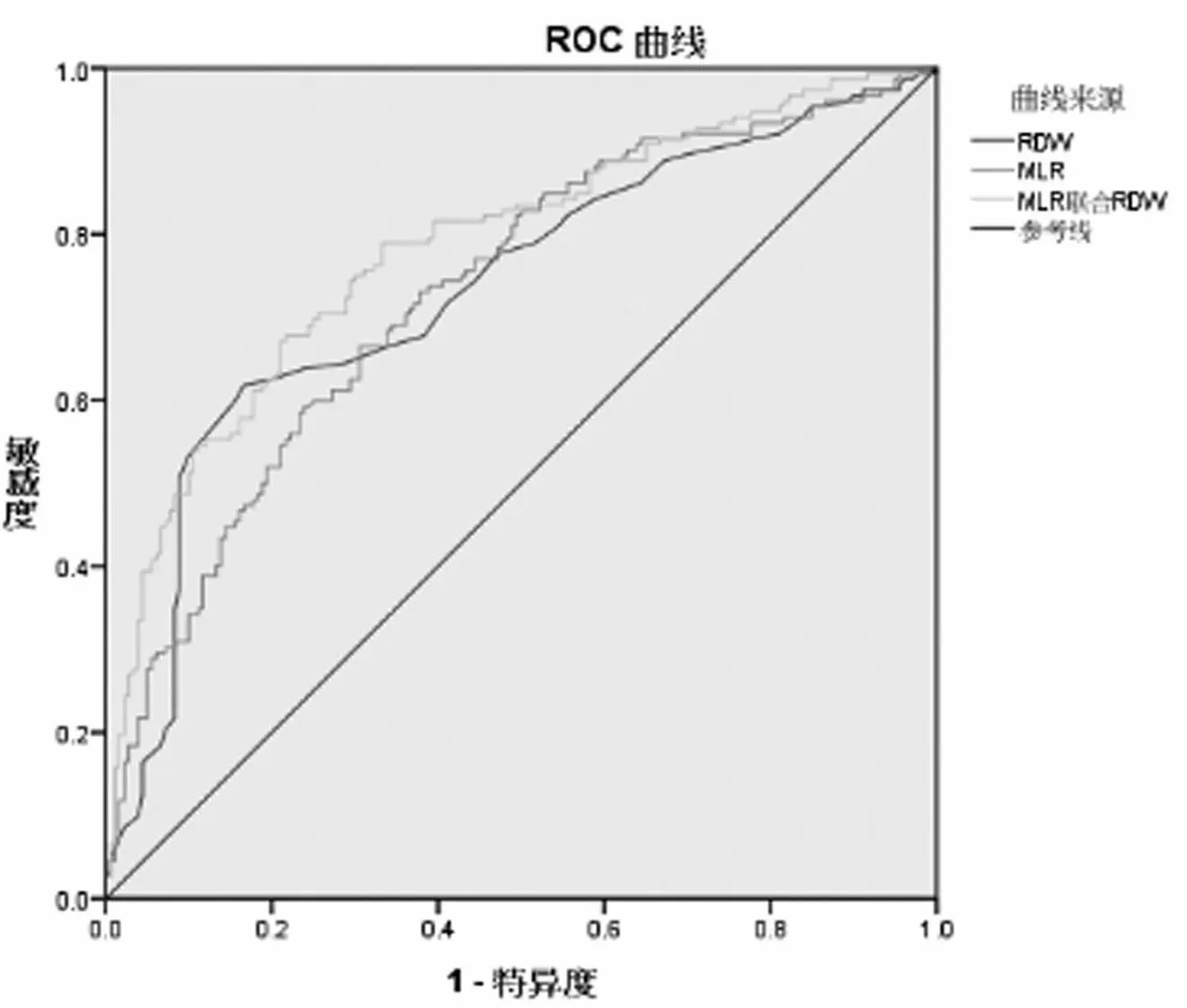
图1 MLR、RDW及两者联合预测AECOPD合并肺炎的AUC
3 讨论
慢阻肺反复急性加重导致肺功能逐渐恶化,患者生活质量降低、住院频率增加、经济负担加重、病死率增加。有研究显示AECOPD的主要诱因为感染,其中40%~50%为细菌感染[2];同时慢阻肺患者免疫功能和呼吸道防御能力下降,更容易发生肺炎。有研究证明因AECOPD入院的患者中有16%~36%合并肺炎,AECOPD合并肺炎患者临床症状严重、发病率高、预后差[3]。临床诊断肺炎的主要方法为影像学检查,如胸部X线片、CT,但大多数危重症患者和基层医院不能及时进行影像学检查,单凭症状结合体征做出的诊断误诊率高,并且部分患者并无明显影像学改变。影像学检查对及时诊断AECOPD合并肺炎存在较大局限性。相较于影像学检查,血液生物标志物更方便、易得、及时。
随着生物指标研究深入,发现MLR、RDW可能成为诊断慢阻肺及肺炎的潜在生物标志物。MLR已经被广泛应用于预测多种疾病严重程度,已有研究证明MLR在判断多种肿瘤及自身免疫相关疾病的严重程度方面有其临床应用价值,如:肺癌[13]、格林-巴利综合征[14]。同时发现RDW也可反应全身炎症情况并与多种疾病严重程度及预后有关。有研究显示随着RDW升高成人肺炎的病死率随之增加[15]。另有研究报道,AECOPD患者RDW异常组的病死率明显高于正常组,AECOPD患者住院时间延长与RDW增加有关[16]。
据我们所知,目前尚无MLR、RDW在早期识别AECOPD合并肺炎方面的研究。本次研究证明MLR及RDW对早期的AECOPD合并肺炎诊断有一定意义,可作为早期识别慢阻肺合并肺炎的生物学指标。虽然MLR、RDW对多种疾病诊断、严重程度评估有关,但该指标所涉及的病理生理机制尚未完全清楚。
COPD发病机制中较为重要的是炎性机制,肺部上皮细胞受到外界因素刺激,如:吸烟、灰尘等,释放肿瘤坏死因子、白细胞介素、粒细胞-巨噬细胞集落因子趋化单核细胞、中性粒细胞聚集,增多单核细胞反向促进单核细胞趋化肽、肿瘤坏死因子等趋化因子释放,这使COPD患者循环中的单核细胞明显高于正常人[17]。AECOPD常为呼吸道病毒、细菌等原因引发气道炎症恶化,趋化因子大量释放,趋化单核细胞大量聚集,因此认为AECOPD患者中单核细胞明显高于健康人中的单核细胞,同时AECOPD患者外周的淋巴细胞明显凋亡。Yao等[10]研究中发现,AECOPD患者MLR水平(0.53±0.36)比健康组(0.23±0.07)明显升高,差异有统计学意义(P<0.001)。上述AECOPD的发病机制及Yao的研究结果证明MLR对AECOPD诊断价值。肺炎是各种因素导致肺泡、肺间质、终末支气管炎症,主要因素为病原体,常见呼吸道病毒、肺炎链球菌、流感嗜血杆菌、非典型病原体等。当病原体进入机体后,机体产生防御机制,产生大量单核细胞和巨噬细胞吞噬并消灭病原体。肺部感染时,血中的单核细胞增加,增加情况与病情严重程度相关。随后在2017年Naess等[18]证明病原体为细菌的发热患者其MLR较高(0.43±1.03),相反,病原体为病毒的患者其MLR较低(0.05±0.30)。Huang等[19]研究显示,社区获得性肺炎患者MLR升高。Wang等[20]研究显示,MLR在肺炎克雷伯杆菌肺炎中随着其感染程度增加而升高。上述研究表明MLR是肺炎独立危险因素。本研究证明MLR是AECOPD合并肺炎的独立危险因素(OR=21.898,95%CI:1.121~427.864,P<0.05),单独用于诊断AECOPD合并肺炎的AUC为0.731,敏感度(66.4%)及特异度(69.4%)表明均不高,表明单独应用价值有限。
RDW是一种衡量红细胞体积异质性的指标,反映了红细胞不均匀的程度。据多项研究证明,RDW水平的升高在COPD患者中较为常见,具体研究机制尚未明确,与多种原因有关[21]:①缺氧是影响RDW的重要因素,COPD患者以进行性呼吸困难为主要症状,长期低氧血症在COPD患者中广泛存在,由于慢性缺氧的刺激会促进肾皮质分泌大量促红细胞生成素,不仅会促进晚幼红细胞的生成,同时也会加速幼稚红细胞的释放,这导致血液循环中的红细胞体积相差较大,RDW随之升高。因此,高RDW值可能是组织缺氧的标志;②氧化应激所产生的炎症因子,如肿瘤坏死因子、白细胞介素1、白细胞介素6等均会抑制红细胞的成熟和生长,而COPD是一种以慢性炎症为特征的消耗性疾病,当合并肺炎时,细菌、病毒等病原体入侵,大量炎症因子生成并释放至血液循环中,加速红细胞的破坏、缩短红细胞的寿命,这也是慢性炎症性贫血的重要机制[22]。但在本研究中发现,随着RDW增加,AECOPD合并肺炎风险降低(OR=0.556,95%CI:0.446~0.692,P<0.05),与已有结果相悖。可能与多种原因有关:本研究患者可能存在潜在胰腺疾病、胃炎、胃癌、结肠癌、肾病、慢性血栓性疾病间接影响RDW[23-24],可能有既往吸烟病史,同时也受样本量、选择偏倚的影响。因此单独RDW预测AECOPD合并肺炎时结果不准确。
MLR联合RDW预测AECOPD合并肺炎的AUC为0.784(95%CI:0.734~0.834,P<0.001),敏感度为67.8%、特异度为78.3%,比单独MLR、RDW预测的价值高。
本研究存在的局限性:样本量有限,为一项回顾性单中心研究,可能存在偏差,后续应进行前瞻性研究来验证本结果。同时我们仅使用单次MLR、RDW的参数值,不能动态观察该值变化,需要进一步的多中心的对照研究,以验证MLR、RDW及二者联合对AECOPD合并肺炎的临床价值。

