基于mtDNA D-loop部分序列的软刺裸裂尻鱼遗传多样性分析
杨朝杰,高强,刘丹,聂苗苗,王发艳,李柯懋,赵宏,张存芳*,祁得林*
(1.青海大学省部共建三江源生态与高原农牧业国家重点实验室,西宁 810016;2.青海大学农牧学院,西宁 810016;3.青海省渔业技术推广中心青海省渔业环境监测中心,西宁 810012;4.青海多美生态环保科技有限公司,西宁 810003)
软刺裸裂尻鱼属鲤形目Cypriniformes鲤科Cyprinidae裂腹鱼亚科Schizothoracinae裸裂尻鱼属,属高原冷水性鱼类,主要分布于青藏高原长江水系上游宽谷河段或海拔较高的河流中,跨流域扩散能力较弱、生长速度相对缓慢,与其他裂腹鱼亚科鱼类具有相同特点;该物种为产区内主要的经济鱼类(武云飞,1992;丁瑞华,1994;He&Chen,2007)。气候变化、栖息地破坏和人类活动等因素限制了种群的发展(祁得林,2009;王太等,2017)。因此,开展软刺裸裂尻鱼保护生物学研究,对其种群管理和恢复具有重要意义。
目前,软刺裸裂尻鱼的相关研究集中在仔鱼生长发育、年龄鉴定、系统发育学等方面(Yu,2006;沈丹舟等,2007;胡睿等,2012),遗传多样性、种群遗传结构方面的研究报道较少,且集中在金沙江和雅砻江水系的种群。mtDNA具有进化速度较快、严格的母系遗传、几乎不发生重组等特点(Avise&Ferguson,1995),在种群遗传多样性、系统发育和系统地理学等方面的研究中得到广泛应用(Levin,2017;Biun,2021;Parmaksiz,2021)。Liu等(2009)采用mtDNA控制区序列分析了宝兴裸裂尻鱼的遗传多样性。Li等(2020)采用微卫星和mtDNA控制区序列联合分析了沙鲁里山脉金沙江和雅砻江软刺裸裂尻鱼的系统地理学。长江上游通天河段干流及支流的软刺裸裂尻鱼野生群体的种群结构情况等未见报道。本文通过mtDNA控制区序列分析了玉树软刺裸裂尻鱼的遗传多样性和种群遗传结构,为其资源管理和保护提供理论依据。
1 材料与方法
1.1 样本采集
软刺裸裂尻鱼样品于2019年9月采自青海省玉树藏族自治州隆宝滩国家级自然保护区(LBT)、巴塘河上游(UBR)和巴塘河下游(LBR),共3个种群72尾。野外采样时使用挂网和地笼进行捕捞,随机挑选体质量、体长相近的个体,LBT的平均体长、体质量分别为33 cm、424 g,UBR的平均体长、体质量分别为23 cm、95 g,LBR的平均体长、体质量分别为21 cm、74 g。每个样品取肌肉或鳍组织2 g置于无水乙醇中固定保存后带回实验室进行分析。
1.2 基因组DNA提取、PCR扩增及测序
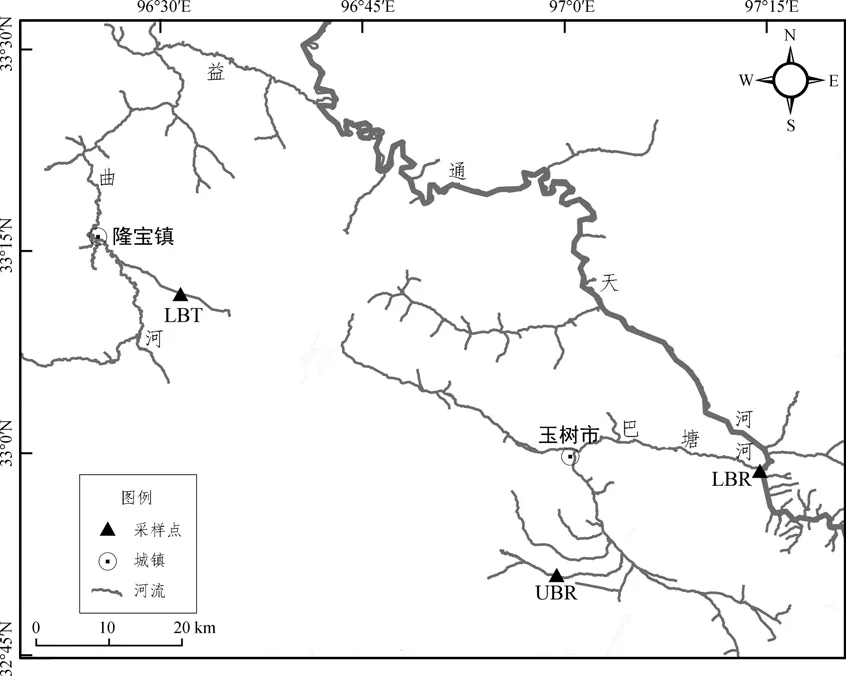
图1 青海玉树软刺裸裂尻鱼采样点Fig.1 Sampling sites of Schizopygopsis malacanthus in Yushu,Qinghai
利用酚-氯仿法从肌肉或鳍组织中提取mtDNA,D-loop序列扩增引物为:GEDL200:5’-CACCCCTGGCTCCCAAAGCCAG-3’;GEDH860 5’-AGGGGTTTGACAAGAATAACAGGA-3’(Zhao,2011),由上海生工生物工程技术公司合成。25μL PCR 反应体系:12.5 μL 2×Taq PCR Master Mix,10 mmol·L的2 条引物各 1 μL,模板 DNA 1 μL,双蒸水 9.5 μL。PCR反应条件:95 ℃ 4 min;95℃30 s,55℃ 30 s,72 ℃ 90 s,32个循环;最后72℃5 min。PCR产物经琼脂糖凝胶电泳检测后送上海生工生物工程技术公司纯化并测序,测序引物为扩增引物。所有单倍型序列提交至Gen-Bank(登录号为:OL870962~OL870977)。
1.3 数据分析
利用DNASTAR和DNAMAN对测序结果进行人工校对(Burland,2000),用MAFFT进行多序列比对(Katoh&Standley,2013),使用MEGA11.0计算核苷酸组成,以同亚科的澜沧裂腹鱼、厚唇裸重唇鱼、青海湖裸鲤、花斑裸鲤、拉萨裸裂尻鱼、温泉裸裂尻鱼、黄 河 裸 裂 尻 鱼、前腹裸裂尻鱼为外群,基于邻接法(NJ)构建系统发育树(Tamura,2021),自举检验1 000次。利用DnaSP 6.0分析每个地理种群的单倍型数、多态位点数、单倍型多样性指数、核苷酸多样性指数、种群间净遗传距离和核苷酸错配分布(Rozas,2003)。利用Arlequin计算群体间的遗传分化指数(F)、估计群体内遗传变异情况,计算基因流[=(1/F-1)/2](Hudson.,1992);进行Tajima’s和Fu’s中性检验(Tajima,1989;Fu,1997;Excoffier& Lischer,2010)。利用Popart基于中接法(median-joining)绘制单倍型最小网络关系图(Leigh&Bryant,2015)。
2 结果
2.1 序列特征
获得同源序列的最终长度为610 bp,包含29个核苷酸变异位点(简约信息位点26个、单突变位点3个)。D-loop序列A、T、C、G碱基平均含量分别为32.8%、32.1%、19.3%、15.9%,A+T含量(64.9%)明显高于G+C含量(35.2%)。
2.2 遗传多样性和单倍型分布
软刺裸裂尻鱼3个地理种群基于mtDNA D-loop序列的单倍型多样性为0.438~0.676,核苷酸多样性为0.003 4~0.008 6。其中,LBT的单倍型多样性最高(0.676±0.076),UBR的核苷酸多样性最高(0.008 6±0.001 3)(表1)。共检测到16个单倍型,其中,H10由UBR和LBR共享,H8在UBR中出现次数最多,H4在LBR中出现次数最多,H2在LBT中出现次数最多(图2)。

表1 软刺裸裂尻鱼样本信息及遗传多样性指数Table 1 Sample information and genetic diversity index of Schizopygopsis malacanthus
2.3 种群分化与分子系统发育
LBR与LBT间的遗传距离最远(0.023 3);UBR与LBR间的最近(0.002 1)。3个种群间的为0.087 3~1.465 3,UBR 与LBR的为 1.465 3,UBR、LBR与LBT的分别为0.108 0和0.087 3。UBR与LBR的F最低(0.254 4);UBR、LBR与LBT的分别为0.822 4和0.851 4;两两群体之间均呈现极显著差异(表2)。
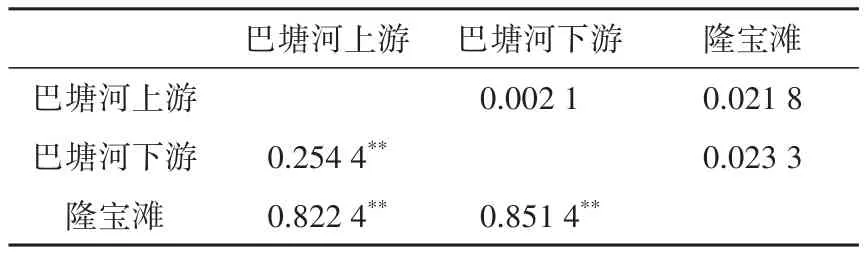
表2 软刺裸裂尻鱼种群间遗传分化系数(对角线下)及种群间净遗传距离(对角线上)Table 2 The fixation index(below diagonal)and net genetic distance(above diagonal)between Schizopygopsis malacanthus populations
将软刺裸裂尻鱼看做一个地理种群时,79.49%的遗传变异位于不同采样点的种群间,20.51%的遗传变异位于种群内,且群体间遗传分化差异极显著(F=0.794 9;<0.001)。按照水系分组,不同组间的遗传变异占74.40%,组内群体间的遗传变异占8.05%,不同群体内的遗传变异占17.55%(表3)。

表3 软刺裸裂尻鱼单倍型的分子变异等级分析Table 3 Hierarchical analysis of molecular variance of haplotypes of Schizopygopsis malacanthus
单倍型序列的系统发育树显示,软刺裸裂尻鱼3个种群的单倍型在系统发育树上大体分为2支,分别对应隆宝滩国家级自然保护区和巴塘河水系(图2)。中接法构建的单倍型网络图显示,相邻2个单倍型之间经过1~5步突变,巴塘河水系2个种群的单倍型呈混杂分布,2个种群之间存在共享单倍型,与LBT之间没有共享单倍型(图3)。单倍型网络图进一步支持了系统发育树的分析。

图2 3个软刺裸裂尻鱼种群16个D-loop单倍型的NJ树及在其中的分布Fig.2 NJ tree of 16 D-loop haplotypes and haplotype distribution among 3 Schizopygopsis malacanthus populations
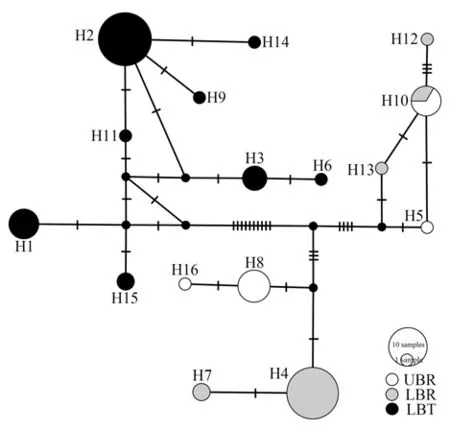
图3 软刺裸裂尻鱼mtDNA D-loop序列单倍型网络Fig.3 Haplotype network of mtDNA D-loop sequence of Schizopygopsis malacanthus
2.4 种群扩张
Tajima’s和Fu’s结果显著性检验差异均不显著(表4),核苷酸错配分布曲线均显示为多峰(图4)。
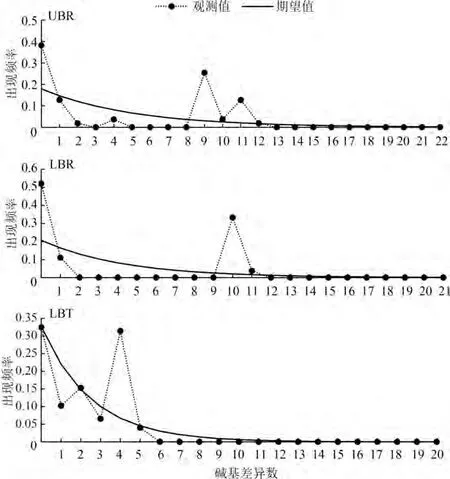
图4 软刺裸裂尻鱼群体错配分布曲线Fig.4 Mismatch distribution of the Schizopygopsis malacanthus
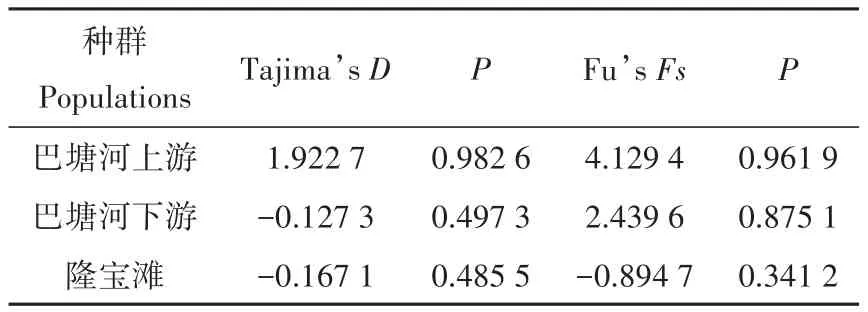
表4 软刺裸裂尻鱼中性检验Table 4 Neutral test of the 3 Schizopygopsis malacanthus populations
3 讨论
种群遗传学分析表明,分布于青海省玉树州隆宝滩国家级自然保护区和巴塘河水系的软刺裸裂尻鱼3个种群的D-loop序列均表现出明显的AT偏倚,与其他裂腹鱼类的研究结果相似(张争世等,2017);单倍型多样性和核苷酸多样性比宝兴裸裂尻鱼遗传多样性丰富,这可能与现存种群大小有关(Liu,2009);整体低于同亚科鱼类塔里木裂腹鱼和齐口裂腹鱼,也低于其他鲤科鱼类(Perdices,2004;海萨·艾也力汗等,2016;张争世等,2017),可能是由于第四纪以来青藏高原经历了多次地质和气候变化,这些环境变化可能使高原鱼类经历了数次瓶颈效应,导致群体内遗传变异丢失,该结论与同亚科黄河裸裂尻鱼及青海湖附近水系中裸鲤的研究结果一致(Zhao,2005;Qi,2007)。在本研究的3个地理种群中,LBT的单倍型多样性最高,核苷酸多样性低于其他2个种群,可能是长期的地理隔离导致种群数量减小引起遗传漂变,使遗传多样性降低;LBR的单倍型多样性和核苷酸多样性均较低,巴塘河下游靠近玉树市区,可能与栖息环境发生改变、人类活动影响有关。
LBT和巴塘河水系2个群体之间的F值较高,表明LBT和其他2个群体之间的遗传分化较大,形成了显著的地理结构,该结果得到种群间净遗传距离和基因流分析的支持。尽管巴塘河水系上、下游2个种群之间也具有显著的遗传分化,但是巴塘河水系2个种群之间的>1,2个种群之间具有较低的净遗传距离,暗示这2个种群基因交流广泛;AMOVA分析显示,无论将软刺裸裂尻鱼看做一个地理种群,还是按照不同水系分组分析,都表明软刺裸裂尻鱼的遗传变异主要来自不同地理种群之间,而不是种群内;3个软刺裸裂尻鱼种群按照隆宝滩国家级自然保护区和巴塘河水系形成2个类群,巴塘河水系2个种群之间未形成明显的地理种群结构,单倍型NJ树和进化关系网络分析也支持这一结果。地质资料表明,断裂带走滑运动导致玉树地区古河流改向,隆宝滩周围地区形成分水岭,中心区域形成断陷盆地,从而形成现今巴塘河水系,并且在隆宝滩国家级自然保护区与巴塘河之间形成天然地理屏障(李跃华等,2013;吴中海等,2014;于洋等,2018)。如果群体处于扩张状态或经历过种群扩张事件,其非重组DNA区域错配分布曲线为平滑单峰曲线(Harpending,1994);软刺裸裂尻鱼的种群扩张分析表明,玉树软刺裸裂尻鱼在近期历史上群体大小保持稳定,未经历显著的种群扩张事件。
本研究结果表明,软刺裸裂尻鱼3个种群整体遗传多样性均较低,而由于LBT和巴塘河水系上、下游2个种群之间存在显著的遗传分化,建议将巴塘河水系上、下游2个种群和LBT作为2个进化显著单元分开进行管理保护。

