σNS蛋白与宿主TRAM1因子互作对鸭呼肠孤病毒复制的影响
刘志艺,米晓云,黄 聪,李传峰,陈宗艳
(中国农业科学院 上海兽医研究所,上海 200241)
鸭呼肠孤病毒(duck reovirus,DRV)是当前养鸭业健康的重要致病因子之一。该病毒属于呼肠孤病毒科正呼肠孤病毒属,其核酸由双层蛋白质衣壳包裹,直径为75~80 nm,其基因组由10个节段组成,分别为3个长节段(L1、L2、L3),3个中节段(M1、M2、M3)和4个小节段(S1、S2、S3、S4)。σNS是由S4基因节段编码的非结构蛋白,是单链RNA(ssRNA)结合蛋白,必须在感染细胞中表达以产生病毒后代,作为RNA稳定因子促进病毒基因组复制。TRAM1因子(translocation-associated membrane protein 1),是一种内质网(ER)膜糖蛋白,与内质网应激反应密切相关,在内质网应激反应中起缓解ER压力的作用,并且是参与生成新生多肽链过程中的必需成分,参与新生多肽链的异位过程,在促进紧密核糖体连接形成中也起重要作用。
前期通过病毒感染细胞原代鸭成纤维细胞后的蛋白组学实验发现,DRV感染细胞后,TRAM1是表达水平差异较大的宿主因子之一。那么,TRAM1蛋白是否与DRV σNS蛋白存在相互作用,其相互作用对DRV-TH11的复制是否有影响,本文通过GST pull-down、免疫共沉淀(Co-IP)、过表达及抑制表达等实验来阐释这一科学问题。
1 材料与方法
1.1 质粒、病毒及细胞
pCMV-Myc-σNS、p3x-10-Flag-TRAM1质粒均由本实验室构建、保存。鸭呼肠孤病毒TH11毒株(duck reovirus,DRV-TH11)由本实验室分离保存。BHK-21细胞由本实验室保存,Trans5α、BL21感受态细胞购自全式金公司。
1.2 主要试剂
限制性内切酶HⅠ(货号:R0136S)和Ⅰ(货号:R0146S)购自NEB公司。T4 DNA连接酶(货号:M1801)、MLV反转录试剂盒(货号:M1701)均购自美国Promega公司。Co-IP(货号:26148)、GST pull-down(货号:21516)均购自美国Thermofisher公司。GST、Myc、Flag标签抗体、HRP标记的山羊抗鼠IgG均购自北京康为世纪生物科技有限公司。RNA提取试剂盒(货号:B618583)购自生物工程股份有限公司。实时荧光定量PCR(qRT-PCR)试剂盒(货号:R211-01)购自南京诺唯赞生物科技有限公司。
1.3 σNS原核表达载体的构建及表达与纯化
1.3.1 σNS原核表达质粒的构建
根据本实验室前期测定序列结果,即GenBank 登录号JX826589设计σNS引物,并在上游引物5′端引入HⅠ酶切位点,下游引物5′端引入Ⅰ的酶切位点,引物由上海生工合成。引物序列F-σNS:5′-CTGGTTCCGCGTGGATCCATGGACAACACCGTGCGT-3′,R-σNS:5′-ACGATGCGGCCGCTCGAGCTACGCCATCCTGGCTGG-3′,目的片段为1 139 bp。以pCMV-Myc-σNS质粒为模板,反应体系为模板1 μL、上下游引物各2 μL、LA酶25 μL、DEPC水补齐至50 μL。反应条件为95 ℃ 30 s;95 ℃ 10 s,57 ℃ 1 min,35个循环;72 ℃10 min。将与预期目的片段一致的PCR扩增产物胶回收后双酶切,并与HⅠ-Ⅰ双酶切的pGEX-4T-1连接,连接产物转化至DH5α感受态细胞,待LB平板上长出单克隆菌落后,挑取单克隆菌落酶切及测序鉴定,鉴定正确的质粒命名为pGEX-4T-1-σNS。转化至表达细胞(BL21)中,同时转化pGEX-4T-1质粒至感受态细胞(BL21)中作为对照。
1.3.2 σNS蛋白的表达与纯化
鉴定正确的pGEX-4T-1-σNS质粒转化至感受态细胞BL21中,同时转化pGEX-4T-1质粒至其中作为对照。菌液培养至为0.6~0.8,加入IPTG诱导,使IPTG终浓度分别为0.5 mmol·L和0.2 mmol·L。超声破碎后取上清和沉淀进行考马斯亮蓝染色拍片和Western blot(WB)分析。随后进行GST-σNS表达与纯化,即采用优化后的条件培养诱导并收集菌体,经1/10 体积的裂解液(1 mmol·LEDTA、100 mmol·LNaCl、1% Triton X-100、50 mmol·LTris-base,pH 8.0)裂解。表达的重组蛋白经Glutathione Sepharose TM 4B树脂进行纯化并保存备用。
1.4 Co-IP试验
37 ℃ CO培养箱中培养BHK-21细胞,待密度达80%左右,将pCMV-Myc-σNS和p3x-10-Flag-TRAM1共转染细胞,同时设置两个质粒分别单独转染作为对照组。转染24 h后,使用预冷的改良型杜氏PBS缓冲液洗细胞,随后参照说明书,加入已预冷的IP Lysis/Wash buffer置冰上裂解10 min,离心分别取上清加入到Myc beads柱中。4 ℃过夜孵育后离心,最后用洗脱液洗涤离心,保存滤液,进行后续WB分析。WB实验一抗为Anti-Myc鼠多隆抗体和Anti-Flag鼠多克隆抗体1∶200倍稀释,二抗用HRP标记的山羊抗鼠IgG 1∶2 000倍稀释,利用全自动化学发光图像分析系统(Tanon 5200)进行分析。
1.5 GST pull-down试验
GST pull-down实验步骤参照试剂盒说明书进行并加以优化。主要实验步骤为:将纯化的GST-σNS重组蛋白及其对照加入到GST琼脂糖珠柱。放置4 ℃旋转器孵育过夜,离心后用洗涤液重复清洗柱子5次。将猎物蛋白加入到已经孵育过诱饵蛋白的GST柱,4 ℃过夜孵育,离心弃滤液后重复清洗柱子5次。最后用洗脱液进行洗脱,保存滤液进行Western blot分析。
1.6 检测TRAM1蛋白对DRV复制的影响
沉默TRAM1或过表达TRAM1对DRV复制的影响,TRAM1 siRNA序列由上海吉玛生物有限公司合成。序列如下:5′-CGAUAAUUAUUCAUGCCAUA-3′,5′-UAUGGCAUGAAUAAUUAUCG-3′。将siRNA或pCMV-Myc-σNS质粒转染至BHK-21细胞,37 ℃下培养24 h后感染DRV-TH11。24、36 h后收取细胞,提取总RNA并进行反转录,随后进行荧光定量实验检测病毒的σNS的变化,引物见表1。并设置直接感染病毒的细胞为对照组。

表1 实时荧光定量PCR引物序列
2 结果与分析
2.1 σNS蛋白的表达与鉴定
鉴定正确的pGEX-4T-1-σNS质粒转化至感受态细胞BL21中,以pGEX-4T-1为对照,结果如图1所示,0.5 mmol·L和0.2 mmol·LIPTG分别于37 ℃ 180 r·min诱导4 h后,表达与预期大小一致的66 ku GST-σNS融合蛋白。

M,蛋白Marker;GST,GST空载对照,IPTG的终浓度为0.2 mmol·L-1;GST-σNS-1,IPTG终浓度为0.5 mmol·L-1诱导GST-σNS融合蛋白的表达;GST-σNS-2,IPTG终浓度为0.2 mmol·L-1诱导GST-σNS融合蛋白的表达。
随后对菌体超声破碎后离心取上清,沉淀用等量的PBS重悬,取样进行SDS-PAGE和WB检测。结果如图2所示,GST-σNS蛋白在上清和沉淀中均有表达,随后对其进行大量诱导用于后续试验。

S,上清;I,沉淀。
2.2 免疫共沉淀(Co-IP)试验
用Anti-Flag和Anti-Myc抗体检测Input样品和IP样品,结果如图3所示。Input样品中均能检到Flag-TRAM1和Myc-σNS蛋白,说明其在细胞中均能够表达。在IP样品中,Flag-TRAM1和Myc-σNS共转染的细胞中可以检测到Flag-TRAM1和Myc-σNS这两种蛋白,说明孵育在磁珠上的Myc-σNS蛋白可以沉淀出Flag-TRAM1蛋白。
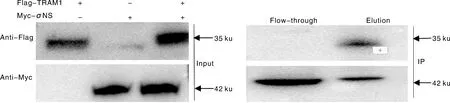
图3 σNS蛋白与TRAM1蛋白互在体外相互作用分析
2.3 GST pull-down试验
如图4所示,以Input样为检测样品,用Anti-GST抗体检测了GST-σNS和GST蛋白,说明两个蛋白均成功表达。在Output实验中,GST-σNS能捕获Flag-TRAM1蛋白而GST蛋白不能捕获,σNS蛋白与TRAM1蛋白在细胞外可以相互作用。

图4 σNS蛋白与TRAM1蛋白在细胞中相互作用分析
2.4 TRAM1蛋白对DRV-TH11复制的影响
用Anti-TRAM1的抗体检测TRAM1的干扰作用,结果显示,TRAM1的干扰RNA能抑制TRAM1的表达,如图5-A所示。之后以表1所示引物进行qRT-PCR,分别检测过表达和抑制TRAM1对病毒复制的影响,结果显示,当抑制TRAM1的表达,24 h时病毒σNS的翻译水平与对照相比没有明显的变化,36 h时σNS的翻译水平得到促进。当过表达TRAM1,24 h时,病毒σNS的翻译水平被抑制,36 h时抑制的效果更加明显(图5-B)。综上所述,TRAM1的表达对DRV-TH11的复制具有影响。
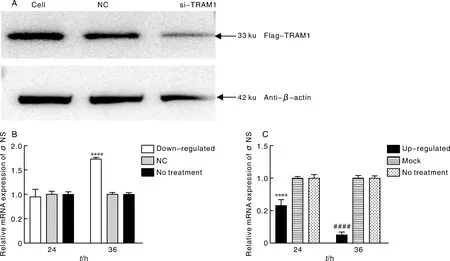
A,siRNA抑制TRAM1的表达;B,抑制TRAM1的表达后,qRT-PCR检测DRV-TH11σNS的转录水平;C,上调TRAM1的表达后,qRT-PCR检测DRV-TH11σNS的转录水平。****,P<0.001;####,P<0.000 1。
3 讨论
禽呼肠孤病毒最初见于水禽的是番鸭,自1997年从南非传入中国后,多在浙江、福建等中国南方地区传播,其病理特征主要表现为肝、脾表面有大量白点以及肾肿大、出血,因番鸭为其易感动物,且具有严格的宿主特异性,并不感染鸭,故命名为番鸭呼肠孤病毒。2011年开始,中国多地的养鸭场中发现了一种脾肿大、出血、坏死的鸭呼肠孤病毒感染的疫情,其死亡率在50%~60%,日龄越小,其发病率和死亡率越高,死亡率在10%~30%。鸭呼肠孤病毒其感染宿主范围广,北京鸭、樱桃谷鸭、番鸭等多种品系的鸭均可被感染。我们对分离的DRV-TH11株全序列测序分析发现,σNS蛋白是一种较小的病毒非结构蛋白,由S4基因阶段编码,能非特异性地与ssRNA结合,在病毒组装的早期发挥作用。内质网是交织分布于细胞质中的膜管道系统,它的主要功能是促进蛋白质的合成、修饰及把正确组装的蛋白转运至其分泌途径或细胞外。内质网作为蛋白质折叠和翻译后修饰的重要场所,是病毒复制和成熟的必需细胞器。病毒感染后,细胞内合成大量的病毒蛋白,从而增加内质网的负担,堆积了大量的未折叠蛋白和错误折叠的蛋白。因此,病毒感染后通常会诱发内质网应激。TRAM1细胞蛋白是一种内质网(ER)膜糖蛋白,与内质网应激反应密切相关,在内质网应激反应中起缓解ER压力的作用,并且是参与生成新生多肽链过程中的必需成分,参与新生多肽链的异位过程。
TRAM1作为经过生物信息学筛选出的在DRV-TH11感染后差异较大的宿主蛋白,研究σNS与宿主蛋白的互作,对揭示病毒致病机制以及阐明病毒在宿主体内的感染、复制周期具有一定的价值。我们使用Co-IP,GST pull-down等实验证实σNS蛋白与TRAM1确实存在相互作用。对1基因进行过表达或沉默,结果显示,1基因过表达可以从翻译水平抑制病毒σNS基因的表达;而降低1基因表达则促进σNS的表达。
本实验首次报道宿主蛋白TRAM1与σNS蛋白的相互作用,初步揭示TRAM1与σNS蛋白相互作用对DRV增殖的影响,为进一步揭示σNS蛋白在宿主体内复制的分子调控机制奠定了基础。

