CysLTR1通路调节铝负荷肝细胞氧化应激及凋亡机制*
铝是自然界中常见的一种元素,大量研究表明铝负荷引起肝脏形态异常和功能障碍
,其损伤的机制可能与氧化应激和炎症反应相关
。研究发现铝通过诱导氧自由基形成,从而引起氧化应激损伤致细胞凋亡
。半胱氨酰白三烯受体1(CysLTR1)与肝细胞损伤过程关系密切,据报道CysLTR1抑制剂孟鲁司特可防止小鼠对乙酰氨基酚诱导的肝损伤
,也有研究发现抑制CysLTR1可以减少肝细胞凋亡保护肠 I/R继发肝损伤
。细胞凋亡是引发肝损伤的重要机制之一
,既往研究发现CysLTR1通路通过调控细胞自噬参与铝负荷肝细胞损伤
。然而CysLTR1通路参与铝负荷肝细胞凋亡的具体机制仍未完全清楚,MK-571是 CysLTR1的特异性受体拮抗剂。本研究旨在通过应用MK-571作用铝负荷肝细胞,探讨CysLTR1通路调节铝负荷肝细胞氧化应激及凋亡机制的作用。
1 材料与方法
1.1 材料 细胞株:HL-7702(L02)为人源正常肝细胞(北纳创联生物公司),RPMI-1640培养基(美国Hyclone),胎牛血清(FBS)(德国Biotech),MTT(美国Genview),MK-571(英国Cayman Chemical),麦芽酚、三氯化铝(国药化工)。ALT试剂盒、AST试剂盒、SOD试剂盒(南京建成),MDA、BCA试剂盒(碧云天),抗体:Bcl-2(博士德,武汉)、Bax(Proteintech,美国)、Caspase3(Abcam,美国)、Caspase9(CST,美国)、GAPDH(Proteintech,美国),二抗购自武汉三鹰生物有限公司。
在汽车发动机电控系统维修、汽车自动变速器维修、汽车电气系统维修等课程过程考核中,引入汽车检测与维修技能大赛的规则评分标准,不仅考核学生的理论知识掌握情况,同时从学生的岗位操作技能、故障分析能力等方面对学生进行综合评价。例如:汽车发动机电控系统维修课程过程考核中设有进气系统电气元件检测、发动机电控系统数据分析、发动机不能起动故障诊断等内容,通过考试模式的改革和考核标准的变更力求实现与岗位技能要求的零对接。
1.2 方法
1.2.1 细胞培养、分组 L02为贴壁细胞,用RPMI-1640(含1%链霉素+青霉素)培养基配置成含10%FBS的培养液,置于5% CO
、37℃恒温孵箱,每24 h换液一次。将培养好的细胞分为3组:正常对照组、铝负荷组[(200 μmol/L Al(malt)3]、MK-571(3 nmol/L)+Al(200 μmol/L)组。
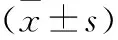
1.2.5 Western Blot检测蛋白表达 按常规方法操作。
2.2 MK-571作用于铝负荷L02肝细胞ALT、AST、SOD和MDA含量变化 见表1。
所谓“就业的时效性”是指学生在毕业就业时要抓住机遇及时就业,在保证就业的前提下通过工作中自身的努力不断提高自己的业务水平,为日后进入更好的领域工作打下坚实的基础。而不要高不成低不就最后耽误自己的前途。
2.3 MK-571对铝负荷L02肝细胞凋亡的影响 图2表明,通过流式细胞术检测,铝负荷L02肝细胞凋亡率较对照组细胞明显增加(
<0.01),而给予MK-571作用后细胞凋亡率较铝负荷组显著降低(
<0.01)。
1.2.2 MTT法测细胞活力 取对数生长期细胞,接种于96孔板中(100 μl/孔),待贴壁后进行药物干预处理。作用36 h后,避光,各孔中加入20 μl MTT,孵箱培养4 h,弃培养液,加DMSO 150 μl,迅速置于避光盒中,放置于水平摇床,充分溶解板中结晶。最后置于光吸收酶标仪,选用490 nm检测光密度(OD)值。
1.2.4 流式细胞术检测细胞凋亡 取对数生长期细胞,接种于六孔板中密度为5×10
个/孔,药物作用36 h后,收集细胞,离心(1 000 r/min×10 min),用冷PBS洗涤,重悬。根据碧云天细胞凋亡试剂盒按操作说明进行染色,采用流式细胞仪检测细胞凋亡。
本文的研究对象是有多种配方,生产炼钢用铁水、铸铁用铁水等多种铁水产品的炼铁厂,本文对所研究的问题作出以下假设:
2 结果
2.1 MK-571对肝细胞L02增殖活力的影响 MK-571干预铝负荷肝细胞L02 36 h后,在3 nmol/L附近有较好的保护的作用(
<0.01,图1A)。由图1B可知在3 μmol/L浓度内对肝细胞增殖活力影响较正常空白对照细胞有差异(
<0.01),而MK-571浓度≤1 μmol/L则不影响细胞的活力。因此选取3 nmol/L作为实验的干预剂量。

1.2.3 检测细胞ALT、AST、SOD、MDA的含量 取对数生长期细胞,每孔接种密度为5×10
个,作用于六孔板中,药物处理36 h后,收集细胞混悬液,离心(1 000 r/min×10 min)及PBS洗2次。最后加PBS冰水浴下超声破碎,收集裂解细胞,充分混匀,测定蛋白浓度。将制备好的细胞匀浆根据ALT、AST、SOD、MDA试剂盒说明书操作。

长期以来,珠江口东西两岸一直面临发展不协调的问题。东岸经济发达,而西岸经济发展相对落后,产业和人口聚集度较低,难以形成规模效益。同时,粤港澳大湾区还面临创新资源分布不均、资源浪费严重、发明创新质量不高、跨境创新合作机制不健全等问题,这些短板限制了粤港澳大湾区的持续发展。

2.4 各组L02 肝细胞中相关蛋白表达水平变化 由图3可知,与正常L02细胞相比,铝负荷细胞中Caspase 3、Caspase 9、BAX蛋白表达显著升高(
<0.05和
<0.01),而Bcl-2显著降低(
<0.01);给予MK-571作用,其蛋白表达Caspase 3、Caspase 9、BAX明显下调(
<0.05和
<0.01),而Bcl-2表达明显上调(
<0.05)。

3 讨论
氧化应激反应在引起机体损伤中发挥重要作用,是生物体的一种应激反应。氧化应激参与肿瘤、炎症和代谢综合征等多种疾病,当机体活性氧(ROS)大量产生,ROS/活性氮的比值增高,不能被机体抗氧化剂作用抵消,扰乱细胞氧化还原失去平衡,导致细胞结构和功能损伤
。据报道金属离子铝可以影响肝脏氧化应激导致肝脏损伤
,课题组前期研究发现200 μmol/L Al(malt)3作用36 h处理L02肝细胞可以有效建立铝负荷肝细胞损伤模型
,因此采用这一造模方法用于本次体外实验研究。
然而,蠕虫状链模型也存在一些不足.由于蠕虫状链用投影长度来表示分子链尺寸,看上去没有用到统计单元数的统计关系,统计单元的多寡仅影响其投影的长度,不影响计算结果,因此可用于描述那些因统计单元数不足而无法用等效自由结合链来处理的分子链.但实际上,不断投影取最后的投影长度的方法也是统计的结果.这种暗含式的统计处理方法很隐蔽,使人们在将其运用到刚性链时没有觉得有什么不妥.
MDA通过氧自由基代谢产生,其含量反映了体系脂质过氧化进展状态
。SOD可以减少脂质过氧化反应,实现抗氧化作用,主要通过歧化作用降低体内过多的氧自由基
,因此SOD水平的高低反映了机体抗氧化能力的强弱。当前结果显示铝负荷L02肝细胞中MDA含量较正常组显著增加、SOD活性显著下降,提示L02肝细胞处于氧化应激损伤状态。CysLTR1受体拮抗剂MK-571(3nmol/L)作用36 h后可以有效降低铝负荷L02细胞中ALT、AST、MDA水平,并提高SOD的水平,减轻了铝负荷引起的L02肝细胞氧化应激反应,使铝负荷细胞的凋亡率明显降低。
细胞凋亡是肝损伤发生的重要机制之一,在细胞凋亡调控过程中Caspase系统及Bcl-2家族在起到关键作用。Ghribi等
研究表明铝诱导的兔子中呈现出上调Bax,下调Bcl-2蛋白的表达趋势。也有研究发现铝可以直接调控Bax以及Bcl-2 mRNA的表达,其与BAX成正相关,而与Bcl-2成负相关
。在Bcl-2家族的中,Bcl-2和Bax分别为凋亡的抑制因子和促进因子,Bcl-2蛋白存在于外部线粒体膜,可以防止凋亡并抑制Bax的激活
。而Caspase-9作为细胞凋亡重要的启动子,当机体氧化应激反应时,通过活化并激活下游Caspase家族凋亡因子,产生级联放大效应,促使细胞发生凋亡
。已有研究表明Caspase3、Bcl-2与铝致肝损伤机制密切相关,铝诱导肝毒性大鼠中Caspase3蛋白表达会显著增加,而Bcl-2蛋白表达降低
。在本次实验中,通过细胞流式技术我们发现给予MK-571可以有效减少铝负荷肝细胞L02凋亡率,并且铝负荷L02肝细胞中蛋白Caspase3、Caspase9和Bax显著上升,Bcl-2表达明显下降。给予MK-571干预后显著下调了铝负荷L02肝细胞中Caspase3、Caspase9、Bax表达,上调了Bcl-2的表达。
[1]Bogdanovic M, Janeva AB, Bulat P. Histopathological changes in rat liver after a single high dose of aluminium[J]. Arh Hig Rada Toksikol, 2008, 59(2): 97-101.
[2]Luo J, Li X, Li X,
. Selenium-Rich Yeast protects against aluminum-induced peroxidation of lipide and inflammation in mice liv-er[J]. Biometals,2018, 31(6): 1051-1059.
[3]Ding Y, Tang J, You X,
. Study on the mechanism underlying Al-induced hepatotoxicity based on the identification of the Al-binding proteins in liver[J]. Metallomics,2019, 11(8):1353-1362.
[4]Yang Y, Wang H, Guo Y,
. Metal ion imbalance-related oxidative stress is involved in the mechanisms of liver injury in a rat model of chronic aluminum exposure[J]. Bio Trace Elem Res, 2016, 173(1):126-131.
[5]Yang Y, He Q, Wang H,
.The protection of meloxicam against chronic aluminium overload-induced liver injury in rats [J]. Oncotarget, 2017, 8(14):23448-23458.
[6]Zahedi-Amiri Z,Taravati A,HejazianL B.Protective effect of rosa damascene against aluminium chloride-induced oxidative stress[J].Biol Trace Elem Res,2018,187:27-127.
[7]Pu S, Liu Q, Li Y,
. Montelukast prevents mice against acetaminophen-induced liver injury[J]. Front Pharmacol, 2019, 10:1070.
[8]吴深宝,朱旭星,王向明,等. 孟鲁司特对大鼠肠缺血再灌注继发肝损伤的保护作用研究[J]. 中国临床药理学与治疗学,2016,21(3):270-275.
[9]Fu JQ, Zhang H, Zhuang Y,
.The role of N-acetyltransferase 8 in mesenchymal stem cell-based therapy for liver ischemia/reperfusion injury in rats[J].PLoS One, 2014, 9(7): e103355.
[10]Hu C, Yang J, He Q,
. CysLTR1 blockage ameliorates liver injury caused by aluminum-overload via PI3K/AKT/mTOR-mediated autophagy activation in vivo and in vitro[J]. Mol Pharm, 2018, 15(5):1996-2006.
[11]Pisoschi AM, Pop A. The role of antioxidants in the chemistry of oxidative stress: A review[J]. Eur J Med Chem,2015, 97:55-74.
[12]巴图德力根,张伟,韩志强,等. 蒙药德都红花7味散对高脂饮食诱导实验性脂肪肝大鼠血脂四项和SOD、MDA 的影响[J].世界华人消化杂志,2015,23(31): 5011-5016.
[13]邓青芳,周欣,陈华国.多糖抗肝损伤作用及其机制研究进展[J]. 中国中药杂志,2016, 41(16): 2958-2967.
[14]Ghribi O, DeWitt DA, Forbes MS,
. Co-involvement of mitochondria and endo-plasmic reticulum in regulation of apoptosis: Changes in cytochrome, Bcl-2 and Bax in the hippocampus of aluminum-treated rabbits[J]. Brain Research, 2001, 903(1-2): 66-73.
[15]Niu Q, Wang LP, Chen YL,
. Relationship between apoptosis of rat hippocampus cells induced by aluminum and the copy of the Bcl-2 as well as bax mRNA[J]. Wei Sheng Yan Jiu, 2005, 34(6):671-673.
[16]Lindsay J, Esposti MD, Gilmore, AP. Bcl-2 proteins and mitochondria-specificity in membrane targeting for death[J]. Biochimica et Biophysica Acta, 2011, 1813(4): 532-539.
[17]Korsmeyer SJ, Shutter JR, Veis DJ,
. Bcl-2/Bax: a rheostat that regulates an anti-oxidant pathway and cell death[J]. Semin Cancer Biol, 1993, 4(6): 320-327.
[18]Mak YT, Chan WY, Lam WP,
. Immunohistological evidences of Ginkgo biloba extract altering Bax to Bcl‐2 expression ratio in the hippocampus and motor cortex of senescence accelerated mi-ce[J]. Microsc Res Techniq, 2006, 69(8): 601-605.
[19]Al-Kahtani M, Abdel-Daim MM, Sayed AA,
. Curcumin phytosome modulates aluminum-induced hepatotoxicity via regulation of antioxidant, Bcl-2, and caspase-3 in rats[J]. Environ Sci Pollut Res Int, 2020, 27(17):21977-21985.

