松嫩平原西部盐碱沼泽生境干扰后的芦苇种群生长响应
安素帮, 杜智鑫, 李晓宇
松嫩平原西部盐碱沼泽生境干扰后的芦苇种群生长响应
安素帮1,2, 杜智鑫1, 3, 李晓宇1,*
1. 中国科学院东北地理与农业生态研究所, 中国科学院湿地生态与环境重点实验室, 长春 130102 2. 宿州学院, 环境与测绘工程学院, 宿州 234000 3. 东北师范大学草地科学研究所, 植被生态科学教育部重点实验室, 长春 130024
松嫩平原西部盐碱沼泽位于半干旱半湿润区。由于自然因素和人类活动干扰, 盐碱沼泽大面积退化, 芦苇种群生境发生改变。为此在松嫩平原西部盐碱沼泽区选择四种不同干扰形成的芦苇生境(湿地、退耕、干旱、稻田退水), 并通过调查营养生长期和有性生殖期的芦苇种群高度、盖度、密度、生物量、叶面积等生长指标, 分析不同干扰生境下的芦苇种群的响应特征。研究结果表明,承接稻田退水水位为30—60 cm的芦苇种群生物量最大(2660 g·m-2), 水位为20—40 cm的湿地芦苇种群最高(2.5 m), 干旱芦苇的密度最大(681株·m-2)。芦苇通过减小叶面积、增加密度和减少有性生殖投入, 来适应干旱条件; 通过调节株高、茎粗以及生殖分配来积极响应水淹条件; 从种群特征来看, 补水足以恢复芦苇种群的高度和生物量, 但稻田退水含有的营养会显著提升芦苇生产力。
盐碱沼泽; 芦苇种群; 稻田退水; 退化沼泽; 退耕; 水文恢复
0 前言
湿地具有环境调节、物种基因保护及资源利用、气候调节、净化水质等多项生态功能, 被誉为“地球之肾”, 是自然界最富生物多样性的生态系统[1]。近几十年来, 由于受人类活动干扰, 如湿地垦殖、污染、城镇化及其他利用方式, 导致湿地大面积下降, 功能也在逐渐退化, 甚至丧失[2]。据数据评估, 自1700年以来全世界已有87%的湿地消失[3]。三江平原的洪泛湿地面积在1950s—2000s的50年内已经下降了80%[4]。自2004年第七届国际湿地会议召开以来, 恢复和重建受损湿地一直是当前国际湿地科学的研究热点。水文恢复[5]、水质恢复[6–7]等被广泛的应用到湿地恢复中。
芦苇种群是世界广泛分布的物种, 其生长范围可以从寒区(纬度范围70°N—143°S), 到热带(-0°)到旱区(北非到澳大利亚中部), 芦苇自然种群生长基质的水分和养分变化较大, 例如矿质养分从1%到97%不等, 表明了芦苇种群极强的环境适应力[8]。芦苇是松嫩平原西部盐碱沼泽的优势物种, 但因为自然和人为因素导致芦苇种群严重退化。过去50年, 沼泽面积从640万 hm2下降到160万hm2, 面积降低了74%[9–10], 盐碱地面积增加了1.73倍; 沼泽生态系统退化是盐碱地面积增大的主要来源之一[11]。研究生境干扰后芦苇种群生长变化对盐碱芦苇种群的有效恢复有一定的指导意义。已有学者研究了水文波动[12, 19]、农艺措施[13]以及湿地农业工程[14]等影响下芦苇种群的生理和生态变化, 表明适当的人为干扰能有效促进退化芦苇种群恢复。稻田退水的研究多倾向于人工湿地植物对其氮磷的净化功能[15]以及对除草剂的降解代谢和迁移转化功能[16–17], 而作为芦苇种群生境的干扰因子的研究较少。因此, 本研究在松嫩平原西部, 以盐碱沼泽湿地为对照, 选取退耕、干旱、稻田排水作为芦苇湿地的三种干扰类型, 调查芦苇的种群生长特征, 探讨芦苇种群对生境干扰后的生长变化, 为退化盐碱沼泽的科学恢复提供理论依据。
1 材料与方法
1.1 研究区域概况和实验设计
研究区设在中国科学院东北地理与农业生态研究所松嫩平原西部盐碱湿地生态研究站—牛心套保苇场(45°13′—45°16′N, 123°13′—123°21′E), 位于吉林省西部大安市大岗子镇, 由霍林河与洮儿河水力运动产生的河间洼地积水形成[13], 面积约33 km2。年均降水量395.7 mm, 年均蒸发量1696.9 mm, 年均无霜期为137 d[18], 是中国内陆典型的芦苇群落分布区之一, 土壤pH 8.5—10.0。
1.2 实验设计
在研究区域内, 以湿地芦苇为对照(HP), 因干旱而退化的芦苇种群(XP), 退耕后形成的芦苇种群(FP)和稻田退水处的芦苇种群(PP)作为三种生境干扰后的芦苇种群(表1),干旱芦苇和退耕芦苇无积水, 湿地芦苇和稻田退水处的芦苇积水水位高于20 cm, 且pH和电导率相对其他两个生境较低, 稻田退水处的土壤有机质和总氮含量高于其他三种生境。

表1 不同生境下芦苇种群的生境特征
1.3 芦苇种群特征的调查方法
在2017年的芦苇营养生长期(7月)和有性生殖期(9月), 分别调查芦苇种群的高度、盖度、生物量、抽穗数、叶面积和茎粗等生长指标。每次采样时, 在每个采样区每个样方随机选取5株芦苇个体, 利用卷尺测量单株高度, 利用数显游标卡尺测量基茎粗, 利用叶面积仪测量第三片展开的新叶面积。每次采样设1 m×1 m样方, 调查种群盖度、密度、抽穗数, 再将芦苇齐地割下带回实验室65 ℃下烘干48 h至恒重, 记录单位面积芦苇生物量。
1.4 统计分析方法
采用SPSS19.0(SPSS Inc, Chicago, IL, USA)和EXCEL2010对实验数据进行统计分析和作图, 不同干扰生境的芦苇种群特征进行单因素方差分析, 结果用平均数±标准误(Mean±SE)表示, 采用最小显著差数法(LSD)进行多重比较, 显著水平为0.05。
2 结果与分析
2.1 芦苇种群的密度和抽穗数
营养生长期芦苇种群密度范围为137—681株·m-2, 有性生殖期的密度范围为293—748株·m-2。生境干扰显著影响了芦苇种群的密度(表2,< 0.05)。与湿地芦苇(HP)相比, 干旱退化芦苇(XP)在营养生长期的密度显著增加了84.48%, 到有性生殖期的密度虽然最高, 但与HP的差异不显著。稻田退水处的芦苇(PP)营养期密度比HP提高41.16%, 但在有性生殖期则下降28.35%。退耕芦苇(FP)在两个生长期的密度均显著低于HP, 其密度不足HP的50%(图1 A, C)。
营养生长期芦苇种群的抽穗数范围为1—157株·m-2, 有性生殖期的抽穗数范围为93—208株·m-2。生境干扰显著影响了芦苇种群的抽穗数(< 0.05)。与营养生长期的HP相比, 只有PP维持与其相近的抽穗数, XP及FP芦苇的抽穗数显著下降(图1B)。与有性生殖期的的HP芦苇相比, XP芦苇的抽穗数则显著下降, 降低了55.13%, FP和PP芦苇虽然也有下降趋势, 但与湿地芦苇相比无显著差异。
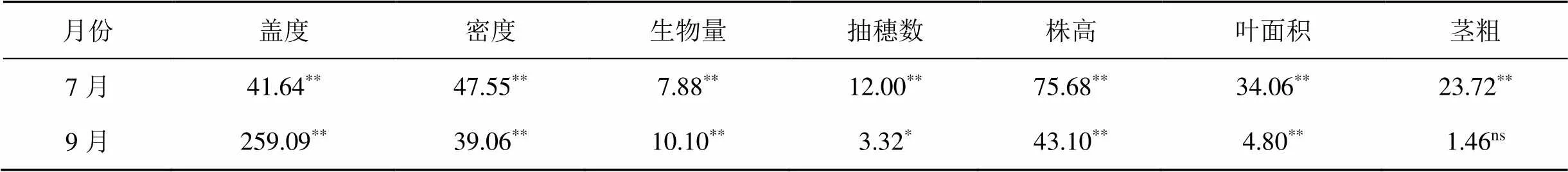
表2 芦苇种群调查指标单因素方差分析
注: ns, *,** 分别表示差异不显著, 差异显著(< 0.05 ), 差异极显著(< 0.01 )。
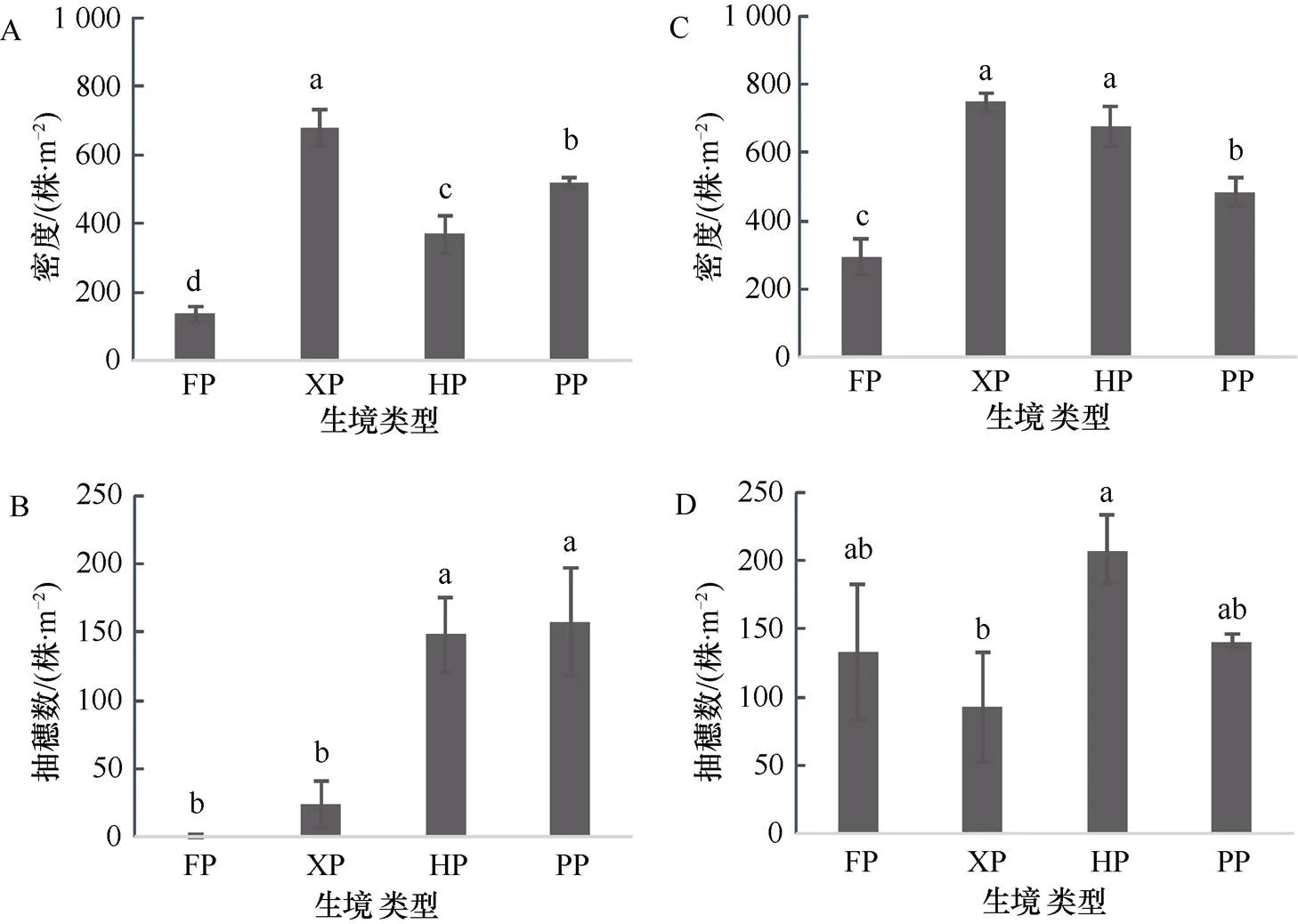
注: A,B为营养生长期; C,D为有性生殖期; FP为退耕芦苇; XP为干旱芦苇; HP为湿地芦苇; PP为稻田退水处的芦苇; 不同小写字母表示差异显著(P<0.05), 下同。
Figure1 The density and spike number ofpopulation under different habitats
2.2 芦苇种群的生物量和盖度
营养生长期芦苇种群的盖度和生物量范围分别为25%—50%和300—873.33 g·m-2, 有性生殖期的盖度和生物量范围分别为40%—84%和1000—2660 g·m-2。生境干扰显著影响了芦苇种群的盖度和生物量(表2,< 0.05)。与HP相比,PP芦苇的生物量在营养生长期显著增加,FP和XP的生物量与HP差异不显著,但XP芦苇在有性生殖期的生物量相比HP出现显著下降。与营养生长期的HP相比, PP和XP芦苇的盖度显著增加, 而FP芦苇则变化不显著, 但到了有性生殖期, 只有FP芦苇的盖度显著降低, 其他生境与HP无显著差异(图2)。
2.3 芦苇的株高和茎粗
营养生长期芦苇种群的高度和茎粗区间分别为93—200 cm和2.72—4.46 mm, 有性生殖期的高度和茎粗区间分别为154—229 cm和4.13—4.69 mm。生境干扰显著影响了芦苇种群的株高(表2,< 0.05), 但对茎粗的影响取决于芦苇的生长阶段, 营养生长期的芦苇茎粗受生境影响, 有性生殖期则无影响。与营养生长期的HP芦苇相比, 三个干扰生境的芦苇株高均显著下降, FP和XP生境的芦苇更低, 仅为HP芦苇的46.56%, 到了有性生殖期, FP和XP两个干扰生境芦苇的株高仍然显著低于HP芦苇, 而PP芦苇的株高则与HP芦苇相似, 均高于200 cm。与营养生长期的HP芦苇相比, 三个干扰生境的芦苇茎粗均显著下降, XP和PP芦苇茎粗值更小, 到了有性生殖期, 各生境芦苇的茎粗差异不显著(图3), 均高于4 mm。
2.4 芦苇的叶面积
芦苇种群的叶面积在营养生长期和有性生殖期分别为227.20—553.07 mm2和469.72—673.43 mm2。生境干扰显著影响了芦苇种群的叶面积(表2,< 0.05)。不同干扰生境的芦苇叶面积, 在营养生长期和有性生殖期的变化趋势一致, 即与HP芦苇相比, FP芦苇的叶面积没有显著变化, XP和PP芦苇叶面积显著降低。
3 讨论
松嫩平原西部盐碱湿地地处半干旱半湿润区, 自然因素和人类活动影响下, 芦苇沼泽大面积退化, 形成干旱芦苇种群, 或者开垦成农田(包括旱田和水田)。因为旱田产量不高进而退耕重新形成芦苇种群。水田退水区, 逐渐形成了一片芦苇沼泽。本文选择的几种干扰生境, 芦苇具有不同的种群生长特征。通常植物会减小叶片细胞体积和叶面积, 降低叶片水势、渗透势和气孔导度, 来减少蒸腾散失适应干旱条件[20], 主要通过生物量分配模式调整, 茎的老化、落叶等方式适应盐分胁迫[21]。本文的研究中, 退化生境芦苇面临着干旱和盐碱的双重胁迫, 无论营养生长期还是有性生殖期, 叶面积显著减小, 这一点与前人研究相似, 也表明了芦苇对干旱生境的适应特征。通常自然生境中的芦苇株高从5月份一直持续增加至8月份, 最大的密度值则发生在早夏(7月份)[22–23], 表明芦苇种群的能量首先用来保证种群的规模, 再分配给个体生长。这也能解释退化芦苇(干旱生境)在7月份密度值就达到了较高水平, 后期2个月仅提高了9.78%, 并且生殖后期株高增长较低。
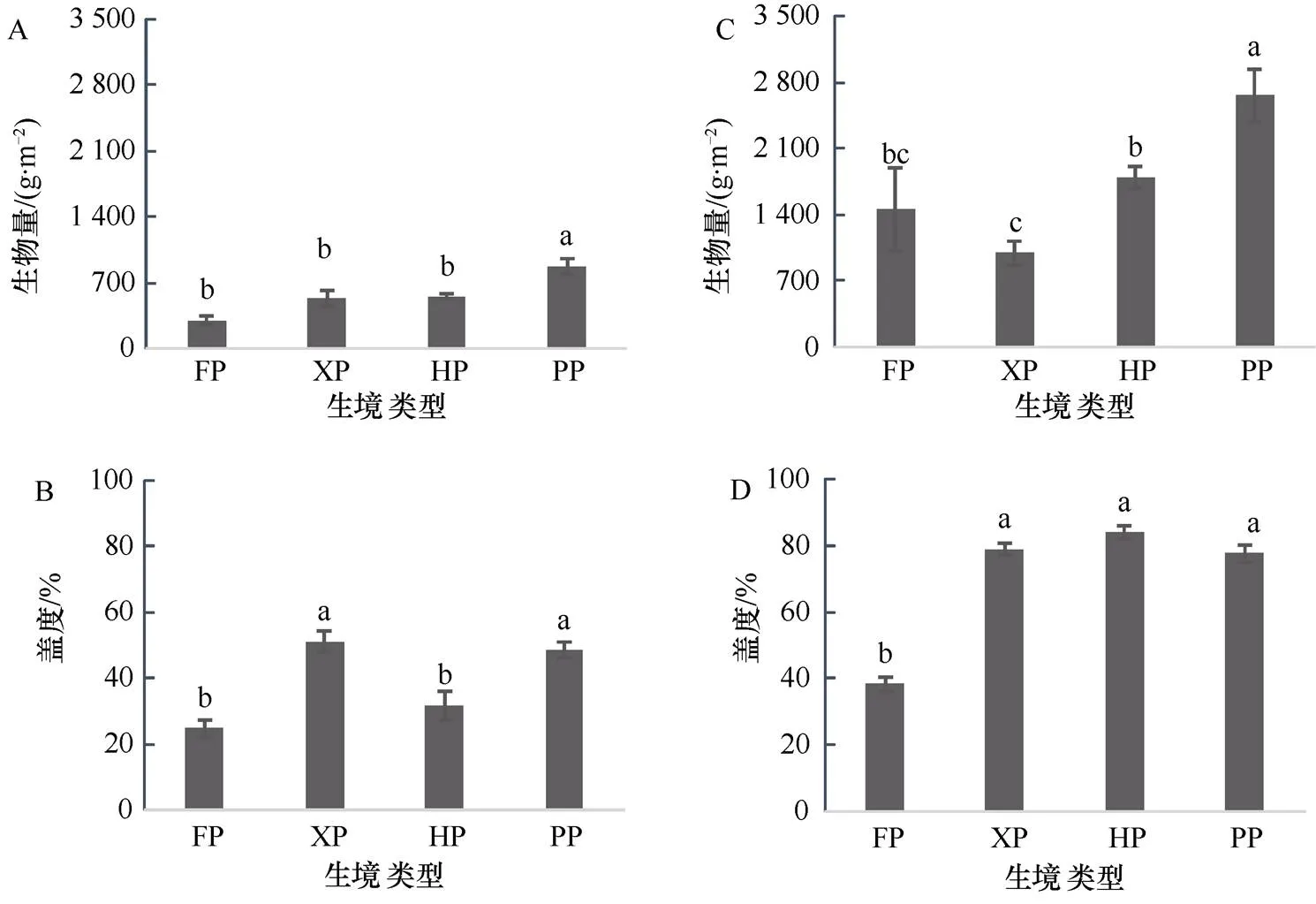
图2 不同生境下芦苇种群的生物量和盖度
Figure 2 The biomass and coverage ofpopulation under different habitats
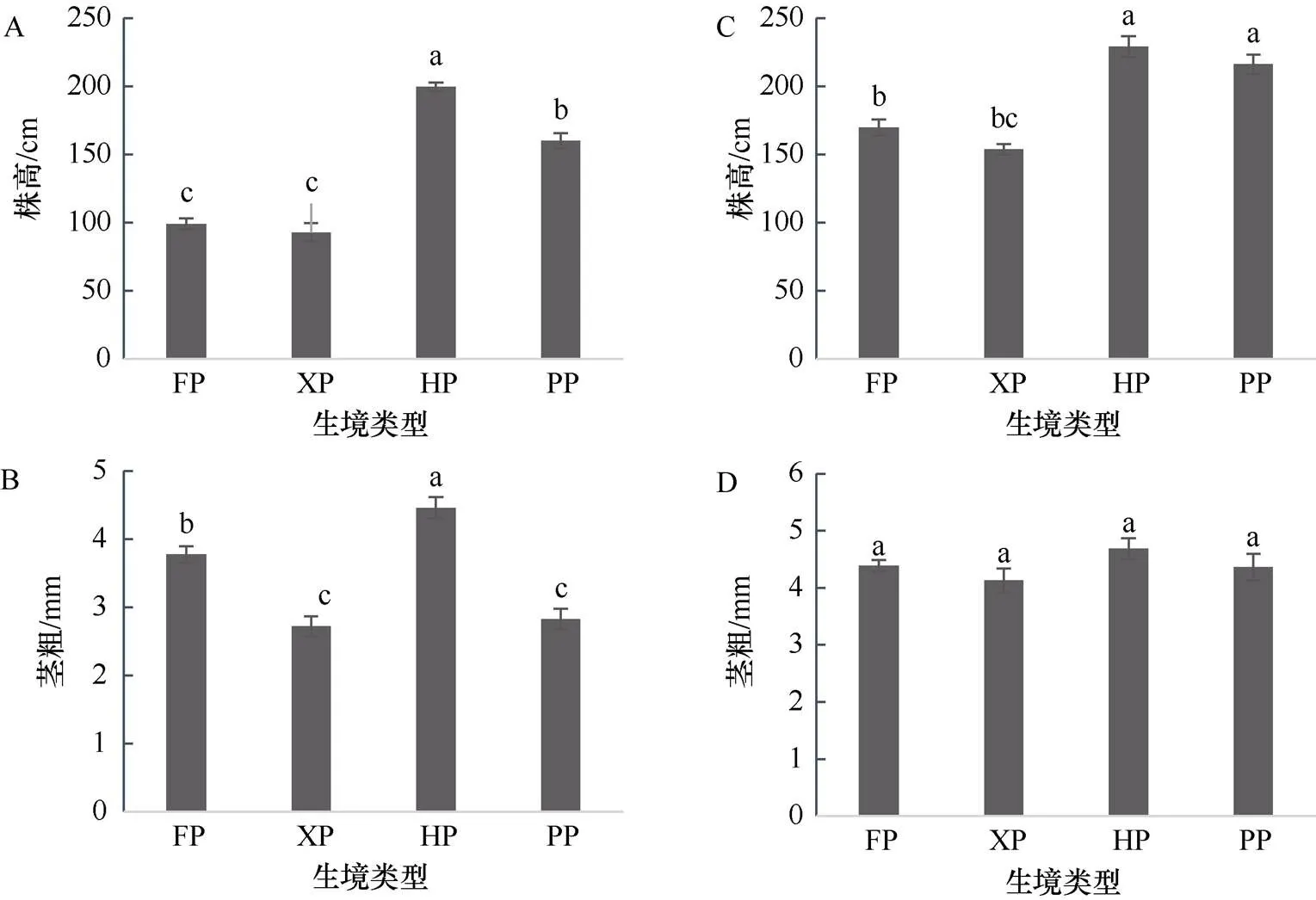
图3 不同生境下芦苇的株高和茎粗
Figure 3 The height and stem diameter ofunder different habitats

图4 不同生境下营养生长期(A)和有性生殖期(B)的芦苇叶面积
Figure 4leaf areas of vegetative and sexual reproduction period under different habitats
通常认为芦苇生长主要受水分限制, 水文通过一系列因子如水深、水流速、水质等干扰芦苇的生长[19]。而水对芦苇种群的影响, 与水深、淹水时间、持续时间和淹水频率均有关[12,24]。不同区域的芦苇种群对水深的生长响应不同。Zhang和Cui等人研究表明芦苇茎生长的适宜水位为-30—70 cm, 且在0 cm水位的盖度最高[25–26]。扎龙湿地22 cm水位的芦苇生物量最高, 为5093 g·m-2[25]。在澳大利亚中部, 有研究表明芦苇在10 cm深水位中, 株高最高[19], 黄河三角洲的芦苇种群密度在30 cm水位时出现最大值, 随着水位梯度的变化而向峰两侧递减[27]。在本文研究中, 在水位<0 cm时芦苇的密度值最大(XP); 水位30—60 cm生物量最高(PP), 为2660 g·m-2; 20—40 cm水位时株高最高(HP), 约为2.5 m, 这可能与除了水环境梯度不同外, 几种环境下的营养条件不同有关。河口和盐沼规则的水文运动有利于芦苇种群的建植和扩张[28]。本文涉及的湿地芦苇和稻田退水处芦苇生境虽不同于河口的潮汐变化, 但补水时间和稻田退水时间也均为规则, 属于芦苇的需水关键期, 有利于芦苇种群的生长和健康发育。在长期淹水环境下, 植物通过改变形态和生育对策来适应淹水环境, 促进繁殖方式由营养生长向生殖生长转变[29]。在本研究中, 湿地补水和稻田退水均有充足的水量, 促使了芦苇抽穗数的增加。对克隆植物羊草的研究表明, 当年抽穗的植株大部分是由上一年的秋季莲座丛状小苗完成花芽分化返青后形成, 而少量是由芽春季返青形成[30–31]。按照这个结果, 湿地补水和稻田退水, 促进了秋季的花芽分化春季抽穗, 芦苇具体的成穗环境因素需要通过控制实验进一步验证和分析。
营养物是湿地重要的环境控制因子, 决定着植物的生产量。随着营养物浓度的增加, 植物生物量呈现单峰曲线变化[32]。本文选取的四种生境, 随着土壤有机质及TN含量的增加, 芦苇种群生物量呈增加趋势(表1, 图2)。低水位可能降低植物吸收营养的能力和有机物的积累以及氮迁移[33]。承接稻田退水的芦苇种群生长特征优于湿地芦苇和退耕芦苇, 体现了水分和养分的双重优势。而退耕芦苇较退化芦苇土壤养分更高, 但由于仅靠自然降水, 可能也影响了芦苇对养分的吸收。芦苇沼泽被开垦成旱田后, 可能严重抑制了芦苇种群的更新繁殖能力, 导致本实验的退耕芦苇种群密度较低。芦苇由营养生长期进入有性生殖期, 生物量的增量显著不同。退化芦苇的生物量增量为87.5%, 而退耕芦苇的生物量增量最高, 接近4倍, 湿地芦苇和稻田退水补给的芦苇生物量增量约为2倍, 表明芦苇进入有性生殖期后, 芦苇种群充分利用所在的生境中的水分、营养等资源条件, 促使其种群可持续的增长。由于本文不是模拟实验, 所选取的不同生境存在年代差异, 未来可选择相同芦苇种群, 模拟水和营养梯度做进一步的探索研究。
4 结论
退耕、干旱和稻田退水等几种干扰生境对芦苇种群生长具有显著影响。无论是营养生长期还是有性生殖期, 稻田退水处的芦苇种群生物量最高; 干旱退化生境的芦苇密度最大; 稻田退水处和湿地芦苇的株高显著高于其他生境, 退耕和湿地的芦苇叶面积显著高于其他生境。
芦苇种群的生态广适性体现在其种群对生境变化的积极响应过程中。芦苇通过减小叶面积、增加密度、减少有性生殖投入, 响应干旱条件和稳定种群; 芦苇通过调节株高、茎粗以及生殖分配来积极响应水分条件; 与营养相比, 水是吉林西部盐碱沼泽恢复的首要关键因子, 但两者叠加效果更有利于芦苇种群生产力的恢复。
[1] 刘兴土等. 东北湿地[M]. 北京: 科学出版社, 2005.
[2] BAI Junhong, CUI Baoshan, CAO Huicong, et al. Wetlands degradation and ecological restoration[J]. The Scientific World Journal, 2013, DOI: 10. 1155/2013/ 523632.
[3] MITSCH W J, GOSSELINK J G. Wetlands[M]. John Wiley and Sons, New York, 2015.
[4] LIU Hongyu, ZHANG Shikui, LU Xianguo. Wetland landscape structure and the spatial-temporal changes in 50 years in the Sanjiang Plain[J]. Acta Geographica Sinica, 2004, 59(3): 391–400.
[5] SULLIVAN P L, GAISER E E, SURRATT D, et al. Wetland ecosystem response to hydrologic restoration and management: the Everglades and its urban-agricultural boundary (FL, U. S. A. ) [J]. Wetlands, 2014(34): 1–8.
[6] MILLER R L, FUJII R. Plant community, primary productivity, and environmental conditions following wetland re-establishment in the Sacramento-San Joaquin Delta, California[J]. Wetlands Ecology and Management, 2010(18): 1–16.
[7] RODRIGUEZ R, LOUGHEED VL. The potential to improve water quality in the middle Rio Grande through effective wetland restoration[J]. Water Science and Technology, 2010(62): 501–509.
[8] PACKER J G, MEYERSON L A, SKáLOVá H, et al. Biological flora of the British Isles:[J]. Journal of Ecology, 2017(105): 1123–1162.
[9] WANG Zhongming, HUANG Ni, LUO Ling, et al. Shrinkage and fragmentation of marshes in the West Songnen Plain, China, from 1954 to 2008 and its possible causes[J]. International Journal of Applied Earth Observation and Geoinformation, 2011(13): 477–486
[10] WEN Bolong, LIU Xingtu, LI Xiujun, et al. Restoration and rational use of degraded saline reed wetlands: a case study in western Songnen Plain, China[J]. Chinese Geographical Science, 2012(22): 1–11
[11] YANG Jiuchun, ZHANG Shuwen, LI Ying, et al. Dynamics of saline-alkali land and its ecological regionalization in western Songnen Plain, China[J]. Chinese Geographical Science, 2010, 20(2): 159–166.
[12] 李晓宇, 刘兴土, 李秀军, 等. 不同干湿交替频率对芦苇生长和生理的影响[J]. 草业学报, 2015, 24(3): 99–107.
[13] LI Xiaoyu, LI Xiujun, LIN Jixiang, et al. Effects of sub-soiling and fertilization on growth restoration of Phragmites australis population in saline marsh of Northeast China[J]. Fresenius Environmental Bulletin, 2017, 26(2): 1453–1460.
[14] 杨富亿, 李秀军, 刘兴土, 等. 松嫩平原退化芦苇湿地恢复模式[J]. 湿地科学, 2009, 7(4): 306–313.
[15] 洪瑜, 王英, 王芳, 等. 5种浮床植物对宁夏引黄灌区稻田退水中氮磷的去除效果[J]. 环境工程学报, 2019(11): 2637–2645.
[16] 严岩, 文波龙, 徐惠风, 等. 除草剂苄嘧磺隆对盐碱化沼泽芦苇生长及土壤酶活性影响的实验研究[J]. 湿地科学, 2016(1): 117–121.
[17] 于翔霏. 潜流人工湿地降解盐碱化稻田退水中毒死蜱的影响因素及强化技术研究[D]. 北京: 中国科学院大学, 2019.
[18] WEN Bolong, LI Xiaoyu, YANG Fuyi, et al. Growth and physiological responses ofto combined drought-flooding conditions in inland saline- alkaline marsh, Northeast China[J]. Ecological Engineering, 2017(108): 234–239
[19] LI Xiaoyu, WEN Bolong, YANG Fuyi, et al. Effects of alternate flooding-drought conditions on degeneratedsalt marsh in Northeast China[J]. Restoration Ecology, 2017, 25(5): 810–819.
[20] ALMEIDA-RODRIGUEZ AM, COOKE JEK, YEH F, et al. Functional characterization of drought-responsive aquaporins inand×clones with different drought resistance strategies[J]. Physiologia Plantarum, 2010(40): 321–333.
[21] HASLAM S M.communis Trin[J]. Journal of Ecology, 1972(60): 585–610.
[22] RODWELL J S. British Plant Communities Volume 4: Aquatic Communities, Swamps and Tall-Herb Fens[M]. Cambridge: Cambridge University Press, 1998.
[23] 李峰, 谢永宏, 蕈盈盈. 盐胁迫条件下湿地植物的适应策略[J]. 生态学杂志, 2009, 28(2): 314–321.
[24] 李晓宇, 齐明明, 李秀军, 等. 淹水发生和持续时间对退化芦苇盐碱沼泽植被与土壤的影响[J]. 水土保持研究, 2016, 23(6): 83–89.
[25] ZHANG Wenguang, TONG Shouzheng, WANG Xuehong, et al. The interaction of water, vegetation and soil in Zhalong wetland, China[J]. Journal of Food, Agriculture & Environment, 2013(11): 1287–1294.
[26] CUI Baoshan, HUA Yanyan, WANG Chongfang, et al. Estimation of ecological water requirements based on habitat response to water level in Huanghe River Delta, China[J]. Chinese Geographical Science, 2010(20): 318–329.
[27] 崔保山, 赵欣胜, 杨志峰, 等. 黄河三角洲芦苇种群特征对水深环境梯度的响应[J]. 生态学报, 2006, 26 (5): 1533–1640.
[28] OSTENDORP W, DIENST M. Vegetation dynamics in the nature reserve ‘WoIlmatinger Ried- Untersee- Gnadensee’ (Lower Lake of Lake Constance, Germany) following extreme flood and low water periods[J]. Carolinea, 2009(67): 93–107.
[29] KLIMKOWSKA A, KOTOWSKI W, VAN DIGGELEN R, et al. Vegetation re-development after fen meadow restoration by top soil removal and hay transfer[J]. Restoration Ecology, 2010(18): 924– 933
[30] 张兆军. 羊草幼穗分化及子株与翌年成穗关系研究[D]. 长春: 东北师范大学, 2011.
[31] 张继涛, 徐安凯, 穆春生, 等. 羊草种群各类地下芽的发生、输出与地上植株的形成、维持动态[J]. 草业学报, 2009, 18(4): 54–60.
[32] 徐治国, 何岩, 闫百兴, 等. 营养物及水位变化对湿地植物的影响[J]. 生态学杂志, 2006, 25(1): 87–92.
[33] WALBRIDGE M R, STRUTHERS J P. Phosphorus retention in non-tidal palustrine forested wetland the mid-Atlantic region[J]. Wetlands, 1993(13): 84–94.
Growth responses ofpopulation to disturbed habitats in saline-alkaline marsh of Western Songnen Plain
AN Subang1,2, DU Zhixin1,3, LI Xiaoyu1,*
1. Key Laboratory of Wetland Ecology and Environment, Northeast Institute of Geography and Agroecology, Chinese Academy of Sciences, Changchun 130102, China 2. School of Environment and Mapping Engineering, Suzhou College, Suzhou 234000, China 3. Key Laboratory of Vegetation Ecology of Ministry of Education,Institute of Grassland Science, Northeast Normal University, Changchun 130024, China
Saline-alkaline marsh in Western Songnen Plain is located in semi-arid and semi-humid areas. Natural factors and human disturbance lead to the degradation of saline-alkaline marsh and changes ofhabitats. In this study, four disturbed habitats ofwere selected in Western Songnen Plain (wetland, returned farm land, drought, paddy field drainage), to determine the height, coverage, density, biomass and leaf area ofpopulation during growing and breeding stage, then to analyze the growth responses characters ofpopulation to different habitats. The results showed that, the biomass ofwas the highest under paddy field drainage (2660 g·m-2), when the water level was 30-60 cm. The plant was the highest under wetland (average 2.5 m), when the water level was 20-40 cm. The density was the biggest under drought site (681·m-2).adapted drought condition by reducing leaf area and the allocation to sexual reproduction, and increasing density. It positively responded to water condition by adjusting height, stem diameter and reproductive distribution. Considering of population characteristics, fresh water supplying was enough for restoring the height and biomass of. Besides, nutrition addition from paddy wastewater promoted the productivity ofsignificantly.
saline-alkaline marsh;population; paddy waste water; degraded marsh; returned farmland; hydrological restoration
10.14108/j.cnki.1008-8873.2022.04.004
945.78
A
1008-8873(2022)04-025-07
2020-07-31;
2020-09-15
中国科学院A类战略性先导科技专项项目(XDA28110401, XDA23060404); 中国工程院院地合作重点咨询项目(JL2020-001); 国家自然科学基金(41771550, 41971140)
安素帮(1987—), 男, 山西应县人, 博士, 主要从事湿地生态学研究, E-mail: ansubang@sina.com
通信作者:李晓宇, 女, 博士, 副研究员, 主要从事湿地生态恢复及资源利用研究, E-mail: lixiaoyu@iga.ac.cn
安素帮, 杜智鑫, 李晓宇.松嫩平原西部盐碱沼泽生境干扰后的芦苇种群生长响应[J]. 生态科学, 2022, 41(4): 25–31.
AN Subang, DU Zhixin, LI Xiaoyu. Growth responses ofpopulation to disturbed habitats in saline-alkaline marsh of western Songnen Plain[J]. Ecological Science, 2022, 41(4): 25–31.

