冷泉环境自生矿物多硫同位素特征及应用
张覃谊,邬黛黛,刘丽华
1.中国科学院天然气水合物重点实验室,中国科学院广州能源研究所,广州 510640
2.中国科学院大学,北京 100049
3.中国科学院南海生态环境工程创新研究院,广州 510301
海洋沉积物是全球最大的甲烷储库[1]。甲烷是一种温室气体,在沉积物中以溶解态、游离气和固相天然气水合物的形式存在[2]。在厌氧沉积物中,可通过以下2种方式产生甲烷:①产甲烷细菌或古菌对有机质的分解利用;②沉积物深部有机物的热催化裂解[3]。当富甲烷低温流体沿海底裂隙或其他通道向上排溢时便会形成冷泉,这一现象在全球大陆边缘广泛存在[4-8]。在地质历史时期,大气甲烷含量的变化甚至会对气候造成直接影响[9]。然而,在冷泉沉积物中的甲烷绝大多数被硫酸盐还原-甲烷厌氧氧化作用所消耗[10-11](公式(1),sulfate reduction-anaerobic oxidation of methane,以下称作SR-AOM)从而减少了甲烷气体排放[12]:
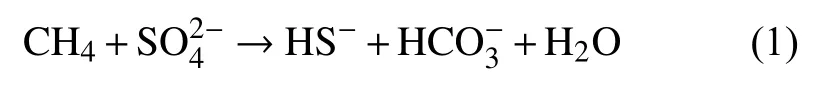
硫酸盐是海洋硫循环中的关键部分[13]。在大陆边缘沉积物中,硫酸盐还原菌利用孔隙水硫酸盐降解有机质[14]。此外,孔隙水硫酸盐还能在硫酸盐甲烷转换带(sulfate-methane transition zone,以下称作SMTZ)内被消耗。上述2个过程中的硫酸盐在被还原成硫化物的同时,部分生成的硫化物会被再次氧化为含硫中间产物(如单质硫),这即是氧化硫循环现象[15]。然而,与有机质硫酸盐还原作用(organoclastic sulfate reduction,以下称作 OSR)不同,在SMTZ内的SR-AOM通常由嗜甲烷古菌和硫酸盐还原细菌组成的共生体所主导[16-17]。如何区分OSR和SR-AOM对于冷泉环境的研究具有重要意义[18]。
SMTZ内主要的微生物过程为SR-AOM,其直接控制该过程产物的硫同位素特征和δ34S及Δ33S值[17]。然而,这个过程的微生物代谢机制,尤其是甲烷厌氧氧化并将硫酸盐作为终端电子受体的电子转移机制仍然存在争议[19-20]。Milucka等[21]认为SR-AOM主要由嗜甲烷古菌进行,即嗜甲烷古菌首先将硫酸盐还原成S0,其细菌共生体随后通过歧化反应将其转换为硫酸盐和硫化物。另一种观点则认为,在嗜甲烷古菌中进行的AOM以及在硫酸盐还原细菌中进行的SR是相互独立的[19-20,22],它们之间通过纳米线[19]和细胞色素[20]直接进行种间电子转移,而不是产生S0等中间产物。迄今为止,后者被认为是此代谢关系的主导模式[23]。
此外,OSR和SR-AOM均会造成显著的硫同位素分馏[24-28]。其分馏的原因在于硫的各个同位素质量不同,导致在物理、化学及生物化学作用过程中,硫同位素在两种或两种以上物质(物相)之间的分配存在不同的同位素比值的现象[29]。一般来说,同位素的质量差越大,其分馏效应也越大,即同位素交换反应服从质量相关法则[24]。然而,现阶段被广泛应用的δ34S值[28-32]在揭示生物地球化学硫循环方面仍然存在一定的局限性[33-34]。近年来,多硫同位素在冷泉研究领域的应用逐渐兴起[17,23,35-36]。与冷泉相关的微生物过程中,多硫同位素的分馏遵循质量分馏原理,硫的3个稳定同位素(32S、33S、34S)会因生物地球化学过程的不同而出现可测量到的差异[37]。反过来,这些被测量到的微小差异就可以反演其分馏过程[38-39]。国内外对 δ34S-Δ33S、δ34SΔ36S的研究已经充分表明多硫同位素可以有效区分OSR和SR-AOM[15,23,37,40],这将有助于揭示极端条件下的生物地球化学硫循环。
硫同位素比值普遍以δ符号表示:
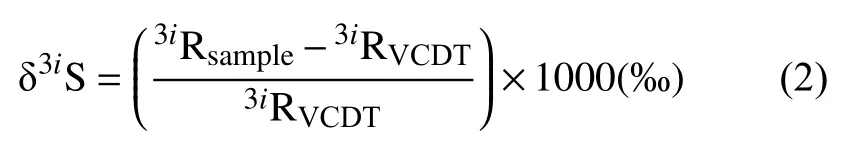
3iR为3iS/32S,3i=33、34或36,VCDT代表国际参考物质 Vienna Cañon Diablo Troilite。Δ 为3iS/32S和34S/32S(3i同上)同位素比率之间测量的差别:
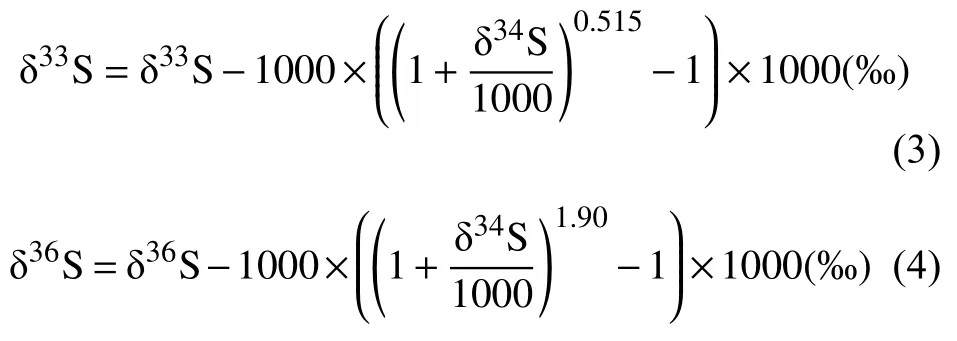
硫同位素分馏系数3iα用下式表达(3i同上):

硫同位素异素体之间的分馏系数与3iλ(3i同上)相关:

33λ=0.515,36λ=1.90[38,41]。由质量差异主导的相关过程促进了34S/32S分馏,其大约是33S/32S分馏的2倍,但只是36S/32S分馏的一半[38,42-43]。
基于前人的研究成果,本文在对冷泉环境中含硫自生矿物(黄铁矿和重晶石)δ34S特征总结的基础上,对其多硫同位素的主要特征及模型方法进行概述,探讨冷泉环境中硫元素的生物地球化学过程,并强调多硫同位素对区分OSR和SR-AOM的积极作用。
1 微生物调节硫同位素分馏
长久以来,冷泉环境中微生物对硫同位素的分馏调节作用一直受到广泛关注[19,44-47]。SR-AOM由甲烷厌氧氧化古菌(anaerobic methanotrophic archaea,以下称作ANME)和硫酸盐还原菌(sulfate-reducing bacteria,以下称作SRB)组成的互养菌群所介导[16,48]。然而,学术界对ANME和SRB互养模式的电子平衡机制的观点仍然存在分歧[20,48]。迄今为止,代谢作用的主导模式是ANME和SRB通过细胞膜上多种含亚铁血红素的细胞色素[19]或者传导菌毛直接实现种间电子转移[20]。尽管对SR-AOM机制的研究已经取得了重要成果,但是对冷泉沉积物内这一过程的本质仍需进一步了解[48]。
研究普遍认为,微生物对硫循环的调节作用造成了显著的硫同位素分馏[49]。一般而言,微生物参与的硫化物氧化作用会产生少量的硫同位素分馏(<5‰)[50]。Pellerin等[51]提出通过两种机制进行的细菌硫化物氧化作用可能会导致显著的硫同位素分馏:硫调节的细胞内歧化作用或反向异化硫酸盐还原作用。前者受细胞限制而不产生细胞外的单质硫,后者将硫酸盐还原形成的硫化物再次氧化为硫酸盐。硫化物的再氧化作用会产生含硫中间产物 (S0,S2O32-,SO32-),这些含硫中间产物参与的歧化作用导致随后形成的硫化物明显亏损34S[52-53]。此外,低浓度的溶解硫化物更有利于微生物参与歧化作用[54]。
在细胞层面上,由微生物控制的硫酸盐还原过程主要包括以下几个步骤(图1)[37,47]:第1步,硫酸根在其通透酶的作用下进入细胞内;第2步,细胞内硫酸根转化为腺苷-5'-磷酸硫酸酐(adenosine 5′phosphosulfate (APS));第3步,APS被还原为亚硫酸根;第4和第5步,亚硫酸根被转化为硫化氢,期间可能经过其他中间价态硫的形态过程(如单质硫、连三硫酸盐、硫代硫酸盐);第6步,硫化氢被释放到细胞外。由于每一步代谢反应都是可逆的,因此,硫同位素的分馏程度不仅取决于每一步反应的动力学分馏程度,也受每一步反应的可逆程度(fi)控制。
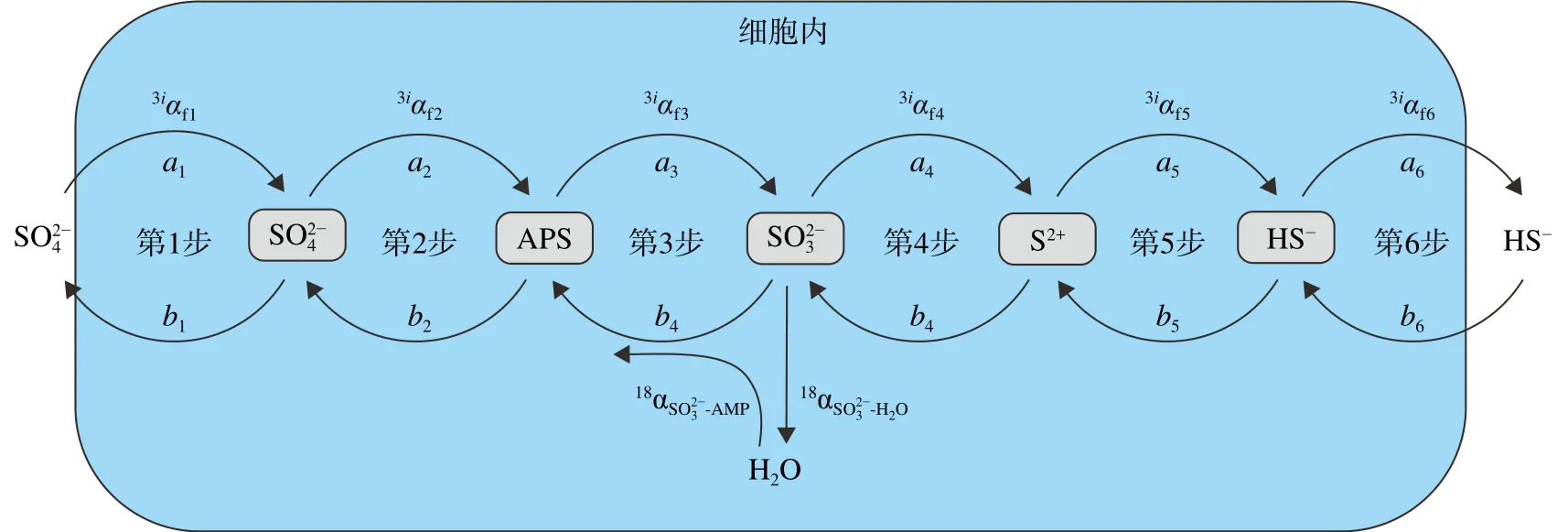
图1 微生物细胞内硫酸盐还原作用硫的代谢过程及硫同位素分馏机理示意图AMP为一磷酸腺苷的缩写,3iα代表34S-32S和33S-32S的分馏系数,fi = ai / bi,ai代表正反应通量,bi代表逆反应通量 [46-55]。Fig.1 Schematic diagram of sulfur metabolism and sulfur isotope fractionation mechanism of microbial intracellular sulfate reductionAMP stands for adenosine monophosphate, 3iα represents the fractionation coefficients of 34S-32S and 33S-32S, fi = ai/bi, where ai represents forward reaction flux and bi represents reverse reaction flux [46-55].
2 冷泉环境内多硫同位素特征
2.1 SMTZ内硫同位素分馏特征及主要自生矿物
现代大陆边缘海洋沉积物内富集34S的自生矿物对研究与SR-AOM相关的过程以及识别SMTZ具有重要意义[17,24,56-61]。在海洋沉积物中,SR-AOM能够不断消耗从海底表层向下扩散的硫酸盐[30,32,60]。在这个过程中,32S被优先转移至产物中,导致在沉积物内形成的溶解硫化物δ34S值显著负偏,并使得残余的孔隙水硫酸盐以及后续产生的硫化物富集34S[24,62]。然而,随着埋藏深度增加,溶解硫化物的δ34S值会逐渐正偏,因为富集34S的残余孔隙水硫酸盐会被逐渐消耗[33,63]。32S、33S和34S之间不同的扩散效应最终导致SMTZ内的还原性硫池接近海水的硫同位素组成[64-65]。大量的研究结果表明,在冷泉区存在由SR-AOM引起的富集34S的硫化物和次生硫酸盐矿物的聚集现象[17,66]。如此大范围聚集的自生矿物指示了现在和/或古代SMTZ的位置[24,33,56-57,60-61,67-69]。
SMTZ内含硫的自生矿物主要为黄铁矿[1,70]和重晶石[62,71]。黄铁矿被认为是沉积物中硫早期成岩作用的最终产物,其形成过程及硫同位素组成主要受3个因素的控制[59,72-74]:① 有机质;② 溶解硫酸盐;③活性铁矿物。现代海洋沉积物中莓球状黄铁矿的粒度大小和含量变化反映了环境的氧化还原状态,甚至包括沉积环境的演化特征[75]。而黄铁矿的赋存形态和微晶形貌的不同反映了甲烷通量的差异[76]。此外,在高硫酸盐还原率情况下,孔隙水硫酸盐浓度在浅层沉积物中快速降低[77],从而导致在低硫酸盐浓度的样品中很难获取足够的孔隙水硫酸盐用于多硫同位素分析[66]。同时,在获取沉积物岩芯时,岩芯的顶层很容易被破坏,这会导致孔隙水硫酸盐被海水硫酸盐所污染[66,78]。幸运的是,自生重晶石(BaSO4)中保存有与SR-AOM活动相关的孔隙水硫酸盐的初始同位素记录[62,71],其性质较为稳定且分布较广,能较好地记录SR-AOM的多硫同位素变化特征。
2.2 冷泉环境黄铁矿多硫同位素特征
沉积物黄铁矿是全球显生宙硫循环中最大的硫汇[1]。在冷泉沉积物中产生的H2S向周围沉积物扩散的过程中会与铁离子结合形成各种形式的铁硫化物[79-81](包括四方硫铁矿、胶黄铁矿、硫铁矿和磁黄铁矿等),并最终形成黄铁矿(FeS2)。黄铁矿的δ34S(即δ34Spy)值是识别富甲烷环境中SR-AOM过程和反演沉积环境变化的一种有效标志[73]。黄铁矿的硫同位素在很大程度上反映了孔隙水中溶解硫化物的硫同位素组分,因为在溶解硫化物形成黄铁矿期间的同位素分馏可以忽略不计[82-83]。
在低甲烷通量条件下,OSR造成残余孔隙水硫酸盐富集34S,导致在沉积物深处的SMTZ内形成的黄铁矿呈逐渐正偏的δ34Spy值[33,36,84]。在SMTZ内形成的黄铁矿,其34S的富集通常归因于以下两点:硫酸盐的定量消耗[33]以及上层海水中普遍存在的硫酸盐与硫化物的扩散交换现象[24]。Gong等[73]分析对比了不同冷泉碳酸盐岩内的δ34Spy值,结果表明,其主要受参与反应的硫酸盐同位素组分所控制,并受硫酸盐还原率和硫酸盐向下扩散通量所控制。相反,当甲烷通量很高时,黄铁矿会形成于靠近海底的浅层沉积物内,非分馏海水硫酸盐的持续补给将会避免硫酸盐被耗尽[73](图2)。此外,在一些研究中,碳酸盐晶格硫(carbonate-associated sulfate,以下称作CAS)也常与黄铁矿结合分析以进一步揭示地质历史时期的冷泉活动[85]。如 Crémière 等[23]发现北海和巴伦支海黄铁矿和CAS的δ34S值呈双峰分布,分别在-23.4‰~14.8‰(平均约-6.9‰±9.7‰ )和26.2‰~61.6‰(平均约42.0‰±7.1‰)。这与冷泉环境中孔隙水硫酸盐不断演化的结果一致,即最初形成的硫化物相对于海水而言亏损34S,随后SRAOM导致硫酸盐的消耗量超过补给量,促使残余硫酸盐和硫化物的δ34S值逐渐正偏[23-24,56],表明同时研究黄铁矿与CAS可以更准确地揭示冷泉环境硫同位素的特征。此外,同位素质量守恒会导致黄铁矿以及CAS的δ34S值倾向于海水值[23-24,77,86]。然而,在部分海底沉积物中存在δ34S值高于+21‰的黄铁矿[15,36,59,87],针对这一现象则需要其他解释。
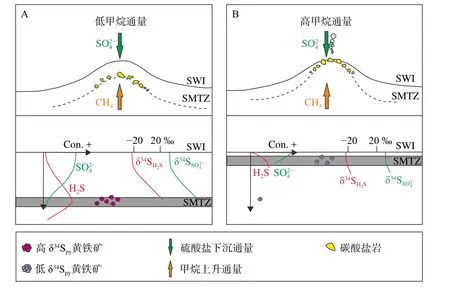
图2 不同甲烷通量条件下形成的黄铁矿的硫同位素组分示意图 [73]A.在低甲烷通量环境下,海水对SMTZ内的孔隙水硫酸盐补给有限,此时通过SR-AOM形成的黄铁矿会呈正δ34S值;B.当甲烷通量很高时,快速向下扩散的海水硫酸盐限制了瑞利分馏的影响,同时,次氧化条件有利于硫化物的氧化作用和歧化作用,此时形成的黄铁矿呈负δ34S值。图中δ34S曲线的横坐标值仅具参考意义;SWI为沉积物-水界面;SMTZ为硫酸盐甲烷转换带;Con为浓度 [73]。Fig.2 Schematic diagram illustrating the variable sulfur isotopic composition of pyrite formed under different methane fluxes [73]A.In the environment with a low methane flux, sulfide minerals formed by SR-AOM are characterized by positive δ34S values due to the relatively limited supply of pore sulfate with respect to seawater.B.While the methane flux is high, rayleigh fractionation is limited by quickly downward-diffusion of seawater sulfate.Meantime, the suboxic condition favors the oxidation and disproportionation progress of sulfide.Such an environment favors the formation of 34S-depleted sulfide minerals.Notablely, the abscissa of the δ34S curve in the figure is for reference only.SWI: sediment-water interface; SMTZ: sulfate methane transition zone; Con: concentration[73].
虽然高硫酸盐还原率与硫酸盐补给之间的竞争关系在一定程度上可以解释δ34Spy的特征[73],但是难以排除其他因素的影响,如含硫中间产物的细菌歧化作用[88-89],来源于OSR[60]和碎屑Fe物质[74]形成的早期成岩黄铁矿。近沉积物水界面的底水中的氧或氮以及氢氧化铁/锰矿物会与孔隙水硫化物反应,并在表层沉积物中形成硫酸盐或含硫中间产物[20,23]。随后这些含硫中间产物通过微生物歧化作用或氧化作用再次形成硫酸盐[90]。通过上述方式形成的硫化物相比于单独由硫酸盐还原作用形成的硫化物具有明显更低的Δ33S值[91-92]。与硫酸盐还原作用相反,针对硫化物氧化作用和硫歧化作用路径的研究相对较少[23]。区分与硫酸盐还原作用共存的硫化物氧化作用是比较困难的,因为硫化物氧化作用会产生少量的34S/32S分馏[41,91,93]。然而,在某些情况下,硫化物氧化作用可能会造成显著的硫同位素分馏[51],使得区分硫酸盐还原作用和硫化物氧化作用更加困难[23]。此外,通过OSR形成的黄铁矿通常显示更低的δ34S值[94]。自然环境[24-26,45]和实验室培养实验[26]的结果表明,单独由OSR引起的硫同位素分馏程度可能高达70‰。然而,自然环境[24-25]和实验室培养实验[86,95]也发现,SR-AOM同样会在硫酸盐和硫化物之间引起显著的硫同位素分馏[86](20‰~60‰)。这意味着单独利用34S-32S之间的硫同位素分馏不能有效区分SR-AOM和OSR[17]。另一方面,硫酸盐还原作用和硫歧化作用微生物培养试验揭示了这2种微生物过程中不同的34S/32S和33S/32S同位素分馏现象[41,93],从而表明多硫同位素特征可以作为自然界硫循环的另一种指标[91-92]。
迄今为止,针对SR-AOM形成的黄铁矿多硫同位素特征的研究并不多见[36](表1),对黄铁矿Δ33S值的形成机制的研究同样缺乏。尽管Lin等[17]提供了与SR-AOM相关的多硫同位素数据,但是人们对其内在机制的认识仍有限。海底沉积物黄铁矿的质量守恒计算表明,在SMTZ内通过SR-AOM形成的硫化物具有高δ34S值和接近海水的Δ33S值[36],不同于上覆沉积物内OSR和硫歧化作用结合所产生的黄铁矿[17](图3)。Tostevin等[40]认为全球埋藏的黄铁矿平均δ34S值和Δ33S值分别为-35‰±5‰和0.145‰±0.025‰。然而,正如表1所示,不同海域沉积物的黄铁矿δ34S值和Δ33S值具有显著差异。例如,北海沉积物的黄铁矿Δ33S值为-0.06‰~0.16‰,随着δ34S值的升高,Δ33S值逐渐趋同于海水值[23]。最新的研究结果表明,由OSR形成的表层黄铁矿会呈现正的δ34S-Δ33S 相关性[91,96],即低 δ34S值和高Δ33S值,随着埋藏深度增加则会出现由SRAOM主导的负相关性的转变[23,36]。Liu等[14]提出,由Fe驱动的持续的硫化物氧化作用以及共存的S0的歧化作用导致Δ33S-δ34S呈负相关,在硫化前缘(sulfidization front)的黄铁矿中表现出高Δ33S值。此外,Ono等[39]认为黄铁矿的Δ36S/Δ33S的斜率也可以区分同位素质量分馏(斜率为-0.9)与同位素非质量分馏(斜率为-6.85)。Liu等[36]对973-4站位内由SR-AOM形成的黄铁矿研究发现,其Δ36S值(约0.2‰)高于平均的海水硫酸盐Δ36S值(约-0.33‰)[97],而与相邻岩芯表层数厘米孔隙水中的硫酸盐Δ36S 值相近 (0.2‰)[17]。
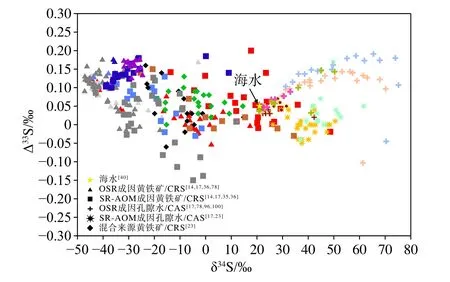
图3 黄铁矿/CRS和孔隙水硫酸盐/CASδ34S-Δ33S数据对比黄铁矿/CRS相对于孔隙水硫酸盐/CAS均具有更低的δ34S值,而由SR-AOM产生的孔隙水硫酸盐/CAS的Δ33S值明显比OSR的更低。CRS表示铬还原性硫,可代指黄铁矿。混合来源表示可能存在氧化硫循环的影响。海水δ34S值和Δ33S值参考Tostevin[40]。Fig.3 The data of δ34S compared with Δ33S of pyrite/CRS and porewater sulfate/CAS in porewaterPyrite/CRS has lower δ34S value than porewater sulfate/CAS, while the Δ33S value of porewater sulfate /CAS produced by SR-AOM is significantly lower than that of OSR.The CRS represents chromium-reducible sulfur which substitutes pyrite.The mixed origin represents the possibly existence of sulfur oxide cycle.The δ34S and Δ33S values of seawater refer to Tostevin[40].
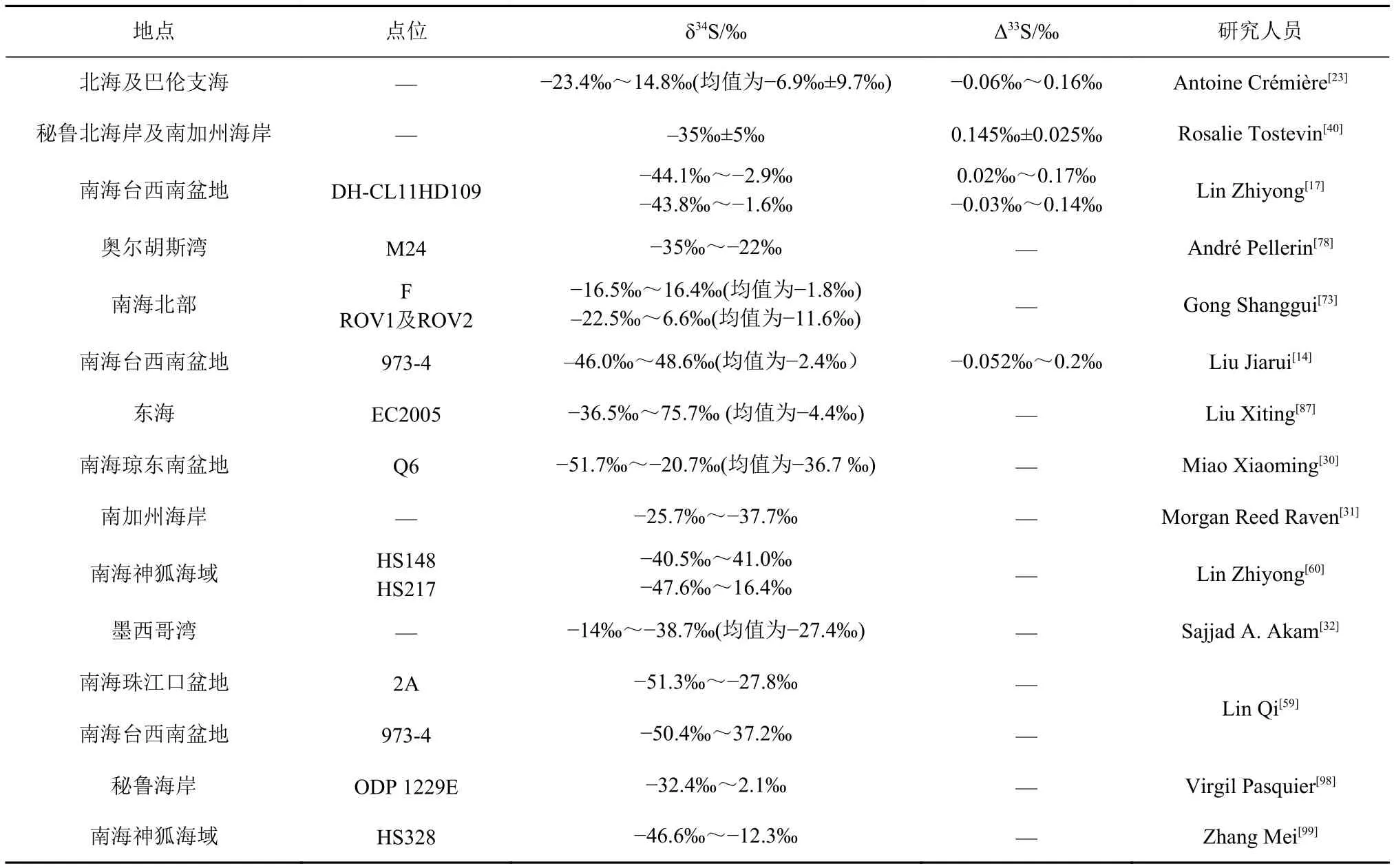
表1 全球范围内不同海域沉积物黄铁矿的δ34S和Δ33S值Table 1 The δ34S values and some corresponding Δ33S values of pyrite in sediments from different sea areas around the world
除了OSR,硫化物的歧化作用和再氧化作用在海底浅层沉积物内的硫循环中也发挥了重要作用[17,50,100]。硫化物的歧化作用和再氧化作用会引起硫化物和硫酸盐之间频繁地相互转换,即强烈的硫循环现象,从而导致海底沉积物内黄铁矿的含量偏低且δ34S值极端负偏,而硫酸盐的多硫同位素特征则 保 持 相 对 稳 定 (δ34SSulate、Δ33Ssulfate和 Δ36Ssulfate值)[101-104]。Liu等[14]认为SMTZ内黄铁矿的硫同位素特征主要反映了OSR、SR-AOM和氧化硫循环之间的内在联系(图4),OSR和SR-AOM形成的黄铁矿多硫同位素特征都会受再氧化作用和微生物歧化作用所影响。
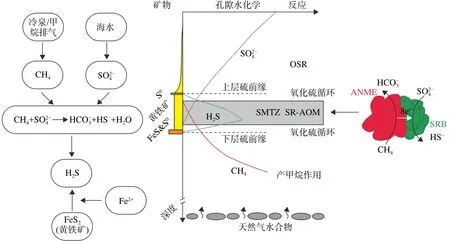
图4 冷泉环境生物地球化学循环示意图图左和图右分别表示SMTZ内与SR-AOM相关的黄铁矿的成因示意[105]和与之对应的细菌组合体的反应产物[19-20],图中间部分阐释了与SR-AOM相关的自生矿物含量变化、孔隙水组分分布和邻近SMTZ的主要反应[15,106]。Fig.4 A schematic representation of biogeochemical cycling at cold-seep environment.The left and right parts of the figure show the genesis of pyrite related SR-AOM in SMTZ[105] and the corresponding reaction products of bacterial assemblage[19-20],respectively.Authigenic mineral, porewater distributions and the dominant reactions in proximity [15,106]are illustrated in the middle portion of the figure.
总体而言,冷泉黄铁矿的多硫同位素特征受控于海水硫酸根的补给与消耗及其与甲烷通量之间的竞争关系。低甲烷通量条件下形成的黄铁矿由于SO42-的供给不足而更富集34S,δ34S值趋近于海水值甚至高于海水值;而在高甲烷通量下形成的黄铁矿易被再氧化且明显亏损34S,δ34S值更负。不同于OSR形成的黄铁矿,由SR-AOM形成的黄铁矿具有高δ34S值和近海水的Δ33S值。然而,影响黄铁矿多硫同位素特征的因素是多样的,揭示其内在机理的自然实验和实验室培养研究依旧不可或缺。
2.3 与SR-AOM相关的重晶石多硫同位素特征
海水中的SO42-与沉积物中的Ba2+结合会形成较为稳定的重晶石(BaSO4),从而能够较好地保存与多硫同位素特征相关的信息[66]。自1979年人们首次在加利福尼亚的圣克莱门特断层带内发现与冷泉相关的重晶石以来[107],在世界其他地区的海洋沉积物中陆续发现了重晶石的存在[66,71,108-114]。
冷泉相关的重晶石的硫和氧同位素可被用作指示与其形成相关的硫酸盐的来源和地球化学记录的指标[115]。此外,重晶石的δ34S/δ18O比值可以用于评估其形成过程中硫酸盐还原的易变性和多样性[62,66,77]。在海洋沉积物中,微生物异化硫酸盐还原作用主要受OSR控制,研究发现,不同深度的现代孔隙水硫酸盐内检测到的δ18O-δ34S斜率为>0.7[77,116]。而与SR-AOM相关的现代和古代环境中的冷泉重晶石δ18O-δ34S 斜率较低,为0.27~0.50[62,66,71]。然而,同时针对冷泉重晶石的两个同位素δ34S和δ18O特征的研究较少,且不同学者对相关数据的解释仍存在分歧[71]。
Gong等[66]认为冷泉重晶石的多硫同位素组分的相关性可作为SR-AOM活动的特征参数,比单独基于δ18O-δ34S斜率解疑冷泉内硫的生物地球化学过程更可信。海底沉积物中保存下来的重晶石所显示的多硫同位素相关性(Δ33S-δ´34S)可以用来区分不同的硫酸盐还原环境[66]。这里的Δ33S值是由公式(7)所定义的δ´33S的差值:
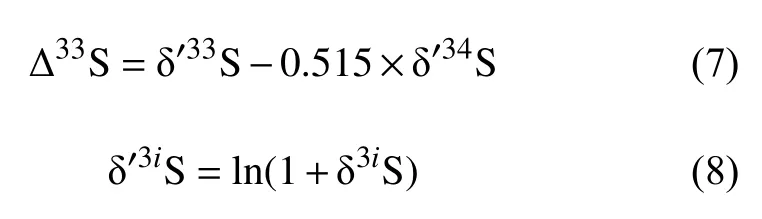
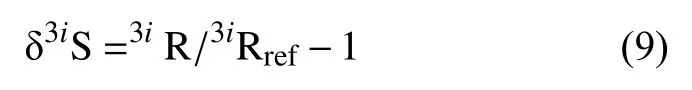
3iRref是硫参考标准内3iS和32S的丰度比。
在冷泉重晶石的形成过程中,受SR-AOM的影响,孔隙水硫酸盐 Δ33S-δ´34S 呈负相关性[66](图5),而正常海洋沉积环境中由OSR主导的孔隙水硫酸盐呈明显正相关性[71,91,100]。此外,当存在硫化物氧化作用和歧化作用时,Δ33S-δ´34S的相关性轨迹取决于净硫酸盐去除率而不仅仅是OSR反应速率,而这会在孔隙水硫酸盐剖面中显示出相比OSR更大的Δ33S-δ´34S斜率,在该环境中形成的冷泉重晶石也会记录这一变化[66]。
图5 OSR控制的孔隙水硫酸盐剖面和冷泉重晶石的Δ33S-δ´34S 轨迹比较[66]Fig.5 Comparison of Δ33S-δ´34S trajectories from OSR-controlled pore water sulfate profiles and cold seep barite [66]
综上,冷泉重晶石的δ18O-δ34S斜率对于识别OSR和SR-AOM具有一定指示意义。然而,受限于研究频率和不同学者存在的分歧,其应用仍有待商榷。而冷泉重晶石负的Δ33S-δ´34S相关性与OSR正的相关性之间的明显差别可以有效识别SR-AOM的存在。但需要注意的是,在SMTZ内的重晶石随着硫酸盐的消耗可能会发生溶解,因此,冷泉重晶石的应用范围在一定程度上是有限的。
3 多硫同位素数值模型应用
在前人研究的基础上,针对黄铁矿和重晶石的多硫同位素特征,分别介绍稳定状态盒模型和1-D反应模型。
3.1 稳定状态盒模型
为进一步揭示与SR-AOM相关的多硫同位素分馏机制,人们建立了稳定状态盒模型[91-92,117](图6)。本质是反演硫酸盐和硫化物(黄铁矿)的多硫同位素变化,其前提是在沉积物水界面附近形成的CAS和黄铁矿记录了硫酸盐和硫化物的硫同位素组分[23]。
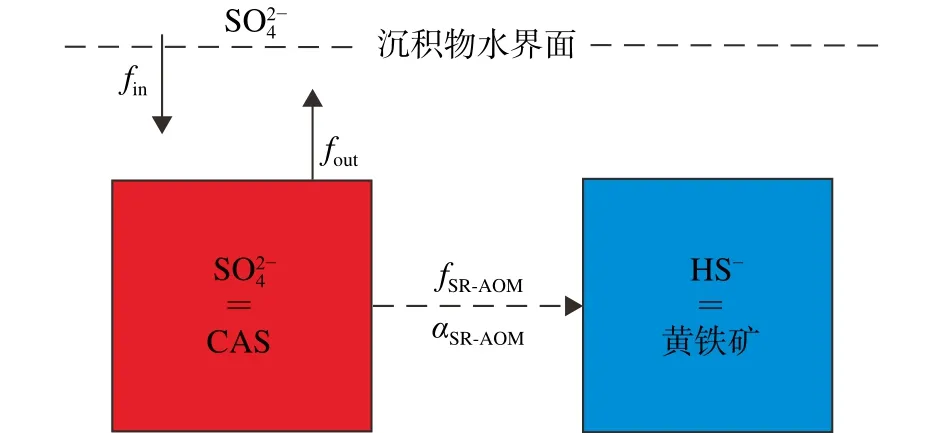
图6 SR-AOM盒状模型示意图fin和fout代表孔隙水硫酸盐进入沉积物和返回上层底水的通量(34S-32S 和33S-32S),fSR-AOM和34/33αSR-AOM分别与被固定的硫酸盐通量和硫同位素分馏相关(34S-32S和33S-32S)。该模型假设CAS和黄铁矿分别记录了孔隙水硫酸盐和硫化物的硫同位素特征,且同位素分馏与fin、fout以及CAS和黄铁矿的形成无关 [23]。Fig.6 Schematic representation of the box model for AOM-SRfin and fout represent the flux of porewater sulfate from and back to the overlying bottom water,whereas fAOM-SR and 34/33αAOM-SR the associated flux and sulfur isotopic fractions (34S-32S and 33S-32S), respectively.The model assumes that CAS and pyrite record porewater sulfate and sulfide,respectively, as well as no isotope fractionation associated with fin, fout and formation of CAS and pyrite [23].
硫同位素参与反应期间,同位异素体之间不同的反应速率造成的分馏结果表示如下:
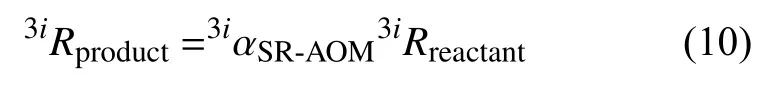
3iR代表34S/32S或者33S/32S的同位素比值,3iαSR-AOM代表产物和反应物沿着特定方式的分馏系数。Crémière 等[23]建立了33αSR-AOM=34αSR-AOM33λ关系式来表征34αSR-AOM和33αSR-AOM之间的关系,并且推断由SR-AOM产生的34αSR-AOM和33λSR-AOM与硫酸盐还原培养试验的结果相似,即这些参数改变具有线性关系[92,101,118-119]。
海洋沉积物中的硫存在以下转换方式:①通过扩散或混合进入沉积物的硫酸盐通量(fin);②从沉积物逃逸的硫酸盐通量(fout);③被固定的硫酸盐通量(fSR-AOM),如黄铁矿。研究表明,物理和生物补给过程可以将底水硫酸盐与沉积物孔隙水充分混合[120],尤其是在冷泉环境中。假设硫酸盐通量处在一个稳定状态,通量质量守恒描述为:
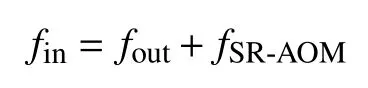
硫同位素在硫酸盐池和黄铁矿之间的净分馏描述如下:
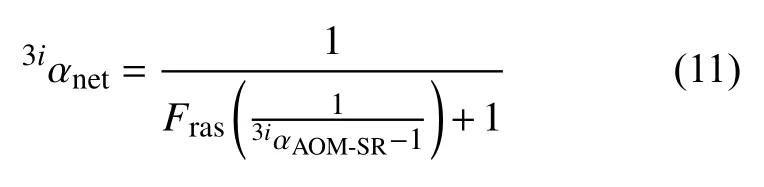
3iαnet是黄铁矿与孔隙水硫酸盐的同位素比,为进入沉积物且被SR-AOM消耗的硫酸盐,代表由硫酸盐还原作用产生的H2S和孔隙水硫酸盐池之间的分馏(现在分别以黄铁矿和CAS的形式保存)。
Crémière等[23]对北海和巴伦支海的黄铁矿和CAS应用稳定状态盒模型的研究表明,该模型的硫酸盐和硫化物δ34S-Δ33S轨迹随着分馏系数的增大逐渐更凹。这些轨迹涵盖了大多数的CAS数据,由此表明通过SR-AOM形成的黄铁矿的硫同位素分馏相对局限,即34αSR-AOM为 0.96~0.99[23]。如此低的34αSR-AOM表明,存在由高甲烷通量维持的高SRAOM速率[86]。
3.2 1-D成岩反应转移模型
1-D成岩反应转移模型在瑞利模型基础之上发展而来。该模型用于解释在SR-AOM作用下重晶石内的δ18O和δ34S之间的线性相关性[62]。此外,研究证明,该模型与孔隙水剖面中的硫酸盐浓度和同位素组分相匹配可得出与多硫同位素相关的特征α值[25,66,121]。
1-D成岩反应转移模型基于以下假设:①同一剖面不同深度孔隙水硫酸盐是稳定的;②受SRAOM影响的同一组重晶石的34α和33α是恒定的。Wing和Halevy[122]也表示1000ln34α值对外部硫酸盐浓度敏感性较弱,而在高细胞特异性硫酸盐还原率(cell-specific sulfate reduction rates,以下称作csSRR)下则对硫化物浓度不敏感;③1000ln34α值为-30‰~-10‰,比OSR相关的背景值偏正[86];④扩散和对流在质量转移中发挥了重要作用;⑤硫酸盐在扩散进入孔隙水时没有发生同位素分馏[123];⑥孔隙水中的硫酸盐还原速率与硫酸盐浓度直接相关[124]。
基于以上假设,硫酸盐的稳态质量守恒表征如下[124]:
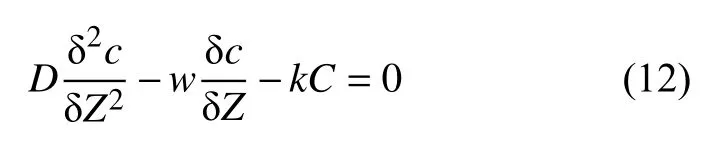
D表示沉积物孔隙水中的硫酸盐扩散系数,C是孔隙水硫酸盐浓度,Z是深度,k是硫酸盐还原作用反应速率常数;平流速度w是外部施加的流体速率和由压实作用造成的流体垂直向上速率的总和。边界条件为Z=0时,C=C0且C=0时,Z=∞,公式(12)解为:
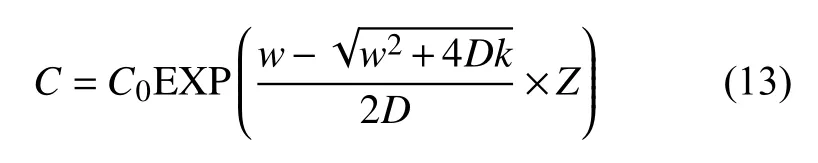
此外,通过公式(13)也可以计算不同硫酸盐同位异素体的浓度(32SO42-,33SO42-和34SO42-)。结果以δ´的形式标记,公式(13)重整为:
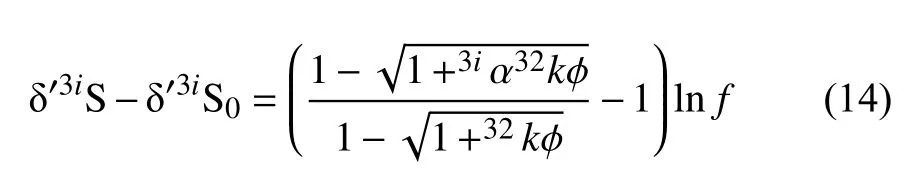
3iα=3ik/32k,3i=33 或 34 ,φ等 于 4D/w2,δ´3iS0为Z=0时的δ´3iS值,f为32C/32C0的比率。假设与硫酸盐扩散相关的同位素分馏为1,则Δ33S值的计算公式如下:
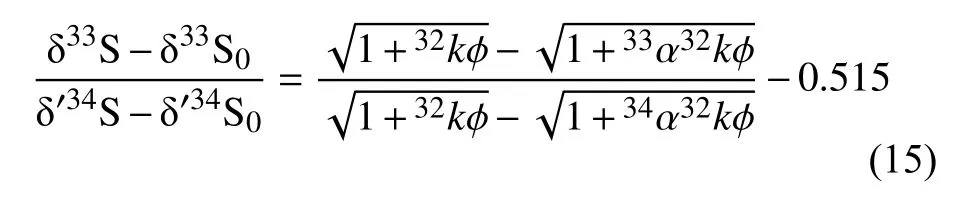
Δ33S0为Z=0时 的Δ33S值 。 公式(15)表明Δ33S值与δ´34S值呈线性相关,斜率由α、k和φ确定。
总体而言,盒状模型简单易行,不考虑盒子内反应即可反演SMTZ内黄铁矿的多硫同位素特征。然而,该模型并没有考虑氧化硫循环的影响(见2.2节),特别是在非稳定状态的冷泉环境中[125]。此外,在SMTZ之上的硫化孔隙水中的硫中间产物[90]也可直接转化为黄铁矿[23],这些情况都会直接或间接影响黄铁矿多硫同位素特征。此外,1-D成岩反应转移模型的缺点较为明显,因为Δ33S值与δ´34S值之间的线性关系是由同一个孔隙水剖面不同深度的硫酸盐浓度推测而来的,而实际研究中的硫酸盐样品却可能来自不同的点位。因此,这些样品的Δ33S值与δ´34S值之间的线性关系不一定能有效识别 Δ33S0,δ´34S0,α和k。然而,Gong 等[66]的研究结果表明,冷泉重晶石的Δ33S值与δ´34S值呈良好的线性关系(图7),现代海水硫酸盐的Δ33S值与δ´34S值处在这种线性关系延伸的范围内。图7结果表明,不同站位的样品具有相似的Δ33S-δ´34S斜率以及Δ33S0值和δ´34S0值(即海水硫酸盐的同位素组分),这表明在1-D成岩反应转移模型中,冷泉重晶石比孔隙水硫酸盐能更有效地揭示冷泉环境中的多硫同位素特征。
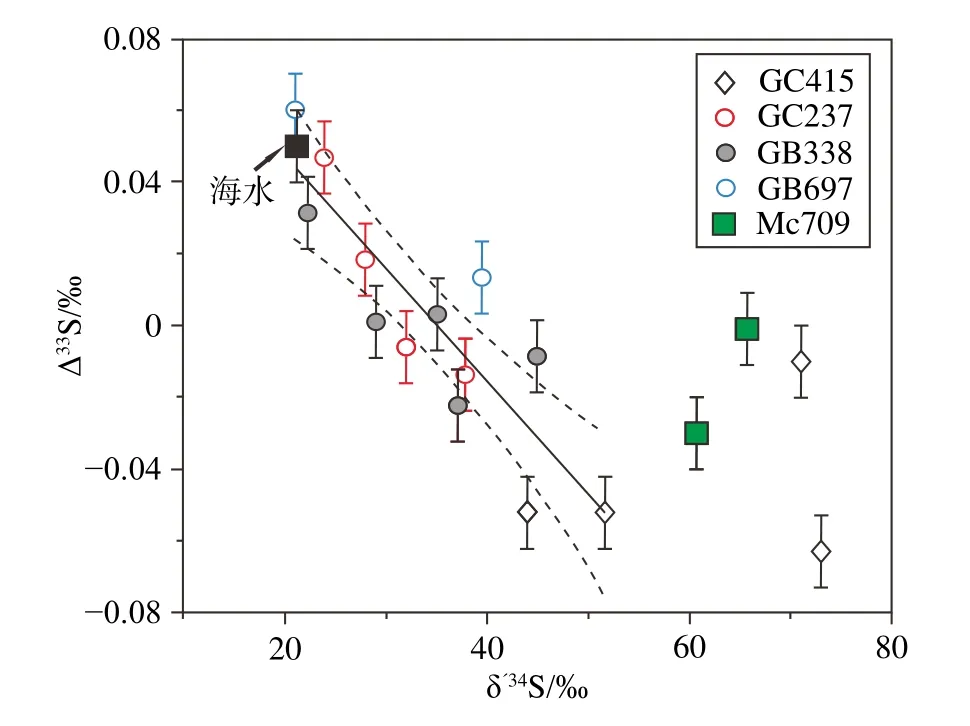
图7 现代沉积物中冷泉重晶石的Δ33S和δ´34S值黑色实线代表重晶石硫同位素的线性回归,其斜率为0.00314±0.00052;虚线之间的区域为95%的置信区间[66]。Fig.7 The Δ33S and δ´34S values of seep barites from modern sediments The black line indicates the linear fit for samples, which yields a slope value of 0.00314 ± 0.00052.The area within the dotted line corresponds to the 95% confidence interval [66].
4 结论与展望
自20世纪60年代以来,针对冷泉环境中甲烷与硫酸盐相互关系的研究已取得了长足进展。微生物研究表明,嗜甲烷厌氧古菌和硫酸盐还原菌的耦合机制可以揭示SR-AOM的内在机理,这为深入解读冷泉环境内复杂的生物地球化学过程提供了基础。而硫同位素研究表明,32S在硫化物中的优先迁移会造成浅层沉积物孔隙水硫酸盐富集34S,同时导致硫化物及黄铁矿亏损34S。但是随着埋藏深度增加,黄铁矿δ34S值会逐渐趋同于海水值。然而,OSR和SR-AOM都会引起显著的硫同位素分馏,因此单独使用δ34S值不能有效区分这两种生物地球化学过程。幸运的是,自然环境和实验室培养实验结果显示,SR-AOM成因黄铁矿负的δ34S-Δ33S相关性与OSR正的相关性存在显著区别,这对进一步区分自然环境下形成黄铁矿的不同生物地球化学过程具有指导意义。除此以外,冷泉重晶石不仅性质较为稳定,同时也保存了SR-AOM期间孔隙水的多硫同位素特征,这有利于从不同角度解析OSR和SR-AOM。稳定状态盒模型和1-D反应转移模型是分别研究SMTZ内黄铁矿和冷泉重晶石多硫同位素特征的有效工具。然而,虽然这些模型能较为准确地区分OSR和SR-AOM,但现阶段仍然缺乏与SR-AOM相关的多硫同位素数据,而相关实验室研究也相对较少。因此,进一步开展针对多硫同位素的自然环境和实验室研究,对于揭示冷泉系统内独特的生物地球化学过程具有重要意义。

