渤海沉积物中产甲烷途径及产甲烷菌群落特征
许晓晴,陈烨,甄毓,米铁柱,李晶,刘昌岭
1.中国海洋大学海洋环境与生态教育部重点实验室,青岛 266100
2.青岛海洋科学与技术国家实验室,海洋生态与环境科学功能实验室,青岛 266237
3.中国海洋大学环境科学与工程学院,青岛 266100
4.中国地质调查局青岛海洋地质研究所,青岛 266237
甲烷是大气中含量最丰富的碳氢化合物,可通过一系列复杂的氧化反应影响大气化学;同时,它也是重要的温室气体,100年内温室效应是二氧化碳的28倍,对全球变暖起着重要作用[1-2]。地球上大部分甲烷来源于微生物产甲烷作用,即通过环境中有机质厌氧发酵的最终途径产生。微生物介导的甲烷生成是地球上最大的甲烷来源,长期以来一直被认为是碳汇和生态碳流动的第一步。产甲烷菌广泛分布于海洋沉积物、淡水沉积物、水稻田土壤、动物胃肠道、地矿及地热环境中[3-4]。目前已知的产甲烷菌属于甲烷火球菌目(Methanopyrales)、甲烷八叠球菌目(Methanosarciniales)、甲烷杆菌目(Methanobacteriales)、甲烷球菌目(Methanococcales)、甲烷微球目(Methanomicrobiales)、甲烷胞菌目(Methanocellales)和马赛甲烷球菌目(Methanomassiliicoccales)[5]。最新研究还发现韦斯特古菌门、深古菌门等部分成员中也具有产甲烷菌代谢途径相关基因,推测也具有产甲烷能力[6-7]。自然界中能被产甲烷菌利用并产生甲烷的底物非常有限,仅包括甲酸盐、乙酸盐、甲基化合物(如甲胺、三甲胺、甲醇等)、CO2等几种结构十分简单的小分子物质[8-9]。产甲烷途径包括甲基营养型、乙酸代谢型和H2/CO2还原型3种类型,而自然界中的甲烷主要来自于乙酸发酵途径和H2/CO2还原途径[10]。产甲烷菌种类不同,不同区域对底物利用的类型不同,导致产甲烷途径有很大差别。
中国一些海域的产甲烷菌及产甲烷活性得到了充分研究并取得了相应成果。Zhou等[11]发现南海北部产甲烷菌的主要类群为Methanomicrobiales、Methanosarcinales和Methanomassiliicoccus。陈金泉和王风平[12]对珠江口沉积物的研究发现,产甲烷菌群落组成随深度增加而变化,在甲烷-硫酸盐过渡带上方及下方区域产甲烷优势菌群不同,产甲烷途径也不同,说明受陆源影响的河口地区甲烷代谢途径多样,不同沉积物深度产甲烷代谢类型可能不同。李小飞等[13]采用室内培养结合高通量测序技术,研究了长江口沉积物中厌氧区和富氧区产甲烷潜力及产甲烷菌群落组成特征,发现甲烷排放速率、甲烷产生潜力、产甲烷群落结构在厌氧区和富氧区沉积物中有明显差异,其中,厌氧区沉积物中产甲烷菌的优势群落为Methanococcoides、Methanosarcina和Methanosaeta,富氧区沉积物中则以Methanosarcina、Methanosaeta和Methanocella为主。
渤海属中国内海,与其他海域相比具有半封闭性、海床浅等特征,受各种人为活动影响较大,是国内众多海域中污染状况相对较重的海域[14-15]。同时,多条内陆河流汇集于此,相对于其他海域河流陆源性输入更为突出,河口地区缺氧或富营养化等造成生化因子发生明显改变,影响甲烷代谢循环过程[16]。在该海域所有入海河流中,黄河径流量最大,泥沙最丰富,向渤海输入了大量泥沙和有机质。但黄河输入物质中大部分在河口区沉积,仅小部分进行离岸输运,进入黄海[17]。研究表明,不同海域沉积物中产甲烷菌群落特征存在差异,而有机质、硫酸盐含量、甲烷浓度等环境因素对产甲烷菌群落结构及产甲烷活性影响较大[13,18]。此外,以往对渤海研究多集中于沉积物微生物多样性和溢油的微生物降解等方面,对渤海尤其是沉积物中产甲烷微生物研究较少。因此,分析比较渤海黄河近岸区域与离岸区域沉积物的产甲烷潜力与产甲烷菌群落特征具有重要意义[19-20]。
本文采集渤海典型站位沉积物样品,通过提供不同类型产甲烷底物进行培养,分析各样品中甲烷产量及产甲烷菌群落特征,综合评价沉积物中甲烷产生途径及产甲烷菌的群落多样性。研究结果将为深入了解渤海沉积物中微生物产甲烷途径提供科学依据。
1 材料与方法
1.1 样品采集
于2019年6月搭乘“中渔科102”号调查船对渤海海域进行调查,使用箱式采泥器采集M1站位和M7站位沉积物,再使用PVC管进行柱状样采集,每个站位各取4个平行样。M1站位(38°13'95''N,119°2'55''E)位于黄河入海口附近,水动力作用丰富,受陆源输入影响较大,M7站位(39°32'12''N,120°28'07''E)位于渤海中部泥质沉积区(图1),水动力相对较弱,受陆源影响较小,是渤海的低速沉积区域,2个站位地理位置在渤海中具有代表性[21]。M1站位柱状沉积物长约30 cm,M7站位柱状沉积物长约40 cm。本实验选取M1站位2~6 cm、20~24 cm和M7站位2~6 cm、20~24 cm、32~36 cm,即浅层、中层、深层沉积物作为目标层次进行后续分析培养工作,以便获得不同层次沉积物中较完整的产甲烷菌群落特征与产甲烷规律。所取4个平行样中,一个采用无菌注射器分别取目标层次沉积物3 mL,并注入装有6% NaOH溶液的顶空瓶中用于甲烷测定;一个采用Rhizon采样器取目标层次间隙水,于-20℃冰箱冻存,用于测定硫酸根离子含量;一个在4℃环境下保存用于产甲烷活性培养;另一个置于-20℃冰箱冻存,用于微生物总DNA提取和高通量测序。
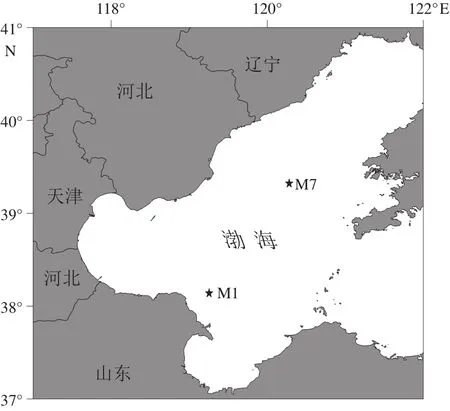
图1 渤海沉积物样品采集位点Fig.1 Sampling location in the Bohai Sea
1.2 沉积物中甲烷、硫酸盐以及总有机碳分析
甲烷作为微生物产甲烷作用的产物,对评价原位产甲烷作用有重要意义,而硫酸盐、总有机碳(total organic carbon, TOC)对产甲烷菌群落组成与原位产甲烷活性有重要影响,为分析其相互关系,对这些指标进行测定。沉积物中的甲烷含量采用静态顶空法[22]进行测定:首先,将装有沉积物的样品瓶剧烈震荡,再充分静置,使液相与气相之间的甲烷达到平衡后,取5 mL顶空气体注入气相色谱仪(7890B,安捷伦)进行甲烷测定。使用FID氢火焰离子化检测器进行检测,进样口设定温度为100 ℃,检测器温度为175 ℃,分离柱温度为50 ℃,载气为高纯氮气。间隙水中SO42-含量利用离子色谱(ICS-3000, Diones)进行测定。检测方式为电导检测,进样量为1 mL,柱温为30 ℃,检测池温度为35 ℃,淋洗液流速为 1.2 mL/min(阴离子)、1.0 mL/min(阳离子),抑制电流为 90 mA(阴离子)、69 mA(阳离子)。将沉积物样品冻干后研磨,称取30 mg置于银舟中用Milli-Q水湿润,采用盐酸熏蒸法去除碳酸盐,然后将样品放入烘箱加热烘干,接着使用元素分析仪(FLASH 2000, Thermo Fish Scientific Inc.)对沉积物中TOC进行测定[23]。
1.3 产甲烷培养实验
由于硫酸盐促进硫酸盐还原菌(sulfate-reducing bacteria, SRB)生长,对产甲烷菌生长产生竞争作用,同时也有可能发生甲烷厌氧氧化消耗甲烷,所以在产甲烷活性培养实验中,用去离子水配置不含硫酸盐的人工培养基(表1)[24]。配置培养基并灭菌后加入微量元素溶液[25](1 mL L-1)及维生素液[26](1 mL L-1)。再以高纯氮气(99.999%)进行通气置换氧气等气体后,置于厌氧培养箱(YQX-Ⅱ,上海星巴仪器设备有限公司)中。培养液内同时加入还原剂L-半胱氨酸盐(20 mg L-1)和刃天青显色剂(1 mL L-1)还原并指示环境的厌氧状态。
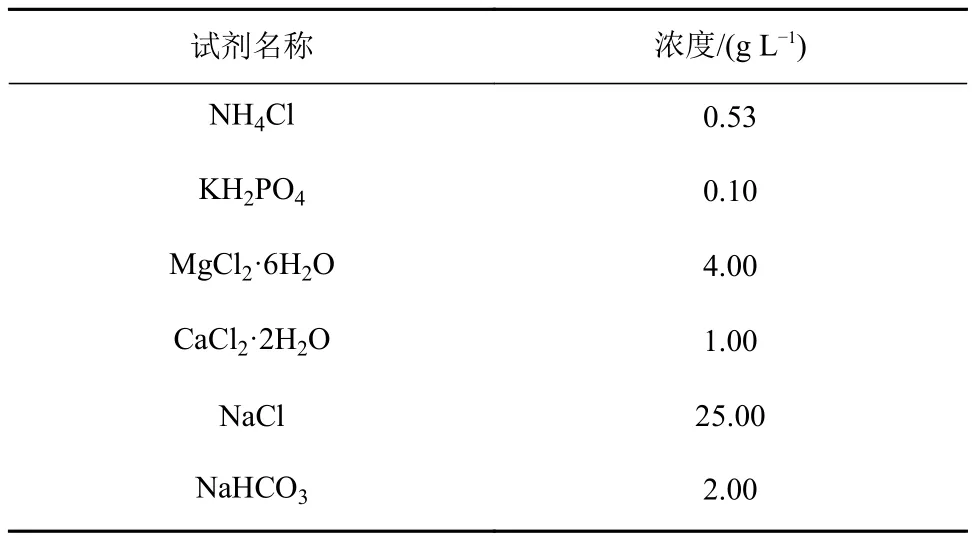
表1 培养基配方Table 1 Composition of the medium
之后,将4℃环境下保存的沉积物样品按1∶1比例与培养液混合,转移至120 mL培养瓶中,加入不同底物后,用丁基胶塞和铝盖密封。然后将培养瓶移出厌氧培养箱,在原位温度下(10 ℃)避光静置培养。设置6个实验组,每组分别添加H2/CO2(H2∶CO2为8∶2)、20 mmol甲醇、20 mmol一甲胺、20 mmol三甲胺、20 mmol乙酸钠、10 mmol 2-溴乙烷磺酸盐(2-bromoethane sulphonate, BES)以测定不同底物对厌氧产甲烷的影响,每组实验设置2个平行样。BES是一种甲烷生成的末端抑制剂,以将微生物甲烷生成与物理解吸区分开来[27]。
采用气相色谱仪(SP-3420A,北京北分瑞利分析仪器有限责任公司)测定甲烷产量。使用FID氢火焰离子化检测器进行检测,进样口设定温度100℃,单次进样 50 μL,检测器温度 150℃,分离柱为50℃,载气为氦气(UHP, 99.999%)。检测结果单位为%(v/v),通过理想气体状态方程得到某一时刻每克沉积物(干重)所产生的甲烷量(μmol)。培养瓶内某时刻甲烷产生量计算公式为:
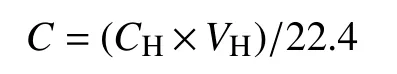
式中,CH为培养瓶上层气体中甲烷测定浓度,μL L-1;VH为上层气体体积,L。
1.4 DNA提取和高通量测序
取0.25~0.5 g沉积物,使用PowerSoil DNA Isolation Kit(Mo Bio, 美国)试剂盒按照手册提供的操作步骤提取样品DNA,采用1%琼脂糖凝胶检测DNA质量。使用添加Barcode序列的引物A519F(5'-CAGCCGCCGCGGTAA)和A915R(5'-GTGCTCC CCCGCCAATTCCT)对古菌 16S rRNA基因V4-V5区进行扩增和Illumina高通量测序。测序于Illumina Miseq PE300平台(上海美吉生物医药科技有限公司)完成。
在摄影领域,我为越南多样的文化和多彩的风光感到惊讶。整个国家仿佛是露天摄影棚,人们喜欢摄影。无论你是风光摄影师、街头摄影师,还是肖像和人文摄影师,这里都是一个绝佳的拍摄地。
1.5 数据分析
采用Fastp和FLASH软件对Miseq测序得到的双端序列数据进行优化。设置50 bp的窗口,将尾部质量值20以下的碱基序列过滤。经过质量控制后的序列进行双端序列拼接(最小重叠碱基长度为10 bp,且最大错配比例为0.2),并筛除不符合序列。根据序列首尾Barcode和引物区分样品,同时调整序列方向。通过Uparse软件平台按照97%相似性对所得非重复序列(不包括单序列)进行OTU聚类分析。通过与Silva数据库(Release132,http://www.arb-silva.de)进行比对,得到样本群落物种组成信息。采用Origin 2018软件绘制甲烷产量图、产甲烷速率图及古菌、产甲烷菌丰度图。本研究基因序列上传至NCBI Sequence Read Archive数据库(登录号:PRJNA715082)。
2 结果与分析
2.1 沉积物中甲烷、硫酸盐及总有机碳含量
沉积物中甲烷、硫酸盐浓度以及TOC含量如图2所示。M1站位中,20~24 cm甲烷浓度略低于2~6 cm;在M7站位中,随着深度的增加,甲烷浓度呈明显的升高趋势。两站位沉积物硫酸盐浓度较稳定,均略高于海水平均值(28 mmol L-1[28]),随深度无明显变化趋势。M7站位TOC含量明显高于M1站位。
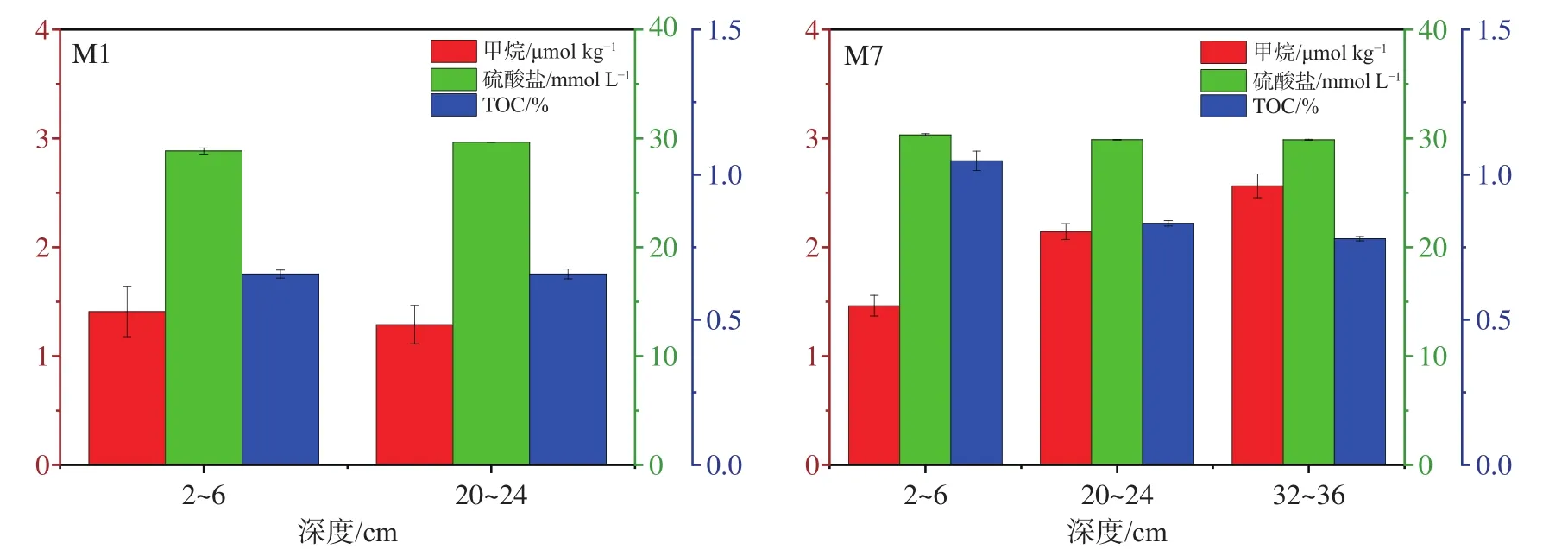
图2 甲烷、硫酸盐浓度和TOC含量Fig.2 Methane and sulfate and TOC contents
2.2 古菌群落特征
2.2.1 古菌群落多样性分析
利用高通量测序共得到114 755条古菌16S rRNA基因有效序列,每个样本序列条数为13 657~31 748。按97%序列相似性界定OTU,共获得1 105个OTU,每个样品的OTU为428~741(表2)。群落覆盖度为>99%,说明测序深度足以覆盖样品中绝大多数物种信息。M7站位古菌丰富度指数(Chao1)高于M1站位,说明M7站位较M1站位有更多的古菌种类。在5个沉积物样品中,M7 2~6 cm沉积物Shannon指数最低且Simpson指数最高,说明M7 2~6 cm群落多样性最低。除M7 2~6 cm外,M7站位其他样品的Shannon指数均高于M1,且Simpson指数均低于M1,证明M7站位其他层的群落多样性高于M1站位。同时,在M1和M7中,Shannon指数随深度逐渐增加,即古菌群落多样性随沉积物深度增加而增高。

表2 古菌群落多样性特征Table 2 Diversity characteristics of archaea community
测定到的古菌属于11个门,其中泉古菌门(Crenarchaeota)、阿斯加德古菌(Asgardaeota)和纳古菌门(Nanoarchaeota)为优势古菌。古菌在纲分类水平上的群落组成见图3。M1站2~6 cm和20~24 cm优势古菌均为深古菌纲(Bathyarchaeia)(相对丰度分别为42.7%和53.4%),M7站2~6 cm优势古菌为 Nitrososphaeria纲(相对丰度 57.1%),而20~24 cm和32~36 cm优势古菌均为深古菌纲(Bathyarchaeia)(相对丰度分别为53.2%和58.9%)。在两个站位中,随着沉积物深度增加,Bathyarchaeia和 Lokiarchaeia丰度增加,而 Nitrososphaeria和Nanoarchaeia丰度逐渐减小。
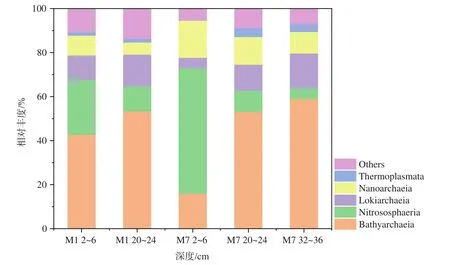
图3 沉积物中纲分类水平上古菌的相对丰度(相对丰度>1%)Fig.3 Relative abundance of the archaea at class level in the sediments of Bohai Sea (relative abundance >1%)
2.2.2 产甲烷菌群落特征
沉积物中产甲烷菌群落结构组成在属和目的分类水平上的相对丰度见图4。所获得产甲烷菌属于Ca.Methanofastidiosales、甲烷八叠球菌目(Methanosarciniales)、甲烷杆菌目(Methanobacteriales)、甲烷微球目(Methanomicrobiales)和马赛甲烷球菌目(Methanomassiliicoccales)。包括以下属:甲烷拟球菌属-(Methanococcoides)、甲烷八叠球菌属(Methanosarcina)、甲烷杆菌属(Methanobacterium)、甲烷短杆菌属(Methanobrevibacter)、产甲烷菌属(Methanogenium)、马赛甲烷球菌属(Methanomassiliicoccus)及Candiadatus Syntrophoarchaeum。其中,Methanococcoides以甲基物质为底物,Methanosarcina以乙酸、甲基物质和H2/CO2为底物,Methanobacterium、Methanobrevibacter、Methanogenium以H2/CO2为底物产甲烷,而Methanomassiliicoccus则利用H2还原甲基类化合物产甲烷[13,29-30]。
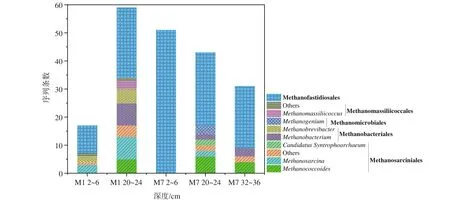
图4 沉积物中目、属分类水平上产甲烷菌的序列条数加粗字体为目名,其余为属名,相同底纹表示同一目分类。Fig.4 The number of sequences of methanogens at levels of order and genus in sediments of Bohai SeaBold font is the order name, and the rest is the genus name.Every shading indicates the same order classification.
在所有样品中Ca.Methanofastidiosales产甲烷菌均为主要优势群落,尤其是在M7 2~6 cm样品中。同时,甲烷八叠球菌目(Methanosarciniales)为M7 2~6 cm外其他样品的优势菌。样品M1 20~24 cm中,甲烷杆菌目(Methanobacteriales)是重要的产甲烷菌目。而甲烷微球目(Methanomicrobiales)只在M7 20~24 cm样品中获得,马赛甲烷球菌目(Methanomassiliicoccales)只在M1的2~6 cm和20~24 cm层样品中获得。
此外,在M1 2~6 cm沉积物中,还存在以乙酸、甲基物质和H2/CO2为底物的Methanosarcina,以H2/CO2为底物的Methanobrevibacter;在M1 20~24 cm沉积物中,也存在Methanosarcina和以H2/CO2为底物的Methanobacterium、Methanobrevibacter,同时还存在Methanomassiliicoccus及利用甲基物产甲烷的Methanococcoides[9,31-32]。M7 2~6 cm沉积物仅含Ca.Methanofastidiosales;在M7 20~24 cm样品中包括:Methanococcoides、Methanosarcina、Methanobacterium、Methanogenium和Candidatus Syntrophoarchaeum;M7 32~36 cm包括Methanococcoides、Methanobacterium。
2.3 沉积物产甲烷活性
沉积物样品在不同底物下甲烷产量如图5所示。在添加BES和乙酸钠后,所有样品均不产生甲烷,而在其他底物下有明显产甲烷现象。其中,沉积物样品均在以非竞争性底物(三甲胺、一甲胺、甲醇)下优先产生甲烷,并很快达到最大产量,H2/CO2底物组则在培养后期开始有少量甲烷产生。此外,样品中同一站位不同深度沉积物最大产甲烷量随深度递减,而同一深度中M7站最大甲烷产量高于M1站。
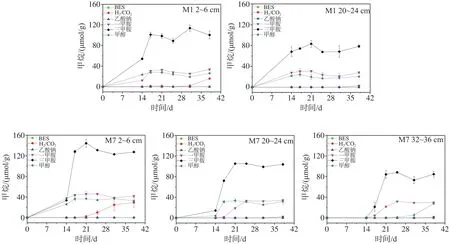
图5 渤海沉积物样品在不同底物厌氧培养过程中甲烷产量Fig.5 Methane production in the sediments from the Bohai Sea during the anaerobic incubation with different substrates
样品在不同底物下的平均产甲烷速率采用最大甲烷产量除以其达到最大产量所消耗时间来计算(图6)。在M1和M7站中,以三甲胺为底物时产甲烷速率最高,接着是一甲胺和甲醇,H2/CO2底物组则最低,而乙酸钠底物组不产甲烷。同等深度同一底物供给下,M7站沉积物产甲烷速率高于M1站;添加相同底物时,两站位产甲烷速率随沉积物深度增加而降低,以三甲胺为底物时最明显,其中M1站降低了33.23%,M7站则依次降低了27.01%和29.48%。
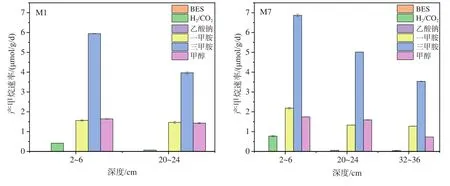
图6 渤海沉积物中添加不同底物的厌氧产甲烷速率Fig.6 Methane production rate in the sediments from the Bohai Sea during the anaerobic incubation with different substrates
2.4 产甲烷活性与产甲烷菌的相互关系
将环境样本所测得的不同产甲烷菌相对丰度与产甲烷速率进行比较发现,原位沉积物中未检测到乙酸营养型产甲烷菌,这一结果与产甲烷培养实验中乙酸钠底物组无甲烷产生相一致;其他不同途径产甲烷菌丰度与产甲烷速率一致性不显著(图7)。在M1站位中,20~24 cm样品所检测到的甲基营养型及H2/CO2还原型产甲烷菌相对丰度均高于2~6 cm样品,但是该层沉积物以三甲胺、一甲胺、甲醇及H2/CO2为底物时,产甲烷速率均低于2~6 cm沉积物。在M7站位中,2~6 cm沉积物中未检测到氢营养型产甲烷菌,但是该层沉积物在添加H2/CO2时产甲烷速率明显高于20~24 cm及32~36 cm沉积物。
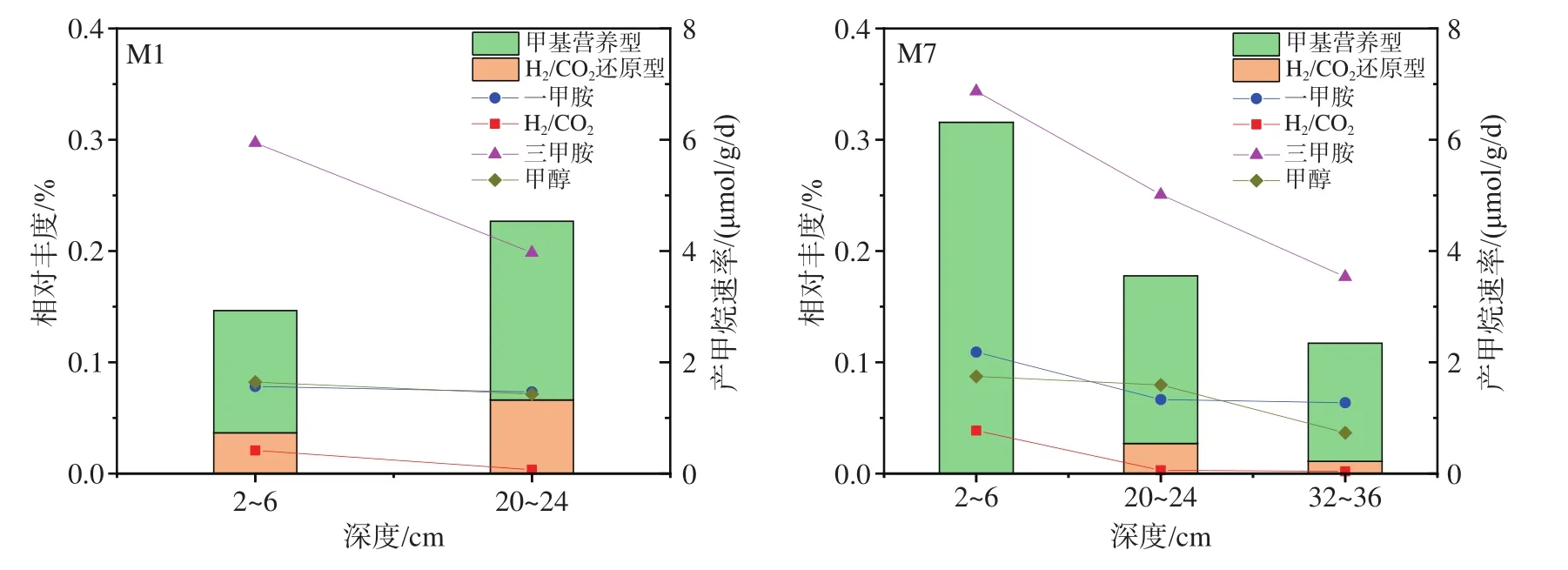
图7 产甲烷菌相对丰度及产甲烷速率Fig.7 Relative abundance of methanogens and methane production rates
3 讨论
3.1 甲烷产生底物
底物影响产甲烷途径和产甲烷潜力,不同底物可以导致不同的产甲烷菌活性和甲烷产生途径[5,33]。在产甲烷厌氧培养过程中以H2/CO2、甲醇、一甲胺、三甲胺、乙酸钠和BES为底物的不同实验组中,产甲烷规律表现出一定的差异:①同一站位同一底物下甲烷产生量随深度增加而降低。Zeleke等[34]对长江口泥滩沉积物中产甲烷菌分布特征进行研究后,发现表层沉积物中产甲烷菌具有更高的丰富度。因此猜测原位环境中表层沉积物富含大量有机质,为产甲烷微生物提供了充足的底物,致使上层沉积物具有更大的产甲烷活性。②添加产甲烷菌能够利用的小分子物质,经厌氧培养后可产生甲烷,同一样品,添加不同底物后甲烷产生量不同,以甲基类化合物为底物时甲烷生成量较高,而以H2/CO2为底物时生成量较低,添加乙酸钠底物的样品和添加BES的样品经过培养后均没有甲烷的生成。表明甲烷的产生是微生物发挥作用的结果,而充足的底物是甲烷产生的重要条件,乙酸钠底物组自身形成空白对照,证明原位沉积物中有机质未对实验结果有任何影响。由于三甲胺分子所含甲基数量为一甲胺与甲醇的3倍,因此,其产甲烷速率同样约为二者的3倍,而一甲胺与甲醇在产甲烷速率上没有较大差异。总体而言,甲基类物质为底物时产甲烷活性明显大于以H2/CO2为底物,这一点在其他学者的研究中也有所体现。Zhuang等[35-36]研究发现,在甲基类物质(一甲胺、三甲胺、甲醇等)浓度很低的原位环境中,产甲烷菌依旧可以利用其产生甲烷。Summons[37]也发现,在自然界高盐环境中,主要以代谢甲基类化合物(一甲胺、三甲胺、甲醇等)产甲烷。
底物通过改变产甲烷菌群落结构影响产甲烷活性的发挥,而不改变沉积物的原有产甲烷途径。同时,高通量测序结果证明,两站位沉积物样品中只存在甲基营养型产甲烷菌和H2/CO2还原型产甲烷菌。因此,根据以上培养实验与微生物测序结果得出结论,两站位沉积物中产甲烷途径以甲基营养型为主,同时含有H2/CO2还原型产甲烷。
3.2 硫酸盐浓度
在硫酸盐含量较高(>1 mmol L-1)的海洋沉积物环境中,硫酸盐还原菌在与产甲烷菌竞争共同底物(乙酸盐和H2)过程中占据优势地位,因此产甲烷菌的产甲烷过程受到一定限制,而甲胺、甲醇为非竞争性底物,可以被产甲烷菌迅速利用并产生甲烷[38-39]。本研究所测得间隙水硫酸盐含量均高于海水平均浓度(28 mmol L-1),因此在原位环境中,甲基型产甲烷菌占优势地位,但因为SRB很难完全限制产甲烷菌对H2的利用,因此,沉积物中仍含有较少量的氢营养型产甲烷菌。在培养实验末期,环境中硫酸盐被大量消耗,H2/CO2型产甲烷菌丰度随间隙水中硫酸盐浓度减小而增加,从而产生甲烷[40-42]。
这一结论在其他学者的研究中也有发现。在对地中海西部三角洲表层和次表层沉积物中不同基质和产甲烷途径下产甲烷作用的分析中,研究者发现在最顶部的表层沉积物中,还原甲醇产甲烷作用占甲烷总产量的98%,而在贫硫酸盐区,H2/CO2还原产甲烷则是主要途径,且对mcrA功能基因测序分析表明,产甲烷菌群落组成与不同底物下产甲烷活性分布基本一致[43]。而对墨西哥湾北部Orca盆地高盐沉积物的研究表明,非竞争性甲基化合物(甲醇、三甲胺、二甲基硫醚、二甲基磺酸盐)底物是生成甲烷的主要途径,氢营养型和乙酸还原型产甲烷途径则受到了硫酸盐的限制[35]。
3.3 原位TOC含量与甲烷含量
海洋生态环境中,绝大部分甲烷来源于产甲烷菌对有机质的厌氧降解,因此,原位沉积物中有机质含量对产甲烷活性具有重要作用。与多数研究相反,离岸海域M7站位整体TOC含量大于近岸海域M1站位,这与高立蒙[44]得出的结论相同。根据沉积物粒径和密度分级,在陆源有机碳散布与沉积过程中,水动力分选作用发挥了重要作用[45-46]。在M7站位所处的渤海中部地区,水动力较弱且为旋转流,细颗粒不断进行沉积,形成渤海中部泥质沉积区。在水动力分选作用下,有机碳赋存于细颗粒物并沉积,因此有机质含量较高。相反,在M1站位,虽邻近黄河口,但TOC含量低于M7站,原因可能为黄河悬浮颗粒物中约90%以上来源于黄土高原,有机碳本身含量较低(0.2%~0.8%)[47-48]。M7站有机质含量丰富,大分子有机物不断分解,为产甲烷菌提供充足的底物。因此,M7站产甲烷菌适应性与活性相比于M1站更强,代谢速率更快,具有更大的产甲烷速率与甲烷产量。这也为之后的研究提供思考,即不能简单地凭借是否近岸,是否有类似黄河径流等大量陆源物质输入而判断站位的有机质含量与相关微生物的代谢速率。
M7站位较M1站位TOC含量更高,产甲烷菌可利用更多底物进行产甲烷活动,因此,间隙水甲烷含量更高。由于采集样品时间临近夏季,黄河径流量较大,近黄河口地区水动力作用活跃,沉积环境不稳定,因此,M1站位甲烷含量没有体现较大差别。M7站沉积物间隙水甲烷含量随深度增加有升高趋势,这在其他较多研究中都有体现。吴自军[49]对珠江口及其临近海域沉积物间隙水甲烷进行测定,发现甲烷浓度在沉积物上部较低且变化幅度小,且随深度递增而增加,接近硫酸盐还原带底部时,甲烷含量急剧增大。臧昆鹏[50]对渤海耗氧海域进行研究,发现表层沉积物中甲烷含量较低,向深层波动上升。分析其原因,环境中甲烷含量是产甲烷与甲烷氧化共同作用的结果,除沉积物层外,底层海水是溶解甲烷的汇之一,表层沉积物中的甲烷部分扩散至底层海水并被微生物氧化消耗。可能因为M7站较高的有机质输入量和较大的沉积速率,限制了微生物对表层沉积物中有机质的降解,因此部分表层有机质未被分解而被直接埋藏,为深层沉积物环境产甲烷提供丰富碳源[49]。
3.4 古菌与产甲烷菌
古菌在深层沉积物的生物地球化学循环中发挥重要作用,在两站位沉积物中具有明显的垂向分布特征。在本研究中,深古菌纲(Bathyarchaeia)为主要优势古菌。Bathyarchaeia为沉积物中最主要的古菌类群,广泛分布于深海沉积物、近海沉积物、滨海湿地等各种环境中[51-53]。在沉积物有机碳再矿化过程中,易降解的有机碳被微生物优先利用,难降解的有机碳不断被埋藏,而Bathyarchaeia和Lokiarchaeia在埋藏有机碳的降解过程中发挥着重要作用[54-55],因此,随着沉积物深度增加,相对丰度增加,不断进行代谢,为深层沉积物中产甲烷作用提供底物,在产甲烷环境中扮演着重要角色。
甲烷的产生与产甲烷菌群落组成密切相关[5]。产甲烷菌是严格厌氧的古菌,只能利用简单化合物生成甲烷,部分产甲烷菌可以同时利用多种底物产甲烷[56-57]。本研究测序结果显示,Ca.Methanofastidiosales是沉积样品中占绝对优势地位的产甲烷菌,该类群能够以甲基类化合物为底物产生甲烷,属于甲基营养型产甲烷菌[58-59]。这类产甲烷菌很少以优势菌出现在以往的研究中,是同其他区域研究结果明显不同之处[60-61]。对原位沉积物的高通量测序结果显示,不同样品中产甲烷菌群落结构不同,优势群落利用底物存在差别,因此具有不同的产甲烷活性。
根据高通量测序结果,M1站位中存在Methanomassiliicoccales,而M7站位不存在。Methanomassiliicoccales是2012年在人类粪便中新分离出来的产甲烷菌,被列为产甲烷菌的第七个目[62]。目前,全球对Methanomassiliicoccales的发现相对较少,且多集中在陆地湿地、人和动物的胃肠道中,部分海洋沉积物中也有发现[63-64]。Cozannet[65]对全球86个样品(包括海洋沉积物、深海热液喷口、海底泥火山、泥炭土壤、湖泊、温泉、河流沉积物等)进行高通量测序分析发现,只有22个样品中检测出了Methanomassiliicoccales。M1站位于黄河入海口附近,且采样时间为夏季,黄河径流量较大,因此考虑为黄河径流将其带入。Methanogenium为海洋油气田沉积物的主要优势菌属,且推测与油气田形成有关[18],在甲烷含量较低的M1站中未检出。除共同优势菌属Ca.Methanofastidiosales外,M1站位和M7站位的第2大主要优势产甲烷菌属分别为Methanosarcina和Methanococcoides。其中,Methanosarcina是黄河中主要优势菌属,具有良好的环境适应性,是滨海地区重要的产甲烷菌并广泛参与碳循环,因此推测其由黄河径流输入M1站;而Methanococcoides是渤海原有的产甲烷菌,受黄河入海影响较小,在M7站位保持其优势菌属地位[4]。
3.5 产甲烷菌与产甲烷活性的相关性
产甲烷菌产甲烷速率与高通量测序结果不具有明显的相关性。尤其在M7站2~6 cm沉积物中没有检测到H2/CO2还原型产甲烷菌,但是在以H2/CO2为底物时,该层沉积物相对于同站位其他层次沉积物却具有更大的甲烷生成量。推测产生这一现象的原因为:本研究针对古菌的16S rRNA基因进行高通量测序,而原始样品中产甲烷功能菌群落丰度本身较小,且因为较高的硫酸盐含量,原位环境中H2/CO2还原型产甲烷菌较少,从而没有被检测出来。但是H2/CO2还原型产甲烷菌在培养过程中丰度逐渐增大,产甲烷作用不断增强,在培养后期获得较大的产量。所以,如果在培养结束时,分析产甲烷菌相对丰度与产甲烷速率的相关性,可能更能准确反映二者之间的相互关系,这为后续进一步研究提供了思路。
4 结论
(1)渤海M1、M7站位以甲基营养型产甲烷为主,同时具有H2/CO2还原型产甲烷途径,不存在乙酸发酵产甲烷途径。
(2)同一站点随着深度的增加,甲烷产生量逐渐减少,产甲烷速率相应降低。
(3)通过高通量测序技术发现古菌群落以Crenarchaeota、Asgardaeota和Nanoarchaeota为主。其中,M1 2~6 cm、M1 20~24 cm、M7 20~24 cm、M7 32~36 cm优势古菌均为Bathyarchaeia纲,M7 2~6 cm优势古菌为Nitrososphaeria纲。Ca.Methanofastidiosales在各样品产甲烷菌中占据优势地位。
致谢:感谢中国地质调查局青岛海洋地质研究所的贺行良老师在甲烷含量测定等方面提供的支持与帮助。

